大鼠佐剂性关节炎模型表现特征及评价指标①
李培培 解国雄 宋珊珊 黄 蓓 吴育晶 汪庆童 常 艳 张运芳 周爱武 刘丽华 张玲玲 魏 伟
(安徽医科大学临床药理研究所抗炎免疫药理学教育部重点实验室抗炎免疫药物安徽省工程技术研究中心,合肥230032)
类风湿关节炎(Rheumatoid arthritis,RA)是以损害滑膜、软骨和骨的一种慢性、炎症性自身免疫疾病[1]。大鼠佐剂性关节炎(Adjuvant arthritis,AA)模型在临床表现、病理学、免疫学改变和病理机制等方面与人RA有许多相似特征,是研究RA病理机制和评价治疗RA药物的较理想动物模型[2]。本文成功建立了大鼠AA模型,从整体和关节局部详细描述了大鼠AA模型的炎症表现特征,确立了大鼠AA模型的评价指标,包括全身评分、关节炎指数、关节肿胀数、足爪肿胀度、足爪X线摄片、踝关节病理等,旨在为建立AA模型研究RA病理机制及评价RA治疗药物提供实验依据。
1 材料与方法
1.1 动物 Sprague-Dawley(SD)大鼠,雄性,清洁级,体重130~170克,购自上海西普尔-必凯实验动物有限公司,许可证号码:SCXK(沪)2008-0016。在恒温(24±2)℃、光照周期12小时∶12小时环境中饲养1周后实验。
1.2 试剂 卡介苗(Bacillus Calmette-Guerin,BCG):北京生物制品所产品,生产批号:20090324。液体石蜡:天津市化学试剂三厂生产,生产批号:20020928。
1.3 方法
1.3.1 实验分组 SD大鼠,随机分为2组,即对照组、模型组,每组10只。
1.3.2 大鼠AA模型的制备 将BCG 80℃水浴灭活1小时,与高压灭菌的石蜡充分研磨、混匀,制成10 mg/ml完全弗氏佐剂(Complete Freund adjuvant,CFA),于每只大鼠右后足跖皮内注射CFA 0.1 ml致炎[3]。对照组用生理盐水同法注射。
1.4 检测指标
1.4.1 临床体征评分
(1)全身评分 从炎症出现后,每隔3~4天进行全身表现评分,评分标准包括:耳:0=无结节和发红症状,1=一只耳朵结节和发红症状,2=两只耳朵结节和发红症状;鼻:0=无结缔组织肿胀,1=明显结缔组织肿胀;尾:0=无结节,1=有结节;前足爪:0=无肿胀,1=一个前足爪肿胀,2=两个前足爪肿胀;后足爪:0=无肿胀,1=一个后足爪肿胀,2=两个后足爪肿胀。每只大鼠最多评8分[4]。
(2)关节炎指数 从炎症出现后,每隔3~4天进行关节炎指数评分,观察每组大鼠的继发病变。每只足爪的关节炎指数评分标准:0=正常;1=踝关节出现红斑和轻微肿胀;2=踝关节到跖关节或掌关节红斑和轻微肿胀;3=踝关节到跖趾关节或掌关节出现红斑和中度肿胀;4=踝关节到趾关节出现红斑和重度肿胀。每只大鼠最多评12分[5]。
(3)关节肿胀数 从炎症出现后,每隔3~4天计算关节肿胀数。每只足爪计1个踝关节(或腕关节)和5个指(趾)关节,每只大鼠最多24个关节肿胀[4]。
(4)足爪肿胀度测定 致炎前用足容积测量仪测量每个大鼠左后足(非致炎侧)容积,从炎症出现后,每隔3~4天测量左后足容积,求出继发侧足爪肿胀度(Δml=︱注射后的足爪容积-注射前的足爪容积︱)[5]。
1.4.2 踝关节X片 致炎后第35天(d35)将各组大鼠四肢关节置XR/d型数字化X线成像系统下摄片(KV:40~50 V;mA:100 mA,S:32 ms),观察骨质破坏情况。关节破坏分软组织肿胀、骨侵蚀和关节间隙改变三个方面进行评价[6]:
(1)软组织肿胀 0分=正常;1分=轻微的肿胀;2分=中度肿胀;3分=严重肿胀。
(2)骨侵蚀评分 0分=正常;1分=可疑或一个微小局部病灶;2分=二个局部病灶或病灶总表面积≤50%;3分=三个以上的病灶或病灶总表面积>50%;4分=关节面完全破坏,或出现骨缩小。
(3)关节间隙 0分=正常;1分=间隙内出现可疑或一个微小局部病灶;2分=关节间隙出现狭窄,比正常关节间隙减少25%至50%;3分=关节强直或关节间隙消失。每只大鼠评价两前足爪和继发侧后足爪,评分最大值为9。
1.4.3 踝关节病理学观察 麻醉后脱臼处死大鼠,剪下后足炎性踝关节,分别用10%甲醛固定,不同浓度梯度乙醇逐级脱水,石蜡包埋、切片、进行HE染色,Olympus光学显微镜观察组织病理变化,并进行病理评分。踝关节病理分别从滑膜细胞增殖、细胞侵蚀、血管翳形成、炎症和骨质侵蚀评分[4]。
(1)滑膜细胞增殖评分:0=无增殖;1=轻微增殖,2~4层滑膜细胞;2=中度增殖,4层以上滑膜细胞;3=滑膜细胞过度增殖,侵蚀软骨和骨,关节间隙消失。
(2)细胞侵蚀评分:0=无侵蚀;1=较少的1至2个细胞侵蚀灶;2=2至5个的局部细胞侵蚀灶;3=5个以上广泛细胞侵蚀到关节囊。
(3)血管翳评分:0=无改变;1=两个部位出现血管翳;2=四个部位出现血管翳,伴有软骨表面的侵蚀;3=四个以上部位出现血管翳或二个部位出现大范围的血管翳。
(4)炎症评分:0=正常;1=轻度炎症,出现1个聚集物或少量散在炎性细胞(T细胞、B细胞、巨噬细胞及浆细胞)浸润;2=中度炎症,2个或2个以上的白细胞聚集物;3=重度炎症,炎细胞大量浸润,大量白细胞聚集,分散浸润明显。
(5)骨质侵蚀评分:0=正常;1=微量侵蚀,1~2个小的浅部位;2=少量侵蚀,1~4个中等大小和深度部位;3=中等侵蚀,5个以上部位,局部侵蚀到骨皮质;4=重度侵蚀,多重损伤,局部或完全侵蚀到骨皮质;5=广泛损伤,皮质穿透骨长度的25%以上。
1.5 统计学处理 数据分析应用SPSS11.5软件处理,计量资料以x±s表示,组间比较采用单因素方差分析(ANOVA),P<0.05被认为有统计学意义。
2 结果
2.1 临床体征观察情况 大鼠AA原发病变主要表现为早期致炎部位的局部炎症反应,在发病过程中,大鼠精神萎靡、毛发失去光泽、多发性关节肿胀和活动障碍等。免疫后18小时,右后足爪肿胀达高峰,持续3天后逐渐减轻,免疫后d8再度肿胀;免疫后d13,模型组大鼠对侧足爪开始出现继发病变,d15模型大鼠普遍出现足爪红肿,d19~d28达高峰,且发病率高达90%以上。表现为对侧(左后肢)和前肢的肿胀,耳朵、鼻和尾根部出现“关节炎”结节等(图1),模型组大鼠在d15全身评分明显升高,d19~d28达高峰(图2)。
2.2 AA大鼠关节炎指数评分情况 第一次免疫后,每隔3天,进行关节炎指数评分。d11开始,AA大鼠关节炎指数升高,随着病程延长,关节炎指数逐渐升高,d19~d28关节炎指数达高峰(图3A、B)。
2.3 AA大鼠足爪肿胀度改变情况 AA大鼠在免疫后d7开始,每隔3天,对各组大鼠进行足爪容积测定,d11开始,与对照组比较,各组AA大鼠足爪肿胀度升高,随着病程延长,肿胀度逐渐升高,免疫后d35,足爪仍然肿胀明显。与对照组比较,有显著性差异(P<0.01见图4)。
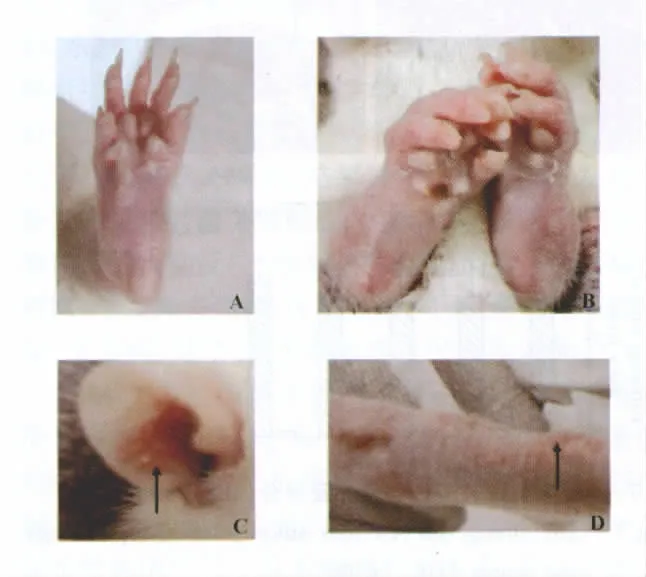
图1 肉眼观察AA大鼠足爪肿胀及全身病变情况Fig.1 Macroscopic observation on paw swelling and global assessment of AA rats

2.4 AA大鼠关节肿胀数的变化情况 免疫后d11开始,各组AA大鼠关节肿胀数明显增加,随着病程延长,关节肿胀数逐渐升高,d19~d28 AA大鼠关节肿胀数达高峰(图5A、B)。
2.5 AA大鼠四肢关节X线摄片变化及评分 免疫后d35,进行大鼠四肢踝关节足爪X线摄片,观察关节骨质破坏情况。并从软组织肿胀、骨侵蚀和关节间隙三方面进行评分。可见AA模型大鼠继发侧关节软组织肿胀,骨质疏松、骨密度降低,骨侵蚀病灶明显可见,关节间隙狭窄甚至消失。软组织肿胀,骨侵蚀和关节间隙狭窄评分值,与对照组比较,有显著性差异(P <0.01,图6A、B)。
2.6 AA大鼠踝关节病理的影响 HE染色结果表明,正常大鼠关节滑膜由1~2层衬里细胞覆盖在结缔组织脂肪组织间质的表面构成。AA大鼠可见关节腔积液,炎性渗出,滑膜细胞增生(3~8层)水肿,血管翳形成,滑膜组织内小血管增生,扩张充血,大量炎细胞浸润,以淋巴细胞、单核巨噬细胞和浆细胞慢性炎细胞浸润为主。严重者炎性滑膜组织侵犯软骨表面和软骨下骨,或者炎性滑膜组织靠近关节软骨;部分模型组滑膜组织表面或组织内可见纤维素渗出或纤维素样坏死物。滑膜增生、细胞浸润、血管翳、炎症和骨侵蚀评分值增高,与正常组比较,有显著性差异(P <0.01,图7A、B)。
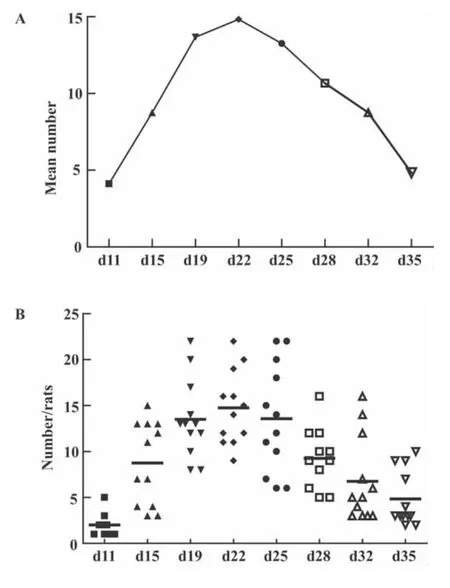
图5 AA大鼠关节肿胀数的变化Fig.5 Swollen joint count assessment on AA rats

图6 AA大鼠继发侧踝关节足爪X线摄片变化情况Fig.6 The X-ray radiography changes on the AA rats'secondary side ankle joint

图7 AA大鼠踝关节病理变化及评分(HE,×100)Fig.7 The change on AA rats ankle joint histopathology and scores(HE,×100)
3 讨论
AA是由细菌学家Freund 20世纪50年代创立,又称弗氏佐剂性关节炎[7]。AA发病机制为:结核杆菌是相对分子量为65 kD的热休克蛋白(HSP65),与AA大鼠关节软骨的自身抗原HSP60有高度相似的保守序列,可以通过分子模拟和交叉反应,激活处于静止状态的针对Ⅱ型胶原为主的淋巴细胞克隆,从而引起自身免疫反应[8]。AA大鼠表现为多发性外周关节炎,关节局部红肿,严重致关节畸形。病理变化为增生性滑膜炎,关节软骨破坏、骨侵蚀,伴有炎性细胞浸润。这些临床表现与人RA相似,是筛选和研究治疗 RA药物的较理想模型。
目前我国建立AA模型的大鼠主要是SD大鼠、Wistar大鼠、Lewis大鼠三个品系。有学者报道,上述三种品系大鼠诱导胶原性关节炎模型,Wistar和SD大鼠发病率和发病程度均明显高于Lewis大鼠,Wistar和SD大鼠发病率无显著性差异,但发病程度SD大鼠明显高于Wistar大鼠。三种品系大鼠雌雄之间发病率和发病程度无明显差异[9]。
国内外的研究结果从形态学、血清学、超微结构的变化等多个特征来考察模型的建立情况,结果显示大鼠AA表现为周围性关节炎,关节肿胀,滑膜充血,水肿,滑膜排列疏松、紊乱,慢性病变则表现为滑膜组织的不规则增厚,关节软骨破坏等[7,10]。本实验中,我们采用完全弗氏佐剂诱导SD大鼠,成功建立了AA关节炎模型,结果显示AA大鼠原发侧和继发侧足爪及踝关节肿胀,活动障碍,该模型既有关节局部的炎症反应,也有全身表现症状,如大鼠精神萎靡、毛发失去光泽、体重下降、耳朵、鼻和尾根部出现“关节炎”结节,且发病率高达90%左右等。
RA关节组织破坏的机制十分复杂,成纤维样滑膜细胞(Fibroblast-like synoviocytes,FLS)是滑膜组织的重要组成成分,通过分泌各种细胞因子、蛋白酶类、花生四烯酸代谢产物等,在关节破坏过程中发挥重要作用[11,12]。从其病理特征来看,关节滑膜和周围结缔组织异常增殖,血管翳的形成是关节软骨侵蚀、关节破坏的主要原因。本研究发现AA大鼠关节X线摄片可见关节软组织肿胀,骨质疏松、骨密度降低,骨侵蚀病灶明显可见,关节间隙狭窄甚至消失;病理学结果表明,AA大鼠滑膜细胞增生,血管翳形成,滑膜组织内小血管增生,扩张充血,大量炎细胞浸润,严重者炎性滑膜组织侵犯软骨表面和软骨下骨。
综上所述,本实验建立的AA大鼠模型的关节炎症表现明显,其病理改变和体征较大程度反映了RA的发病情况,关节炎指数、足爪X线片、踝关节病理等是评价AA模型的主要指标。本实验描述的AA大鼠建立方法和主要评价指标,为进一步了解RA发病机制和评价新药提供了重要的实验依据。
1 Seyler T M,Park Y W,Takemura S et al.BLyS and APRIL in rheumatoid arthritis[J].J Clin Invest,2005;115(11):3083-3092.
2 宋珊珊,张玲玲,魏 伟.实验性关节炎动物模型建立及病理机制研究进展[J].中国药理学通报,2011;27(12):1648-1652.
3 Chang Y,Wu Y,Wei W et al.Therapeutic effects of TACI-Ig on rats with adjuvant-induced arthritis via attenuating inflammatory responses[J].Rheumatology(Oxford),2011;50(3):862-870.
4 Wang D,Chang Y,Wei W et al.Therapeutic effects of TACI-Ig on rat with adjuvant arthritis[J].Clin Exp Immunol,2011;163(2):225-234.
5 张玲玲,陈 尹,魏 伟et al.芍药苷对胶原诱导性关节炎大鼠滑膜细胞Ras和Raf21表达的影响[J].中国新药杂志,2008;17(5):375-380.
6 Van der Heijde D M.Radiographic imaging:the‘gold standard'for assessment of disease progression in rheumatoid arthritis[J].Rheumatology(Oxford),2000;39(1):9-16.
7 Abd El-Rahman R S,Suddek G M,Gameil N M et al.Protective potential of MMR vaccine against complete Freund's adjuvant-induced inflammation in rats[J].Inflammopharmacology,2011;19(6):343-348.
8 Bevaart L,Vervoordeldonk M J,Tak P P.Evaluation of therapeutic targets in animal models of arthritis:how does it relate to rheumatoid arthritis?[J].Arthritis Rheum,2010;62(8):2192-2205.
9 赵宏艳,王 燕,肖 诚 et al.不同品系、不同性别对大鼠CIA发病情况的比较研究[J].中国中医基础医学杂志,2010;16(9):761-764.
10 陈柏松,徐玉东,钟淑琦et al.大鼠佐剂性关节炎模型的建立与评价[J].哈尔滨医科大学报,2005;39(6):489-491.
11 Tamai M,Kawakami A,Tanaka F et al.Significant inhibition of TRAIL-mediated fibroblast-like synovial cell apoptosis by IFN-gamma through JAK/STAT pathway by translational regulation[J].J Lab Clin Med,2006;147(4):182-190.
12 Chen Q,Wei W.Effects and mechanisms of chaenomeles speciosa on collagen-induced arthritis in rats [J].Int Immunopharmacol,2003;3(4):593-608.

