IL-1β和IL-18在鼠巨细胞病毒播散性感染中的表达及意义①
李旭芳 刘玲玲 刘兴楼 舒赛男 李 革 方 峰
(华中科技大学同济医学院附属同济医院儿科,武汉430030)
人巨细胞病毒(Cytomegalovirus,CMV)在我国感染率很高,由于CMV是一种弱致病因子,多数感染者无症状或潜伏感染,但在免疫功能下降或缺陷时可引起疾病[1]。胎儿和新生儿全身播散性感染可致头小畸形、智力障碍、生长发育迟缓和神经性耳聋、室间隔缺损等畸形;器官移植、艾滋病及其他免疫缺陷患者,可增加病死率和器官移植排斥率。迄今的研究证实病毒诱生的细胞因子在CMV致病性中发挥了重要作用[2]。研究发现多种细胞因子与CMV感染密切相关,如IL-6、IL-8、TNF、IFN及MIP-1α等[2]。近年来研究发现的炎性体能够识别病原微生物后活化,使 procaspase-1转化为活性形式caspase-1,并促进细胞因子IL-1β和IL-18的成熟释放[3-7],这两种细胞因子主要参与多种自身免疫性疾病的炎性损伤过程并介导适应性免疫应答[8]。本研究旨在证实鼠CMV(Murine cytomegalovirus,MCMV)感染后炎性体活化并促进IL-1β和IL-18的成熟释放,为探寻多靶点抗CMV感染的治疗奠定基础。
1 材料与方法
1.1 实验动物 SPF级雌性BALB/c小鼠,4周龄,购自湖北省医学科学院实验动物中心,饲养在同济医院动物室洁净层柜内。实验前适应性饲养3天。
1.2 病毒 MCMV Smith株(美国德克萨斯大学健康卫生中心惠赠)在BALB/c小鼠唾液腺中增殖,唾液腺匀浆经空斑试验测定病毒平均感染性滴度3×106PFU(plaque-forming unit)/ml。
1.3 实验分组 实验小鼠随机分为播散性感染组和模拟感染对照组各16只。播散性感染组接种含MCMV 5×103PFU的唾液腺匀浆0.2 ml,模拟感染对照组接种等量正常唾液腺匀浆[9]。感染后第0(接种前)、3、7和14天,各组分别随机处死4只小鼠。乙醚麻醉,眼球摘除取血后断颈处死,无菌分离血清及脾、肝、肺和唾液腺等组织经4%多聚甲醛固定后石蜡包埋,部分脾组织-80℃冰箱保存。
1.4 标准空斑试验检测组织MCMV感染性滴度参照参考文献[10],采用本实验室自制的小鼠胚胎肺成纤维细胞作为敏感细胞,检测MCMV感染后3、7和14天小鼠肝、肺和唾液腺组织中MCMV感染性滴度。检测低限为0.2 PFU/mg组织(湿重)。
1.5 Western blot法检测脾细胞中caspase-1表达将分离的感染后0、3、7、14天的脾组织经蛋白裂解液裂解研磨后,应用BCA蛋白测定试剂盒测定裂解上清中的蛋白浓度。各样本取50 μg蛋白上样,经12%SDS-PAGE胶电泳分离蛋白并转至PVDF膜上。转膜后用含0.05%Tween 20的TBS封闭2小时,分别用 caspase-1兔多克隆抗体(1∶400,BioVision 公司)及兔抗鼠GAPDH(1∶1 000,Santa Cruz公司)孵育过夜,羊抗兔结合HRP的特异性IgG二抗(1∶10 000,Santa Cruz公司)孵育 1小时后,化学发光法显色曝光。采用HMIAS-2000型全自动医学彩色图像分析系统分析测定目的条带的吸光值并分析与GAPDH条带的相对吸光值。
1.6 ELISA法检测血清IL-1β和IL-18水平 采用双抗体夹心ELISA法检测感染后0、3、7和14天分离的血清中IL-1β和IL-18(R&D Systems)浓度。
1.7 免疫组化法检测组织中IL-1β和IL-18表达唾液腺、肺、肝组织石蜡切片经脱蜡至水化后进行以下操作:抗原热修复;0.3%H2O2阻断内源性过氧化氢酶;正常小牛血清封闭20分钟;分别加入抗鼠IL-1β(Peprotech公司,1∶100稀释)和抗鼠 IL-18抗体(Biovision公司,1∶100稀释),4℃ 孵育过夜;加入生物素标记的羊抗鼠室温孵育15分钟;加入链霉素标记的生物素蛋白孵育10分钟;DAB显色5~10分钟;苏木紫复染;1%盐酸酒精分化后脱水透明,中性树胶封片。应用Olympus BX41显微系统摄像。每个标本选择3张切片,每张切片选择5个高倍镜视野(×200)进行观察,对组织中IL-1β和IL-18阳性细胞数进行半定量分析,阳性细胞数以每高倍镜视野中阳性细胞个数表示(cells/hpf)。
1.8 统计学方法 所有数据应用Microsoft Excel软件分析,计量资料以x±s表示,两组间比较应用t检验,双侧检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 MCMV感染后组织病毒滴度 肝组织病毒滴度于MCMV感染后3天升高,其后迅速下降,14天即检测不到;肺组织病毒滴度低于检测低限,而唾液腺组织病毒滴度呈逐渐增高趋势(图1)。
2.2 Western blot法检测脾细胞中caspase-1表达状况 模拟感染对照组感染后procaspase-1和caspase-1的表达相对稳定;与模拟感染对照组相比,播散性感染组感染后3天 procaspase-1和caspase-1的表达明显升高[相对吸光值分别为(1.226±0.355)vs(0.361±0.033),t=4.22,P <0.01和(1.193±0.165)vs(0.332 ±0.095),t=7.84,P <0.01],随后逐渐恢复正常(图2)。

图1 标准空斑试验检测MCMV感染鼠组织病毒滴度Fig.1 The levels of viral titer in tissues of MCMV-infected mice quantified by standard plaque assay
2.3 血清中IL-1β和IL-18水平 模拟感染对照组血清IL-1β和IL-18水平相对稳定;与模拟感染对照组相比,播散性感染组感染后3天血清IL-1β和IL-18明显升高并达峰值[(分别为(112.72±5.20)vs(47.86±4.35)pg/ml,t=16.57,P <0.01和(42.74±4.23)vs(22.60 ±2.82)pg/ml,t=6.85,P <0.01],随后逐渐降至正常水平(图3)。
2.4 免疫组化法检测组织中IL-1β和IL-18表达模拟感染组和播散性感染组0天各组织中无IL-1β和IL-18阳性细胞;而播散性感染组感染后3天唾液腺组织中可见少量IL-1β和IL-18阳性表达细胞,并呈进行性增加,至感染后7天明显增多达峰值,14天减少。而肺和肝组织仅于感染后3天可见少量阳性表达细胞,其后未见阳性表达 (图4)。
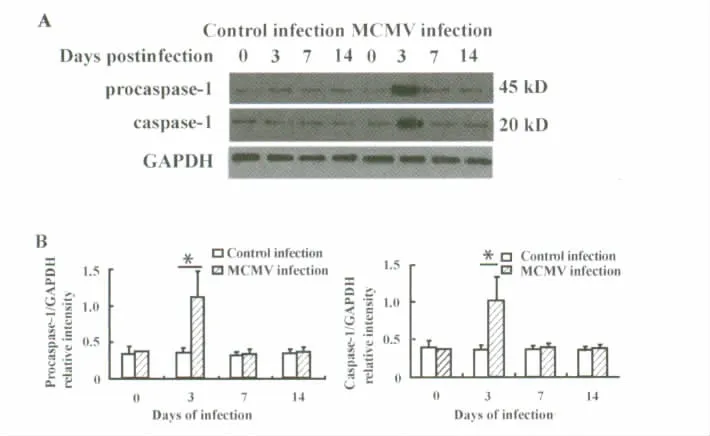
图2 Western blot检测脾细胞中procaspase-1和caspase-1的表达状况(A)及相对吸光值(B)Fig.2 The expressions of procaspase-1 and caspase-1 in spleen detected by Western blot(A)and the relative intensity(B)
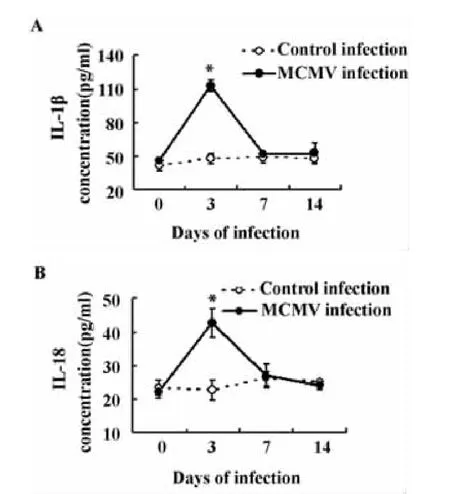
图3 ELISA法检测血清中IL-1β(A)和 IL-18(B)水平Fig.3 The levels of IL-1β(A)and IL-18(B)in sera measured by ELISA
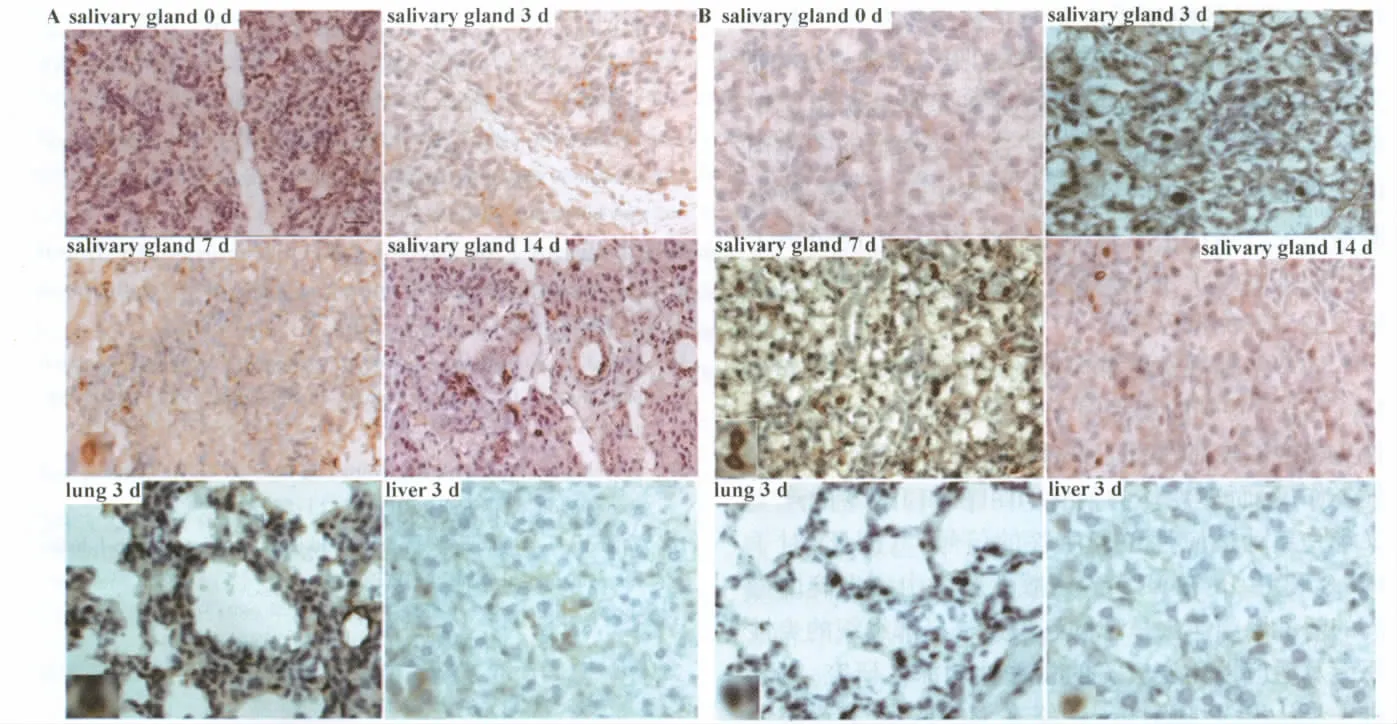
图4 免疫组化法检测组织中IL-1β(A)和IL-18(B)表达(×200)Fig.4 The expressions of IL-1β(A)and IL-18(B)in tissues detected by immunohistochemistry(×200)
3 讨论
机体清除病原体的天然免疫应答需要巨噬细胞和抗原提呈细胞募集到感染部位,产生促炎细胞因子[11]。MCMV能够诱导巨噬细胞中 AIM2(Absent in melanoma 2)炎性体介导的NF-κB和caspase-1的活化[12-14]。NF-κB 的活化能够产生 TNF-α、IFN-γ等多种炎性因子,已有研究显示这些炎性因子能够明显抑制肝细胞内病毒的复制而不损伤肝细胞,主要介导肝细胞非损伤性抗细胞内病毒效应[15,16]。
本组实验证实了MCMV感染后3天procaspase-1的募集及转化为活性caspase-1增加,同时其下游的炎性因子IL-1β和IL-18在血清中的成熟释放明显增加,说明了MCMV感染后炎性体形成及活化增加。IL-1β最初是作为内生致热源被人们所认识,其与发热、感染及损伤密切相关,能够进一步诱导和激活很多炎性分子,如磷酸酯酶A2、花生四烯酸环氧合酶(COX)等从而造成组织损伤;此外,IL-1R信号的表达有助于Th17细胞的增殖,还能够通过直接增强B细胞的增殖或间接上调T细胞共刺激分子的表达而增强体液免疫应答[17]。IL-18以往称为IFN-γ诱导因子,主要增强Th1细胞的增殖及IFN-γ的产生;近年来的研究发现还能够增强Th1细胞、NK细胞表达Fas配体而介导细胞毒作用,上调NF-κB的表达和活性,增强其他促炎因子的产生,加重局部组织继发性损伤[18]。这些研究说明 IL-1β和IL-18在机体的免疫反应尤其是抗感染免疫中具有双刃剑的作用。而本研究发现的IL-1β和IL-18在不同组织中的不均一性表达(尤其是唾液腺组织中明显高表达)至少部分说明了这两种细胞因子作用的靶细胞可能不同于 TNF-α、IFN-γ等,在肝、肺等脏器的炎性损伤中发挥非主导作用,这可能是由于不同的细胞因子环境影响了不同的靶器官的炎性反应及适应性免疫应答。
MCMV播散性感染模型的建立有助于阐明MCMV感染后特殊的细胞因子在介导炎症反应及适应性免疫应答中的作用。IL-1β和IL-18具有明显的促炎作用,而炎性体的活化、IL-1β和IL-18的产生又都是启动适应性免疫应答的信号[7],因此,对于IL-1β和IL-18在MCMV播散性感染中病毒滴度最高的唾液腺组织中呈现的高表达与局部组织的炎性反应及适应性免疫应答的相关性的深入研究,对于进一步认识多细胞因子网络在MCMV感染致病性中的作用具有重要意义。
1 董永绥,方 峰.巨细胞病毒和巨细胞病毒感染的诊断[J].中华儿科杂志,1999;37(7):397-398.
2 熊书君,方 峰.细胞因子与HCMV致病性关系初探[J].国外医学(病毒学分册),2004;11(6):176-179.
3 Burckstummer T,Baumann C,Bluml S et al.An orthogonal proteomic-genomic screen identifies AIM2 as a cytoplasmic DNA sensor for the inflammasome[J].Nat Immunol,2009;10(3):266-272.
4 Fernandes-Alnemri T,Yu J W,Datta P et al.AIM2 activates the inflammasome and cell death in response to cytoplasmic DNA[J].Nature,2009;458(7237):509-513.
5 Hornung V,Ablasser A,Charrel-Dennis M et al.AIM2 recognizes cytosolic dsDNA and forms a caspase-1-activating inflammasome with ASC[J].Nature,2009;458(7237):514-518.
6 Roberts T L,Idris A,Dunn J A et al.HIN-200 proteins regulate caspase activation in response to foreign cytoplasmic DNA[J].Science,2009;323(5917):1057-1060.
7 Van De Veerdonk F L,Netea M G,Dinarello C A et al.Inflammasome activation and IL-1β and IL-18 processing during infection[J].Trends Immunol,2011;32(3):110-116.
8 Martinon F,Mayor A,Tschopp J.The inflammasomes:guardians of the body[J].Annu Rev Immunol,2009;27:229-265.
9 徐 翼,方 峰,向稚丹 et al.小鼠巨细胞病毒全身播散型感染模型的建立[J].临床儿科杂志,2008;26(6):517-520.
10 徐 翼,方 峰,向稚丹et al.小鼠巨细胞病毒性心肌炎模型的建立[J].中华心血管病杂志,2005;33(4):360-363.
11 Brodsky I E,Medzhitov R.Pyroptosis:macrophage suicide exposes hidden invaders[J].Curr Biol,2011;21(2):72-75.
12 Hornung V,Latz E.Intracellular DNA recognition[J].Nat Rev Immunol,2010;10(2):123-130.
13 Rathinam V A,Jiang Z,Waggoner S N et al.The AIM2 inflammasome is essential for host defense against cytosolic bacteria and DNA viruses[J].Nat Immunol,2010;11(5):395-402.
14 Fernandes-Alnemri T,Yu J W,Juliana C et al.The AIM2 inflammasome is critical for innate immunity to francisella tularensis[J].Nat Immunol,2010;11(5):385-393.
15 Cavanaugh V J,Guidotti L G,Chisari F V.Inhibition of hepatitis B virus replication during adenovirus and cytomegalovirus infections in transgenic mice[J].J Virol,1998;72(4):2630-2637.
16 Luca F V,Francis V C.Cytokine-induced viral purging-role in viral pathogenesis[J].Current Opinion Microbiology,1999;2(4):388-391.
17 Patrick J S,Michael F M,Thirumala-Devi K.Inflammasomes and autoimmunity[J].Cell,2011;17(2):57-64.
18 Fantuzzi G,Dinarello C A.Interleukin-18 and interleukin-1 beta:two cytokine substrates for ICE(caspase-1)[J].J Clin Immunol,1999;19:1-11.

