柠檬汁清除DPPH自由基能力及实验方法比较研究
周 玥,张 娜,林太凤,钟儒刚
(北京工业大学生命科学与生物工程学院,北京100124)
柠檬汁清除DPPH自由基能力及实验方法比较研究
周 玥,张 娜*,林太凤,钟儒刚
(北京工业大学生命科学与生物工程学院,北京100124)
应用电子顺磁共振(EPR)和紫外-可见分光光度计(UV-Vis)两种方法研究美国加州和中国广西柠檬汁清除DPPH自由基的能力。结果表明,EPR方法测得加州和广西柠檬汁的半数清除率EC50值分别为54.53%和32.73%;UV-Vis方法测得加州和广西柠檬汁的EC50值分别为46.41%和30.41%,并且DPPH自由基清除率与柠檬汁浓度呈现良好的正相关性。统计学分析结果表明,两种实验方法的实验结果之间无显著性差异,测试方法对实验结果无显著性影响,两种方法均可用于柠檬汁对DPPH自由基清除能力的研究。
电子顺磁共振,紫外可见分光光度计,柠檬汁,DPPH自由基
Abstract:The DPPH radical scavenging capacities of California lemon juice and Guangxi lemon juice were determined using electron paramagnetic resonance(EPR) and ultraviolet-visible spectroscopy(UV-Vis).The EC50values for California and Guangxi lemon juice measured by EPR method were 54.53%and 32.73%,respectively,and the corresponding vales measured by UV-Vis method were 46.41%and 30.41%,respectively.The study revealed good positive correlation between DPPH radical scavenging rate and lemon juice concentration.In addition,statistical analysis indicated that the results were not significantly influenced by methods.In conclusion,both the two methods could be used for analysis of DPPH radical scavenging capacities of lemon juice.
Key words:electron paramagnetic resonance;ultraviolet-visible spectroscopy;lemon juice;DPPH radical
自由基是人体新陈代谢时产生的一系列活性分子,可与蛋白质、核酸作用导致细胞和组织器官的损伤,进而诱发多种疾病,如癌症、心血管功能障碍等[1-2]。因此具有低毒、高效自由基清除能力的天然抗氧化剂引起了国内外学者的极大关注[3]。柠檬属于芸香科柑橘属柠檬,富含类黄酮、维生素C、类胡萝卜素等多种抗氧化活性成分[4-7],是一种极具开发潜力的天然抗氧化剂。DPPH(2,2-联苯基-1-苦基肼基)是一种稳定存在的有机氮自由基,广泛应用于体外抗氧化剂能力研究[8-9]。目前测定抗氧化剂清除DPPH自由基能力的主要方法是紫外-可见分光光度计法,随着相关技术的成熟,EPR法开始逐渐应用于此领域。电子顺磁共振(EPR)是一项直接检测含有未成对电子物质的光谱技术,该方法基于DPPH自由基在3500G左右具有特征峰,信号强度与抗氧化剂浓度及反应时间成反比的原理进行测定[10-11]。紫外-可见分光光度计法(UV-Vis)基于DPPH在515nm左右有特征吸收峰,抗氧化剂提供氢原子将DPPH上的单电子还原使其颜色减弱,据其吸光值的减少量来评价自由基的清除程度[8,12]。目前,关于柠檬的研究多集中于果皮、果肉中活性物质的分离及提纯等方面[4,7],而对其清除自由基能力的研究鲜有报道。本文采用电子顺磁共振和紫外可见分光光度计两种方法研究美国加州和中国广西柠檬汁清除DPPH自由基的能力,以探究柠檬的抗氧化性能,为其作为抗氧化剂的开发利用提供理论基础和实验依据。
1 材料与方法
1.1 材料与仪器
国产柠檬 产地中国广西;进口柠檬 产地美国加州;2,2-联苯基-1-苦基肼基(DPPH) 美国Sigma公司;无水甲醇 一级色谱纯,天津四友精细化学品有限公司。
A-300电子顺磁共振仪 德国Bruker公司;UV-3010紫外可见分光光度计 日本HITACHI公司;5810R台式高速大容量离心机 德国Eppendorf公司。
1.2 实验方法
1.2.1 柠檬汁的制备 制备参考冯翠萍的方法[13]并略作改动。选取新鲜柠檬,洗净、切块、榨汁并过滤。滤液经11000r/min离心取上清液制得柠檬汁。使用无水甲醇稀释果汁,配制体积百分比浓度(V/V)为10%、20%、40%、60%、80%的柠檬汁溶液,冷藏保存。
1.2.2 DPPH溶液的配制 储备液配制:准确称取DPPH固体粉末0.0710g,用无水甲醇溶解并定容于100mL容量瓶,配制成1.80mmol/L DPPH储备液,冷藏避光保存。使用液配制:准确移取5mL储备液于50mL容量瓶,用无水甲醇定容至刻度,配制成0.180mmol/L DPPH使用液,使用液需现用现配。
1.2.3 EPR参数设定 中心磁场 3524.970G;扫场宽度200.000G;微波频率9.842GHz;微波功率20.17mW;调制频率100kHz;调制幅度2.00G。
1.2.4 EPR法测定柠檬汁对DPPH自由基的清除能力 取不同浓度的加州和广西柠檬汁,按照表1进行加样,反应30min后用50μL毛细管吸取一定量反应混合液装入保护管,置于谐振腔中进行测试。以谱图中3507G处峰高表示DPPH自由基的强度,按式(1)计算柠檬汁对DPPH自由基的清除率。

式中:I1:未加柠檬汁时DPPH原始信号强度,使用无水甲醇代替样品液;I2:加入柠檬汁后DPPH的信号强度。

表1 EPR实验加样表Table 1 Sample composition for EPR experiment
1.2.5 UV-Vis法测定柠檬汁对DPPH自由基的清除能力 取不同浓度的加州和广西柠檬汁,按照表2进行加样,反应时间为30min,采用1cm比色皿测定混合液在514nm处的吸光值(Abs)。按式(2)计算柠檬汁对DPPH自由基的清除率。

式中:A1:未加柠檬汁时DPPH原始吸光值,使用无水甲醇代替样品液;A2:柠檬汁与无水甲醇混合液的背景吸光值;A3:加入柠檬汁后DPPH的吸光值。

表2 UV-Vis实验加样表Table 2 Sample composition for UV-Vis experiment
1.2.6 实验数据分析 采用SPSS12.0统计学软件对两种方法测定同一样品的两组数据进行单因素方差分析[14]。在显著性水平α=0.05的条件下,先进行Levene检验以确定方差齐性,再进行方差分析以探讨该两组数据之间是否存在显著性差异。
2 结果与分析
2.1 EPR法测定柠檬汁对DPPH自由基的清除能力
分别选取6种浓度的加州和广西柠檬汁进行测试,以磁场强度为横坐标,信号强度为纵坐标绘制柠檬汁清除DPPH自由基的电子顺磁共振波谱图,如图1所示。
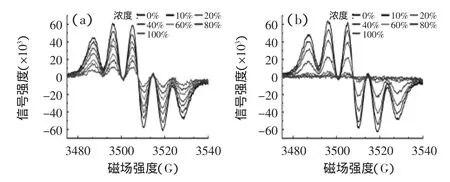
图1 加州(a)和广西(b)柠檬汁清除DPPH自由基的电子顺磁共振波谱图Fig.1 EPR signals of DPPH radicals in the presence of California(a)and Guangxi(b)lemon juice
由图1可知,DPPH自由基特征峰中心磁场均在3507G,自由基波谱信号强度均随柠檬汁浓度的增加而显著减小,说明柠檬汁的浓度越大,对DPPH自由基的清除作用越强。进一步分析可知,加州柠檬汁随浓度的增大,自由基信号减弱趋势较为平稳;而广西柠檬汁在浓度60%时,自由基信号强度锐减并趋于零,说明两种柠檬汁对DPPH自由基的清除能力存在差异。
实验中每种浓度进行三组平行实验,根据式(1)计算清除率并取平均值,以DPPH自由基清除率(%)对柠檬汁体积百分比浓度(%)作图,见图2。
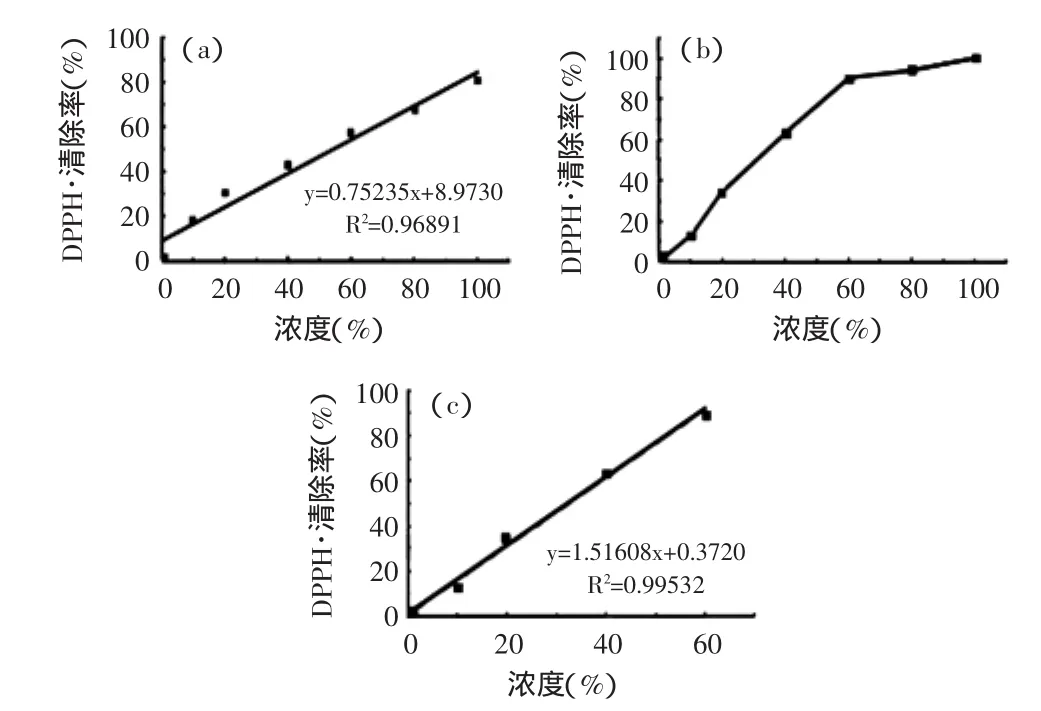
图2 加州(a)和广西(b)、(c)柠檬汁DPPH自由基清除能力与浓度的关系Fig.2 The correlation between DPPH radical scavenging rate and lemon juice concentration of California(a)and Guangxi(b),(c)
由图2可知,在一定浓度范围内,DPPH自由基清除率随柠檬汁浓度增加而逐渐升高。浓度为60%的广西柠檬汁与浓度100%的加州柠檬汁自由基清除效果相当,且清除率接近100%。进一步分析可知,加州和广西柠檬汁分别在0~100%和0~60%浓度范围内,自由基清除率与浓度之间呈现较好的线性关系。通过计算得出:加州和广西柠檬汁清除DPPH自由基的半数清除率EC50值(DPPH比起始强度减少50%时所对应的清除剂浓度)分别为54.53%和32.73%。说明此实验中测定的广西柠檬汁对DPPH自由基的清除能力优于加州柠檬汁。
2.2 UV-Vis法测定柠檬汁对DPPH自由基的清除能力
图3为DPPH自由基溶液及加入柠檬汁溶液后的紫外-可见分光光谱图。从图3中可以看出,DPPH溶液在326nm和514nm处有特征吸收峰,加入浓度为40%和100%的柠檬汁后,514nm处吸收峰明显下降,且柠檬汁在此处无特征吸收峰,故选择514nm为本实验的检测波长。
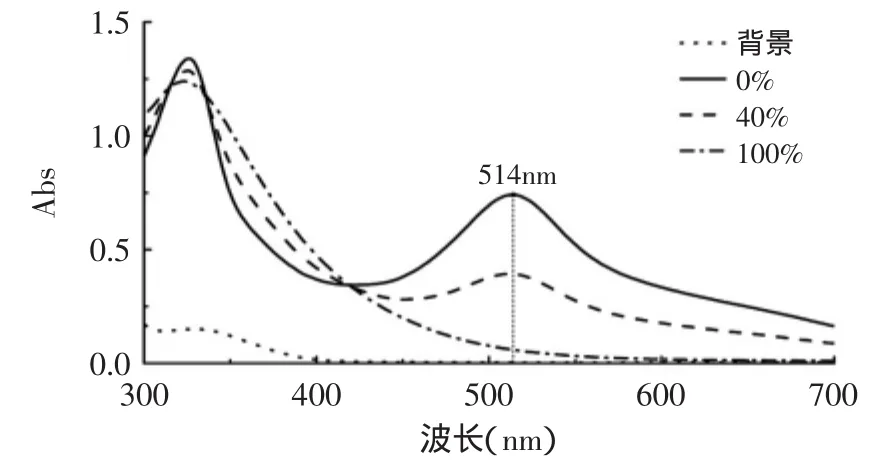
图3 DPPH自由基溶液的紫外-可见光谱图Fig.3 UV-Vis signals of DPPH radicals
实验对6组不同浓度的加州和广西柠檬汁分别进行测试,每种浓度进行三组平行实验,根据式(2)计算清除率并取平均值,得到不同体积百分比浓度柠檬汁对DPPH自由基清除率的量效关系,见图4。
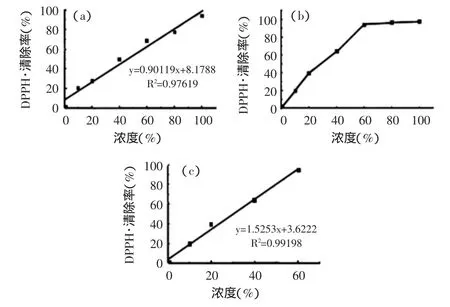
图4 加州(a)和广西(b)、(c)柠檬汁DPPH自由基清除能力与浓度的关系Fig.4 The correlation between DPPH radical scavenging rate and lemon juice concentration of California(a)and Guangxi lemon(b),(c)
结合图3~图4可以看出:柠檬汁对DPPH自由基的清除率随浓度的变化趋势与紫外谱图中一致。60%浓度的广西柠檬汁自由基清除率接近100%与浓度为100%的加州柠檬汁清除程度相当。进一步分析可知,对于加州和广西柠檬汁,其自由基清除率与浓度呈现较好线性关系的浓度范围分别是0~100%和0~60%,与EPR法的实验结果一致。加州和广西柠檬汁清除DPPH自由基的EC50值分别为46.41%和30.41%。说明此实验中所测定的广西柠檬汁对DPPH自由基的清除能力优于加州柠檬汁。由此可见,EPR法和UV-Vis法在柠檬汁清除DPPH自由基能力的测定上具有可比性。
2.3 实验结果的统计学分析
为了探讨方法因素对实验数据有无显著性影响,采用SPSS软件对EPR法和UV-Vis法测定同一样本(加州或广西柠檬汁)的两组实验数据进行单因素方差分析,结果如表3所示。方差齐性Levene检验结果表明,加州和广西柠檬汁显著性指标p值分别为0.206和0.785,均大于显著水平0.05,说明两种方法测试同一样本的两组实验结果方差齐性,可进行方差分析。方差分析结果表明,加州和广西柠檬汁的F值分别为0.660和0.070,均小于统计分布F分布数值表中的F0.025(17,17)值2.673[15],同时加州和广西柠檬汁的显著性指标p值分别为0.442和0.793,均大于显著水平0.05,说明两种方法测试同一样本的实验结果之间无显著性差异,即柠檬汁对DPPH自由基清除率受方法因素的影响不显著,两种方法均可用于柠檬汁对DPPH自由基清除能力的研究。
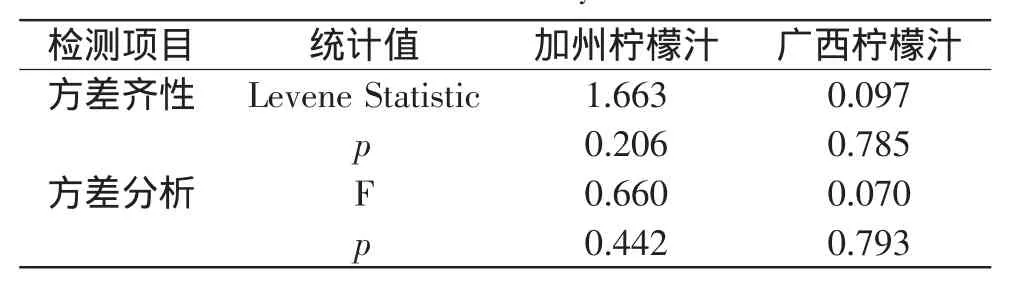
表3 单因素方差分析Table 3 One factor analysis of variance
已有文献报道,柠檬汁中富含的类黄酮及抗坏血酸具有很强的抗氧化作用[6,16],其中类黄酮化合物主要以类黄酮糖苷形式存在,通过向自由基提供氢原子或与其形成芳氧基基团而达到清除自由基的目的[2,17]。总抗坏血酸是重要的水溶性抗氧化剂,具有很好的生物利用性,分为L-抗坏血酸和和L-脱氢抗坏血酸两种形式,柠檬汁中主要以L-抗坏血酸的形式存在,向自由基提供氢原子使之失活,自身转变为L-脱氢抗坏血酸[6,18]。本实验中,DPPH是一种稳定的深紫色有机氮自由基,加入柠檬汁后生成浅黄色的2,2-联苯基-1-苦基肼,致使自由基信号减弱。由上述实验可知,加州和广西柠檬汁均对DPPH自由基具有较好的清除能力。
3 结论
运用电子顺磁共振和紫外可见分光光度计两种方法分别对加州和广西柠檬汁清除DPPH自由基的能力进行测定。实验结果表明,加州和广西柠檬汁均对DPPH自由基具有较好的清除能力,且清除率与果汁浓度成正相关性,在此实验中所测定的广西柠檬汁对DPPH自由基的清除能力优于加州柠檬汁。统计学分析结果表明,两种方法测试同一样本的实验结果之间无显著性差异,即方法因素对测试结果无显著性影响,两种方法均可用于柠檬汁对DPPH自由基清除能力的研究。
[1]Fearon I M,Faux S P.Oxidative stress and cardiovascular disease:Novel tools give(free) radical insight[J].Journal of molecular and cellular cardiology,2009,47(3):372-381.
[2]Benavente-García O, Castillo J, Marin F R, et al.Uses and Properties of Citrus Flavonoids[J].Journal of Agricultural and Food Chemistry,1997,45(12):4505-4515.
[3]Brewer M S.Natural antioxidants:Sources,compounds,mechanisms of action,and potential applications[J].Comprehensive Reviews in Food Science and Food Safety,2011,10(4):221-247.
[4]Ramful D,Bahorun T,Bourdon E,et al.Bioactive phenolics and antioxidant propensity of flavedo extracts of Mauritian citrus fruits:Potential prophylactic ingredients for functional foods application[J].Toxicology,2010,278(1):75-87.
[5]Di Vaio C,Graziani G,Gaspari A,et al.Essential oils content and antioxidant properties of peel ethanol extract in 18 lemon cultivars[J].Scientia Horticulturae,2010,126(1):50-55.
[6]Gonzalez-Molina E,Dominguez-Perles R,Moreno D A,et al.Natural bioactive compounds of Citrus limon for food and health[J].Journal of pharmaceutical and biomedical analysis,2010,51(2):327-345.
[7]Wang Y,Chuang Y,Ku Y.Quantitation of bioactive compounds in citrus fruits cultivated in Taiwan[J].Food Chemistry,2007,102(4):1163-1171.
[8]Singh S,Singh R P.In vitro methods of assay of antioxidants:An overview[J].Food reviews international,2008,24(4):392-415.
[9]Karadag A, Ozcelik B, Saner S.Review of Methods to Determine Antioxidant Capacities[J].Food Analytical Methods,2009,2(1):41-60.
[10]Lucy Yu L,Cheng Z.Application of electron spin resonance(ESR) spectrometry in nutraceutical and food research[J].Molecular Nutrition&Food Research,2008,52(1):62-78.
[11]Kopani M,Celec P,Danisovic L,et al.Oxidative stress and electron spin resonance[J].Clinica Chimica Acta,2006,364(1-2):61-66.
[12]Mokbel M S,Hashinaga F.Evaluation of the antioxidant activity of extracts from buntan(Citrus grandis Osbeck) fruit tissues[J].Food Chemistry,2006,94(4):529-534.
[13]冯翠萍,邬瑕.果汁对DPPH自由基清除作用的研究[J].食品科技,2009,34(12):144-146.
[14]王彤.医学统计学与SPSS软件应用[M].北京:北京大学医学出版社,2008:102-110.
[15]国家标准局.GB/T 4086.4-1983统计分布数值表F分布[S].北京:中国标准出版社,1983.
[16]Gattuso G,Barreca D,Gargiulli C,et al.Flavonoid composition of citrus juices[J].Molecules,2007,12(8):1641-1673.
[17]Pannala A S, Chan T S, O’Brien P J, et al.Flavonoid B-ring chemistry and antioxidant activity:Fast reaction kinetics[J].Biochemical and Biophysical Research Communications,2001,282(5):1161-1168.
[18]Kesinger N G,Stevens J F.Covalent interaction of ascorbic acid with natural products[J].Phytochemistry,2009,70(17-18):1930-1939.
Comparative study on DPPH radical scavenging capacities of lemon juice based on two methods
ZHOU Yue,ZHANG Na*,LIN Tai-feng,ZHONG Ru-gang
(College of Life Science and Bioengineering,Beijing University of Technology,Beijing 100124,China)
TS255.44
A
1002-0306(2012)16-0176-04
2012-01-13 *通讯联系人
周玥(1985-),男,硕士,研究方向:食品安全与分子毒理学。

