香竹中特殊香气成分及甜味成分的研究
孙 嘏,岳永德,汤 锋,吕 平
(国际竹藤中心,北京 100102)
香竹中特殊香气成分及甜味成分的研究
孙 嘏,岳永德*,汤 锋,吕 平
(国际竹藤中心,北京 100102)
研究了我国特殊制酒材料-香竹杆中的化学成分,通过气质联用分析出1种特殊芳香性的化学成分α-石竹烯,同时分离制备出9种化合物,用核磁共振波谱仪进行分析鉴定分别为葡萄糖、果糖、半乳糖,蔗糖,木糖,木二糖,半乳糖醛酸-葡萄糖-果糖组成的三糖,葡萄糖醛酸和半乳糖醛酸。推测影响酒气味变化的应为α-石竹烯,影响其口感的应为多糖类化合物。
多糖,α-石竹烯,香竹
Abstract:Chimonocalamus delicatus Hsueh et Yi stem was used to be a special liquor material in China.The chemical composition of Chimonocalamus delicatus Hsueh et Yi stem were studied by GC-MS,modern separate technology and NMR.α-caryophyllene had been identified by GC-MS.Nine compounds were separated by modern separate technology and identified the structures by NMR.The compounds were glucose,fructose,galactose,sucrose,xylose,xylan,galactose acid-glucose-fructose,glucose acid and galactose acid.Speculate that α-caryophyllene miht be influence the wine smell sweet and polysaccharides made the wine taste good.
Key words:polysaccharides;α-caryophyllene;Chimonocalamus delicatus Hsueh et Yi
香竹(Chimonocalamus delicatus Hsueh et Yi)属于禾本科竹亚科香竹属[1],为我国竹类学家于1980年发现的珍稀竹类,现仅见于云南金平县海拔1400~2000m山区,常与阔叶树混生。由于其杆之节间空腔内具淡黄色特殊芳香气味的油脂,因此得名。当地农民,将酒注入香竹竹竿中封存三个月后,再将酒取出饮用,其酒有独特的香味,并且入口绵甜,深受当地群众欢迎,但究竟是什么引起其香味和口感的变化?是否食用安全?目前这方面的研究较少。本研究主要是对香竹竹杆中特殊的化学成分进行了分析,为进一步开发香竹作为食品资源提供参考依据。
1 材料与方法
1.1 材料与仪器
香竹竹种 采样于云南金平县,由西南林学院辉朝茂教授进行品种鉴定,将香竹竹杆刨开,将其竹杆内壁及其油层刮掉,收集称量,得到100.4g;色谱甲醇、乙腈、正己烷 德国Merck公司;甲酸、甲酸胺 均为国产分析纯。
核磁共振仪Bruker AV300 瑞士Bruker公司;液相色谱-质谱联用仪(Agilent 1100Series、LC/MSD SL),气相色谱/质谱联用仪(Agilent 6890/5973N) 美国安捷伦科技有限公司;Pall超纯水制备仪 美国Pall公司;EYELA N-1000旋转蒸发仪 日本EYELA公司;多通道二维分离制备色谱仪 德国Sepiatec公司;THZ-C-1台式恒温振荡器 太仓市实验设备厂。
1.2 样品制备
1.2.1 样品预处理 将收集到的100.4g竹杆内壁,加入1000mL超纯水按料液比1∶10浸泡加热蒸馏6h,将浸提过后的原材料和浸提液分离,将原材料加入100mL正己烷,密封浸泡48h,抽取1mL,加入正己烷定容到1000mL容量瓶,抽取1mL进行气相色谱/质谱联用分析。
将浸提液在40℃水浴锅减压浓缩,浓缩到100mL,加入150mL无水乙醇醇沉,过滤,得到醇沉物,将醇沉物溶解于100mL 20%的甲酸水溶液,30℃恒温水浴摇床12h,浓缩称重461mg。
选用二维分离制备仪中C4反相色谱柱,活性炭色谱柱,阳离子交换树脂柱,阴离子交换柱,用pH3的甲酸水溶液,甲酸-甲酸胺缓冲液(pH3,0.01mol/L甲酸胺),配合乙腈甲醇反复梯度洗脱,分离得到化合物1:11mg、化合物2:30mg、化合物3:15mg、化合物4:7mg、化合物5:60mg、化合物6:5mg、化合物7:21mg、化合物8:17mg、化合物9:29mg。
1.2.2 质谱条件 检测色谱条件:色谱柱DB-1(0.25mm×30m×0.25μm);载气为高纯He;载气流速1mL·min-1;进样量1μL;溶剂延迟4min;进样口温度200℃;程序升温,起始温度为40℃,保持1min,然后以5℃/min,升至100℃,保持5min,再以5℃/min,升至210℃,保持10min。
检测质谱条件:EI源电子能量70eV;离子源温度:230°C;质量扫描范围:40~80u。
分离与鉴定:所得质谱图谱主要利用NIST2002(标准图谱)进行检索,参考检索数据匹配度,并对全部结果进行人工核对和补充检索,根据质谱图扫描识别色谱柱上不同保留质谱峰的对应关系,对柱流失和环境产生的杂质峰进行人工筛选和排除,确定各成分[2]。
1.2.3 核磁条件
a.氢谱(1H NMR):脉冲程序(PULPROG):zg;驰豫延迟(D1):2.0s;采样通道1H高功率90°脉宽,(P1):4.00 usec;
b.碳谱(13C NMR):脉冲程序(PULPROG):zgdc;驰豫延迟(D1):2.0s;采样通道1H高功率90°脉宽,(P1):3.00usec;
c.质子检测的异核单量子相干谱((1H-detected)heteronuclear single-quantum coherence HSQC):脉冲程序(PULPROG):hsqcetgp;驰豫延迟(D1):2.0s;采样通道1H高功率90°脉宽,(P1):7.40usec;
d.质子检测的远程1H-13C异核相关谱((1H-detected)heteronuclearmultiple-bond correlation HMBC):脉冲程序(PULPROG):hmbcgplpndqf;驰豫延迟(D1):1.5s;采样通道1H高功率90°,脉宽(P1):7.40usec;
e.不失真地极化转移增强法[3](Distortionless enhancement by polarization transfer,DEPT) a)DEPT90°:脉冲程序(PULPROG):dept90;驰豫延迟(D1):2.0s;采样通道1H高功率90°脉宽(P1):6.70usec;b)DEPT90°:脉冲程序(PULPROG):dept135;驰豫延迟(D1):2.0s;采样通道1H高功率90°,脉宽(P1):6.70usec;
化合物1、2、3、4、6、7、8、9,选用D2O溶解,化合物5选用DMSO溶解。
2 结果与分析
2.1 气质(GC-MS)联用分析结果
正己烷浸泡液的总离子流色谱图见图1。GC-MS联用技术对其正己烷浸泡液进行分离分析,共获得1个色谱峰。通过谱库检索及文献查阅,匹配度98%,初步鉴定了该化合物为α-石竹烯。
2.2 分离单体化合物鉴定结果
化合物1:白色粉末,分子量:180.1,从碳谱中可以看出主要有6个碳,其化学位移从低场到高场分别是97.5(CH),76.2(CH),74.0(CH),73.1(CH),70.2(CH),62.1(CH2),氢谱的化学位移分别为是4.63(s,1H),4.20(dd,1H),3.72(d,2H),3.67(s,1H),3.59(d,1H),3.48(d,1H)。根据DEPT谱,62.1ppm为一个亚甲基,可以初步推断该化合物为六碳糖,在氢谱中端基碳的化学位移在4.63ppm,与分析化学手册核磁分册数据进行比对[4],可以推断该化合物为β-半乳糖(图2)。由于半乳糖在水溶液中主要是以吡喃式构型含氧环存在,为α和β两种构型的衡态混合物,从核磁数据中可以看出主要以β-半乳糖的形式存在。
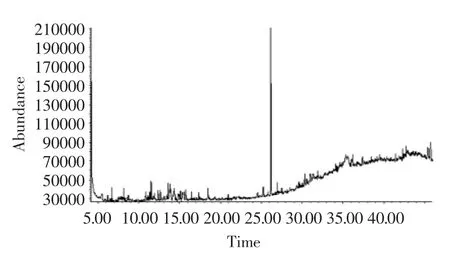
图1 正己烷萃取物的GC-MS总离子流图Fig.1 TIC chromatogram of solution of Hexane
化合物2:白色粉末,分子量518.3,从碳谱中可以看出有18个碳,其碳谱数据为:106.3(C),78.27(CH),75.38(CH),83.5(CH),63.5(CH2),62.9(CH2),94.9(CH),72.49(CH),73.8(CH),70.4(CH),72.0(CH),66.7(CH2),98.7(CH),72.4(CH),75.2(CH),72.2(CH),77.3(CH),173.9(C),在氢谱中,其数据为:4.23(d,1H),4.07(d,1H),3.89(dd,1H),3.68(dd,2H),3.82(m,2H),5.42(d,1H),3.54(s,1H),3.77(dd,1H),3.49(d,1H),3.67(m,1H),3.59(d,2H),4.64(d,1H),4.11(s,1H),3.607(dd,1H),3.481(d,1H),3.750(dd,2H),化学位移在低场173.9ppm处有一个碳,说明含有一个羧基,化学位移主要集中在110~60ppm之间,可以推断出该化合物为一个三糖,并有一个糖醛酸,根据糖分子中C-1羟基甲基化后,使C-1的δ值向低场位移7.4ppm,可以推断98.7ppm应为半乳糖的端基碳,且半乳糖的C-1与其他糖连接。106.3ppm可以推断三糖中应含有一个β-果糖,从94.9ppm的化学位移可以推断应为最后一个糖的C-1,该碳对应的氢耦合常数为7.2Hz[5],所以推断该糖为α-葡萄糖,且C-1上的羟基脱水,与其他糖连接。根据DEPT谱中66.7ppm的峰为亚甲基,在HMBC谱中与其对应的H,与98.7ppm的碳有相关点,可以推断该α-葡萄糖的C-6与半乳糖的C-1为两个糖的链接点。在HMBC谱中,羧基碳106.3ppm与氢谱中3.75ppm的氢有相关性,推断应为半乳糖醛酸。推测化合物结构为β-半乳糖醛酸-α-葡萄糖-β-果糖(图2)。
化合物3:白色粉末,分子量150,其碳谱的高场区主要有5个碳信号,为5碳糖,其数据分别为:97.6(CH),75.0(CH),76.8(CH),70.2(CH),66.3(CH2),氢谱数据分别为4.65(d,1H),3.23(d,1H),3.41(dd,1H),3.60(d,1H),3.92、3.32(2H),端基氢信号为4.65ppm,可以初步推断为β-木糖或α-阿拉伯糖,在糖的优势构象中,凡是H-2’为α健的糖,当与苷元形成β-苷键,其H-1’与H-2’为αα耦合系统[6],J=6-9Hz,并呈现一个二重峰,从氢谱中可以看出,其耦合常数为7.4,其C1’上的α键H与C2’上的α键H之间的夹角Φ180°应为β-D构型,并在C-3的化学位移76.8ppm,可以证实为β-木糖(图2)。
化合物4:白色粉末,分子量194.3,从碳谱中可以看出有6个碳,并有一个羧基碳,其化学位移分别为173.8(C),96.7(CH),76.2(CH),75.4(CH),73.6(CH),70.0(CH),可以推断为亚甲基氧化成羧酸的6碳糖类结构,端基碳为96.7ppm,对应氢谱的化学位移为5.42ppm,耦合常数J1,2=7.8Hz[5],说明该化合物应为β-葡萄糖醛酸(图2)。
化合物5:白色粉末,分子量180.5,从碳谱中可以看出有明显12个峰,与分子量差距较大,可以推断该糖在水溶液中主要为α和β两种构型的衡态混合物,且比例接近,其碳谱:106.0(C),103.9(C),84.8(CH),83.7(CH),82.7(CH),77.7(CH),77.5(CH),77.2(CH),65.6(CH2),64.8(CH2),64.8(CH2),62.9(CH2),低 场区的化学位移分别有两个端基碳106.0ppm和103.9ppm,DEPT谱中为季碳,且65~60ppm范围内有4个亚甲基峰出现,即可以推断该糖在水溶液中主要呋喃环氧环存在,初步推测该化合物为果糖,且为α和β两种构型且比例接近的衡态呋喃型果糖(图2)。
化合物6:白色粉末,分子量180.2,从碳谱中可以看出有明显主要有6个碳,其化学位移分别为96.4(CH),76.6(CH),76.3(CH),74.7(CH),70.2(CH),61.5(CH2),氢谱的化学位移:5.48(d,1H),耦合常数J1,2=7.8Hz,3.57(d,2H),3.76(t,3H),3.47(d,3H),3.85(d,2H),3.82(d,2H),根据分析化学手册核磁分册数据进行比对[4],推测该化合物为β-葡萄糖(图2)。
化合物7:白色粉末,分子量282.4,从碳谱中可以看出,该化合物有10个碳,化学位移分别是:102.8(CH),73.76(CH),76.67(CH),70.21(CH),66.2(CH2),97.53(CH),74.93(CH),75.02(CH),77.49(CH),64.1(CH2),在Dept谱中,有2个亚甲基,且分别为66.2ppm,64.1ppm,可以判断该亚甲基在环内,且端基碳102.8ppm和97.5ppm,推断应为两个糖,其氢谱为4.36(d,1H),3.26(d,1H),3.54(dd,1H),3.60(m,1H),3.35、4.00(m,2H),4.68(d,1H),3.29(d,1H),3.41(t,1H),3.77(m,1H),3.74、3.04(m,2H),J1,2耦合常数为7.4,可以判断为两个木糖组成的木二糖,通过HMBC谱确证为1’和4位连接(图2)。
化合物8:白色粉末,分子量194.2,从碳谱中可以看出有6个碳,并有一个羧基碳,其化学位移分别为173.2(C),97.9(CH),77.1(CH),75.2(CH),72.9(CH),72.1(CH),氢谱为:4.65(s,1H),4.23(d,1H),3.60(d,1H),3.48(dd,1H),3.70(d,1H),8.40(s,1-OH)端基氢的化学位移为4.65ppm,说明该化合物应为β-半乳糖醛酸(图2)。
化合物9:白色粉末,分子量342.5,从碳谱中可以看出12个碳,氢谱中看到有14个氢,推断分子式为C12H22O11,碳谱的化学位移:95.0(CH),73.9(CH),75.4(CH),72.1(CH),75.2(CH),63.0(CH2),106.5(C),79.2(CH),76.8(CH),84.2(CH),64.2(CH2),65.2(CH2),氢谱为:5.42(d,1H),3.56(d,1H),3.76(t,1H),3.47(dd,1H),3.85(d,1H),3.82(d,2H),4.22(d,1H),4.05(t,1H),3.89(dd,1H),3.68(d,2H),3.82(d,2H),推测有两个糖组成,碳谱中端基碳为106.5ppm,且含有3个亚甲基,可以判断该化合物应该有1个果糖,另一个端基碳95.0ppm对应的氢的化学位移为5.42ppm,可以推测化合物含有α-葡萄糖,葡萄糖J1,2耦合常数为3.8Hz,推断化合物为蔗糖(图2)。

图2 化合物1~9的结构图Fig.2 Structures of compound 1~9
3 结论
该研究证明,香竹竹杆中的主要化学成分为特殊挥发性气味的α-石竹烯和多糖。多糖经过酸解后,得到多种单糖、双糖,经过核磁鉴定为葡萄糖、果糖、半乳糖、蔗糖、木糖等多种糖类成分,可以初步推断香竹竹杆中的多糖成分应为β-半乳糖-α-葡萄糖-β-果糖组成的多糖和木聚糖[7-9]。
从香竹竹杆中分离得到的多糖和α-石竹烯,证实了当地农民将酒注入香竹杆中封存三个月后取出饮用,入口绵甜应是因为游离的果糖和蔗糖增加了其酒中的甜度,α-石竹烯增加了酒的特殊香气。
综上可见,香竹竹杆具有潜在的巨大食品开发价值。我国竹类资源丰富,竹子除作为食用笋之外,还有很多有待开发的食用价值,如何发现竹子更好的食用价值并与食品工业方面相结合有待进一步的研究。
[1]中国科学院“中国植物志”编辑委员会.中国植物志[M].北京:科学出版社,2009,9(1):362.
[2]杨嘉,刘建华,高玉琼,等.慈竹叶精油化学成分研究[J].天然产物研究与开发,2002,14(6):31-32.
[3]田菲菲,李志良,吴世容.原子电性作用矢量用于呋喃糖核磁共振碳谱化学位移计算[J].波谱学杂志,2005,22(2):163-172.
[4]于德泉,杨峻山,谢晶曦.分析化学手册:核磁共振波谱分析[M].北京:化学工业出版社,1989:832-834.
[5]阎政礼,杨名生,李添宝,等.蜂蜜中葡萄糖、果糖和蔗糖NMR定量分析研究[J].食品科学,2009,30(14):253-255.
[6]Aylward G H,Findlay T J.Sichenical data[M].2nd ed.Beijing:High Education Press,1985:94.
[7]邱明华,杨叶昆,何以能.雪单双糖的NMR碳氢化学位移完全解析[J].波谱学杂志,2002,19(3):193-197.
[8]王展,方积年.高场核磁共振波谱在多糖结构研究中的应用[J].分析化学评论与进展,2000,28(2):240-247.
[9]臧笑雪.孔石莼多糖的分离和结构研究[D].青岛:中国海洋大学,2006.
Study on special aroma and sweet taste compositions in stem of Chimonocalamus delicatus Hsueh et Yi
SUN Jia,YUE Yong-de*,TANG Feng,LV Ping
(Internation centre for Bamboo and Rattan,Beijing 100102,China)
TS201.2
A
1002-0306(2012)14-0145-04
2011-11-30 *通讯联系人
孙嘏(1981-),男,博士后,研究方向:林产化工,天然产物化学。
国家科技支撑计划项目(2012BAD23B03)。

