不同蛋白水解物在大豆油水包油乳状液中的抗氧化作用
程 宇,陈 洁,马海乐,熊幼翎
(1.江苏大学食品与生物工程学院,江苏镇江 212013;2.江南大学食品科学与技术国家重点实验室,江苏无锡214122)
不同蛋白水解物在大豆油水包油乳状液中的抗氧化作用
程 宇1,2,陈 洁2,马海乐1,熊幼翎2
(1.江苏大学食品与生物工程学院,江苏镇江 212013;2.江南大学食品科学与技术国家重点实验室,江苏无锡214122)
以TBARS为指标,用烘箱加速氧化法考察了大豆蛋白水解物、乳清蛋白水解物和马铃薯蛋白水解物对大豆油水包油(O/W)乳状液氧化稳定性的影响。采用离心法分析了不同蛋白水解物在乳状液两相中的分布,并测定了界面上蛋白水解物的分子量分布。实验表明,这些蛋白水解物在乳状液中都显示了一定的抗氧化能力。并且有一部分蛋白水解物分布在乳状液界面上。分布在界面上的蛋白水解物可能是通过物理作用(屏蔽和静电作用)和化学作用(清除自由基)延缓了脂肪的氧化。
乳状液,蛋白水解物,抗氧化,界面
Abstract:Effect of soy protein hydrolysate,whey protein hydrolysate and potato protein hydrolysate on the oxidation stability of soybean oil-in-water emulsion was investigated.Lipid oxidation was estimated using 2-thiobarbituric acid reactive substances(TBARS) as indicator.Partition of these hydrolysates was determinded by centrifugation.Also,Molecular weight distribution of these hydrolysates was determined.It was indicated that these protein hydrolystes were able to retard the lipid oxidation of emulsions.A portion of protein hydrolysates was partitioning in the interace of emulsion.Both physical and chemical action of the hydrolysates distributing in the interface of emulsion played an important role in inhibiting lipid oxidation.
Key words:emulsion;protein hydralysate;antioxidant;interface
脂肪氧化是引起食品品质劣变的主要因素之一。乳状液作为一种重要的食品载体体系,同样存在脂肪氧化的问题。通常,一些合成的抗氧化剂会被添加到食品中用于抑制食品中脂肪的氧化。然而近年来,随着人们生活水平越来越好,人们开始关注一些传统化学合成添加剂的安全性,因此,研究人员开始不断寻找和开发天然来源的替代品,具有抗氧化性的蛋白水解物就是其中的一种。已经有很多研究报道了通过酶水解得到的蛋白水解物可以有效清除自由基,表现出了良好的抗氧化能力[1-3]。同时,将一些蛋白水解物添加到食品体系如肉饼[4-5]和香肠[6-7]中,产品中的脂肪氧化得到了有效的延缓,使产品货架期得到了延长。然而,将水解蛋白应用于水包油乳状液的研究则较少[8]。而乳状液体系是广泛存在于食品中的一个体系,因此有必要对水解蛋白在乳状液中的作用进行研究。本实验将不同来源的水解蛋白作为共乳化剂用于制备乳状液,观察它们对乳状液氧化稳定性的影响,并对这些蛋白水解物的作用进行了分析。
1 材料与方法
1.1 材料与仪器
马铃薯浓缩蛋白 荷兰AVEBE BA,蛋白含量81%;大豆分离蛋白 哈尔滨黎明植物蛋白科技有限责任公司,蛋白含量90%;乳清蛋白 美国Davisco公司,蛋白含量90%;Alcalase 诺维信公司;Flavoruzyme 无锡酶制剂厂;1,1,3,3-四乙氧基丙烷(TEP) Sigma公司;大豆油 东海油脂(张家港)公司;其他试剂 上海国药集团,分析纯;实验用水为超纯水,自制。
pH计 梅特勒-托利多仪器(上海)有限公司;DC10-K10加热制冷循环器 赛默飞世尔科技(中国)有限公司;Avanti J-26 XP高速冷冻离心机 美国贝克曼库尔特有限公司;冷冻干燥机 德国Marin Christ公司;T18高速乳化均质机 德国IKA公司;AH-basic型高压均质机 ATS工业系统有限公司;UV-2800型紫外可见光分光光度计 尤尼柯(上海)科学仪器有限公司;Marlvern Nano ZS动态光散射仪英国马尔文仪器有限公司。
1.2 实验方法
1.2.1 不同蛋白水解物的制备
1.2.1.1 马铃薯蛋白水解物(PPH) 参考Wang[5]等人的方法。将马铃薯浓缩蛋白溶液(4%,w/v)调pH到8.0左右,用Alcalase在50℃水解6h,酶底比为1∶100。水解结束后,用1mol/L的NaOH调pH至7.0,80℃灭酶15min。7000×g离心后取上清液冷冻干燥。
1.2.1.2 大豆蛋白水解物(SPIf) 参考Pena-Ramos[9]等人的方法。将大豆分离蛋白(2%,w/v)在90℃预热5min,调pH到7.0左右,用Flavoruzyme在50℃水解0.5h,酶底比为1∶100。水解结束后,用1mol/L的NaOH调pH至7.0,80℃灭酶15min。7000×g离心后取上清液冷冻干燥。
1.2.1.3 乳清水解蛋白物(WPIf) 参考Pena-Ramos[9]等人的方法。将乳清分离蛋白(2%,w/v)在90℃预热5min,调pH到7.0左右,用Flavoruzyme在50℃水解1h,酶底比为1∶100。水解结束后,用1mol/L的NaOH调pH至7.0,80℃灭酶15min。7000×g离心水解液,取上清液冷冻干燥。
1.2.2 乳状液的制备 水相溶液:将Tween20(1.125%,w/w)溶于10mg/mL不同蛋白水解物溶液(0.01mol/L磷酸盐缓冲液,pH7.0)。将大豆油(10%,w/w)和水相溶液(90%,w/w)用高速分散机在21500r/min下乳化2min,再将乳化液用高压均质机在32MPa均质两次,并在得到的乳状液中加入NaN3(0.02%,w/w)作为抑菌剂。乳状液的Zeta电位和粒径用Malvern Nano ZS动态光散射仪测定。乳状液的粒径在氧化过程中没有显著变化。
1.2.3 乳状液的氧化 将乳状液分装在20mL带盖的玻璃瓶中,用铝箔纸包裹,在瓶中加入适量体积乳状液(每瓶中液体体积相同,并保证氧气充足),放入隔水式培养箱中37℃氧化。定期测定体系TBARS值。TBARS的测定方法参考Mei[10]等人的方法。以1,1,3,3-四乙氧基丙烷(TEP)做标准曲线,确定样品中的TBARS值。
1.2.4 蛋白水解物在乳状液中的分布 取1mL乳状液在Eppendorf管中,室温下15000×g离心45min,取下层乳清层再次15000×g离心45min,然后取下清液过0.22μm滤膜,得到的滤液稀释到一定浓度用福林酚法测定蛋白含量即得到水相中蛋白水解物的含量。蛋白水解物分布的计算参考Huang[11]等人的方法,为不同相蛋白占原始蛋白含量的比例。
1.2.5 分布在界面上蛋白水解物的分子量分布 取一定体积乳状液在50mL离心管中,20℃下50000×g离心45min,小心取出第一次离心得到的乳化层,加入缓冲液混匀,20℃下50000×g离心45min,小心取出乳化层,加氯仿-甲醇(2∶1)混合溶剂进行萃取(蛋白水解物会进入上层甲醇相),离心,将收集得到的甲醇相中甲醇旋转蒸发除去,得到界面上的蛋白水解物。其分子量分布使用凝胶排阻色谱进行分析。分析使用的色谱柱为Shodex Kw802.5,流动相为50mmol/L磷酸缓冲盐(pH7.0)+0.3mol/L NaCl,流速为0.8mL/min,柱温25℃。分子量由标准品测得的标准曲线得到。
1.2.6 ABTS+自由基清除能力 参考Cheng[12]等人的方法。
1.2.7 统计分析 数据统计使用DPS中单因素实验统计分析以及Tukey法多重比较。
2 结果与讨论
2.1 不同水解蛋白清除ABTS自由基的能力
从实验结果(图1)可以看到,10mg/mL的大豆蛋白水解物、乳清蛋白水解物和马铃薯蛋白水解物都表现出了较好的自由基清除能力,ABTS+自由基的清除能力都超过了60%。其中,马铃薯蛋白水解物表现出了最好的自由基清除能力,自由基清除率达到了90%以上。自由基反应是引起乳状液中脂肪氧化的一个重要原因,因此这几种显示出抗氧化活性的水解物都可以用于抑制乳状液中脂肪的氧化。
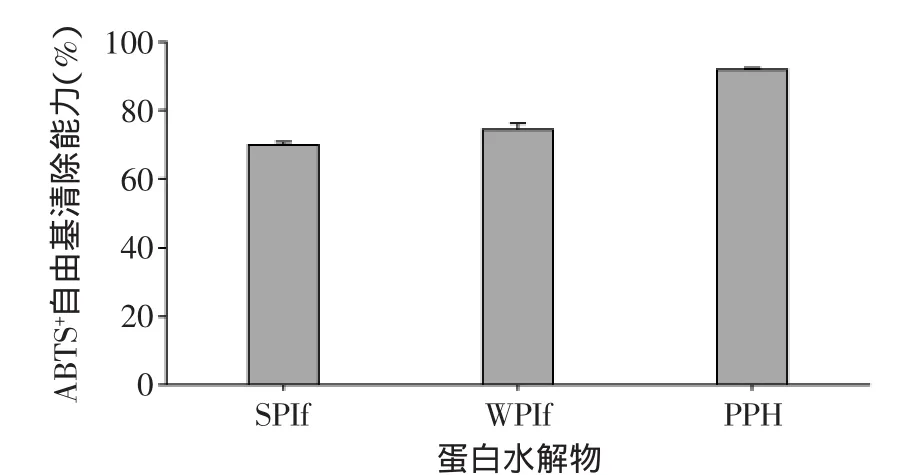
图1 不同蛋白水解物的ABTS+自由基清除能力Fig.1 ABTS+radical scavenging capacity of different protein hydrolysates
2.2 不同水解蛋白对乳状液中脂肪氧化的抑制作用
从图2可以看到和未加蛋白水解物的乳状液相比,加入了抗氧化活性蛋白水解物的乳状液都表现出了更好的氧化稳定性。和对照样品相比,添加大豆蛋白水解物、乳清蛋白水解物和马铃薯蛋白水解物的乳状液在0d时TBARS的值低于前者(p<0.05)。经过10d的氧化,添加蛋白水解物的乳状液中脂肪氧化的程度依然显著低于未添加抗氧化剂的乳状液(p<0.05)。在第10d时,和对照样品相比,添加了大豆蛋白水解物、乳清蛋白水解物和马铃薯蛋白水解物的乳状液中TBARS的生成量分别降低了77.6%、77.8%和25.6%(p<0.05)。特别是添加了大豆蛋白水解物和乳清蛋白水解物的乳状液,经过10d的氧化,脂肪氧化产物丙二醛类物质并未有显著的提高(p>0.05),表现出了较高的氧化稳定性。尽管马铃薯蛋白水解物清除自由基能力最高,但是其对乳状液稳定性的提高程度并不及大豆蛋白水解物和乳清蛋白水解物。这表明乳状液氧化稳定性的提高还和其他因素有关。

图2 添加不同蛋白水解物的乳状液的氧化稳定性Fig.2 Oxidation stability of emulsion prepared with different protein hydrolysates
2.3 蛋白水解物在乳状液中的分布
在乳状液中,抗氧化剂在乳状液中的分布与其抗氧化性存在一定的联系[11]。实验结果(图3)表明,添加了蛋白水解物的乳状液中,有一部分蛋白水解物分布在了乳状液的油水界面上。其中,乳清蛋白水解物在界面上分布的比例较高,达到了27.9%;而大豆蛋白水解物在界面上分布的比例较低,只有2.8%。由于脂肪的氧化易于在界面上发生,因此改变界面上的组成则可以有效改变脂肪氧化的速率。蛋白水解物吸附在油水界面上,可以形成有效的阻隔层,起到了一定的物理屏障作用和阻断自由基反应的化学作用。乳状液中脂肪颗粒属于非连续性分布,自由基的传递则需要通过连续相的水来进行,而在水相中分布的蛋白水解物也可以起到很好的阻断脂肪氧化的作用,从而延缓脂肪的氧化。
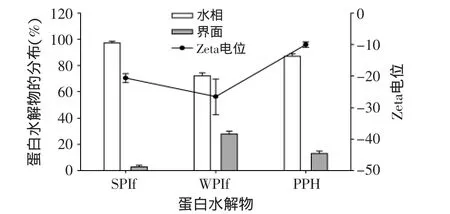
图3 不同蛋白水解物在水相和界面上的分布以及相应乳状液的Zeta电位Fig.3 Partition of different protein hydrolysates in water phase and at the interface and ζ-potential of emulsions prepared with different protein hydrolysates
和阴离子乳化剂的结果不同,尽管加入蛋白水解物的乳状液的Zeta电位为负值,这些乳状液依然显示了优于对照乳状液的氧化稳定性。而且,添加了乳清蛋白水解物的乳状液尽管其Zeta电位更低,但氧化稳定性要优于Zeta电位相对较高的添加马铃薯蛋白水解物乳状液。较低的电位表明在界面上的组分有更强的亲和过渡金属离子的静电作用,可以有效阻止这些过渡金属离子与过氧化物接触。同样,虽然大豆蛋白水解物在界面上的分布较少,但是这部分蛋白水解物形成的静电相互作用仍然较强。同时,界面上物质对铁离子和铜离子等油脂氧化催化剂的作用不仅有静电作用,也可能包括其本身在界面上的空间阻碍作用。因而添加大豆蛋白的乳状液也表现出了较好的氧化稳定性。
2.4 分布在界面上的蛋白水解物的分子量分布
分子量分布测定的结果(表1)表明,分布在界面上的蛋白水解物的分子量大部分集中在400~2000u之间,因而这些小分子量段的蛋白水解物是分布在界面上的水解蛋白起主要作用的物质基础。小分子量段的蛋白水解物由于分子较小,吸附速率比大分子高,在乳化的过程中有更多的几率和乳化剂竞争吸附在脂肪表面,或是与乳化剂通过非共价键吸附在乳化剂表面,形成了更有效的脂肪保护层如膜的致密性可能较高。而很多研究都表明,小分子量段的蛋白水解物在化学性质上表现出更好的抗氧化活性。而马铃薯蛋白水解物尽管分子量较大,可能有较好的空间阻碍作用,但是也正是其空间位阻作用而导致界面致密度下降,表现出了比其他蛋白水解物弱的抑制氧化作用。

表1 不同乳状液界面上蛋白水解物的分子量分布Table 1 Molecular weight distribution of protein hydrolysates partitioning in the interface of different emulsions prepared with different protein hydrolysates
3 结论
在乳状液中添加大豆蛋白水解物、乳清蛋白水解物和马铃薯蛋白水解物可以有效抑制脂肪的氧化。尽管马铃薯蛋白水解物的清除自由基能力最强,但是大豆蛋白水解物和乳清蛋白水解物可以更好地抑制乳状液脂肪的氧化。所有蛋白水解物制备的乳状液中都有一部分蛋白水解物分布在乳状液界面上。其中乳清蛋白水解物在界面上分布的量最高,达到了27.9%。分布在乳状液界面上的蛋白水解物都有助于延缓乳状液中脂肪的氧化。这部分蛋白水解物主要是分子量分布在400到2000u的小分子多肽。
[1]涂宗财,郑明,陈钢,等.酶解鱼鳞蛋白制备抗氧化肽的研究[J].食品工业科技,2009,30(7):202-206.
[2]任娇艳,赵谋明,崔春,等.草鱼源抗氧化肽的响应面法优化制备及活性评价[J].食品工业科技,2009,30(7):69-73.
[3]Elias R J, Kellerby S S, Decker E A.Antioxidant activity of proteins and peptides[J].Critical Reviews in Food Science and Nutrition,2008,48(5):430-441.
[4]Diaz M,Decker E A.Antioxidant mechanisms of caseinophosphopeptides and casein hydrolysates and theirapplication in ground beef[J].Journal of Agricultural and Food Chemistry,2004,52(26):8208-8213.
[5]Wang L L,Xiong,Y L.Inhibition of lipid oxidation in cooked beef patties by hydrolyzed potato protein is related to its reducing and radical scavenging ability[J].Journal of Agricultural and Food Chemistry,2005,53(23):9186-9192.
[6]Nieto G,Castillo M,Xiong Y L,et al.Antioxidant and emulsifying properties of alcalase-hydrolyzed potato proteins in meat emulsions with different fat concentrations[J].Meat Science,2009,83(1):24-30.
[7]石丽梅.玉米蛋白水解物对于中式香肠的氧化稳定性的影响研究[D].无锡:江南大学,2008.
[8]Elias R J,Bridgewater J D,Vachet R W,et al.Antioxidant mechanisms of enzymatic hydrolysates of β-lactoglobulin in food Lipid dispersions[J].Journal of Agricultural and Food Chemistry,2006,54(25):9565-9572.
[9]Pena-Ramos E A,Xiong Y L.Whey and soy protein hydrolysates inhibit lipid oxidation in cooked pork patties[J].Meat Science,2006,64(3):259-630.
[10]Mei L,McClements D J,Wu J,et al.Iron-catalyzed lipid oxidation in emulsion as affected by surfactant,pH and NaCl[J].Food Chemistry,1998,61(3):307-312.
[11]Huang S W,Frankel E N,Aeschbach R,et al.Partition of selected antioxidants in corn oil-water model systems[J].Journal of Agricultural and Food Chemistry,1997,45(6):1991-1994.
[12]Cheng Y,Xiong Y L,Chen J.Antioxidation and emulsifying property of hydrolyzed potato protein in soybean oil-in-water emulsions[J].Food Chemistry,2010,120(1):101-108.
Effect of different protein hydrolysates on the antioxidant in the soybean oil-in-water emulsion
CHENG Yu1,2,CHEN Jie2,MA Hai-le1,XIONG You-ling2
(1.School of Food and Biological Engineering,Jiangsu University,Zhenjiang 212013,China;2.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
TS201.2
A
1002-0306(2012)16-0108-04
2012-02-01
程宇(1981-),男,博士,讲师,研究方向:食品蛋白质功能。
国家自然科学基金项目(20976071);973计划前期研究专项(2010CB535014);江苏高校优势学科建设工程资助项目(PADA);江苏大学高级专业人才科研启动基金(11JDG051)。

