野生桑葚中花色苷成分分析
陈 亮,辛秀兰,袁其朋
(1.北京化工大学化工资源有效利用国家重点实验室,北京100029;2.北京电子科技职业学院,北京100029)
野生桑葚中花色苷成分分析
陈 亮1,2,辛秀兰2,*,袁其朋1,*
(1.北京化工大学化工资源有效利用国家重点实验室,北京100029;2.北京电子科技职业学院,北京100029)
运用固相萃取纯化技术与高效液相色谱/二极管阵列检测器/电喷雾质谱联用技术,采用Zorbax SB-C18色谱柱(250mm×4.6mm,5μm),甲醇-5%甲酸水溶液为流动相,流速为1.0mL/min,检测波长为520nm,以矢车菊素3-葡萄糖苷为对照,外标法测定了野生桑葚花色苷含量,并通过紫外扫描光谱和电喷雾质谱正离子碎片信息确定了花色苷的成分组成。结果表明:野生桑葚总花色苷含量为154.27mg/100g,含有的三种花色苷成分分别为矢车菊素3-葡萄糖苷、矢车菊素3-芸香糖苷和天竺葵素3-葡萄糖苷,其相对含量为67.52%、31.29%和1.06%。
野生桑葚,花色苷,固相萃取,高效液相色谱-质谱联用
Abstract:To establish a method to determine anthocyanin content and composition in wild mulberry,solid phase extraction(SPE)and high performance liquid chromatography equipped with a DAD detector and electro-spray ionization mass spectrometry(HPLC/DAD/ESI/MS)were used.The analysis was carried on Zorbax SB-C18column(250mm ×4.6mm,5μm).The mobile phase was aqueous 5%formic acid solution and methanol at the flow-rate of 1.0mL/min,the detection wavelength was 520nm.The content of gross anthocyanins was 154.27mg/100g by HPLC expressed as milligrams of cyanidin 3-glucoside equivalent per 100g of fresh weight.Three anthocyanins in wild mulberry were identified by UV-Vis and ESI+-MS spectra which were cyanidin 3-glucoside,cyanidin 3-rutinoside and pelargonidin 3-glucoside,the relative content of which were 67.52%,31.29%,1.06%respectively.
Key words:wild mulberry;anthocyanin;solid phase extraction;high performance liquid chromatography-mass spectrometry(HPLC/MS)
桑葚(Mulberry)是桑科桑属落叶乔木桑树Morusalba Linn.的果实,晒干或蒸后晒干可入药,味甘酸,性寒,归心、肝、肾经,中医可用于治疗肝肾不足和血虚精亏导致的头晕目眩、腰酸耳鸣、失眠多梦、津伤口渴等症。桑葚酸甜适口,营养丰富,富含鞣酸、苹果酸、多种维生素和人体必需的氨基酸及锌、钾、镁、磷等微量矿质元素,具有良好的保健功能,很早就被当作水果和中药材加以应用[1]。此外,桑葚颜色紫红,含有大量的天然红色素。桑葚红色素属花色苷类成分,是果蔬及其产品呈现从红色到蓝色的物质基础,具有抑制血小板凝固,预防血栓、心脏病,抗癌,延缓衰老等作用[2-4]。桑葚中的红色素含量高、色度高、性质稳定、安全无毒,是从自然界中提取花色苷的主要来源之一。霍琳琳等用直接分光光度法和pH示差分光光度法两种方法分别测定了桑葚果汁中总花色苷含量,表明这两种方法用于总花色苷的测定都具有良好的线性相关性,且直接分光光度法操作简便,结果更准确[5]。Q.Du等用高速逆流色谱(HSCCC)分离纯化鉴定出杭州产桑葚中花色苷成分为矢车菊素3-O-(6-O-鼠李糖-葡萄糖苷)(C3RG)、矢车菊素 3-O-(6″-O-鼠李糖-半乳糖苷)(C3RGa)、矢车菊素3-葡萄糖苷(C3G)、矢车菊素3-O-半乳糖苷(C3Ga)和矢车菊素7-葡萄糖苷(C7G)等五种花色苷成分[6]。但是,分光光度法分析测定花色苷过于笼统、简单,不能得到桑葚花色苷单个成分的分析结果,另一方面,先分离纯化,再用质谱、核磁等手段鉴定费时费力,不能快速得到花色苷的鉴定结果,甚至丢失部分含量较少的花色苷成分。因此,本实验通过高效液相色谱与光电二极管阵列检测器和电喷雾质谱检测器联用技术(HPLC-DAD-ESI-MS),既可以通过色谱图的总峰面积测得桑葚中花色苷的含量,又能得到花色苷类物质的紫外光谱信息、分子量和分子结构的碎片信息,鉴定桑葚中花色苷的成分,为今后桑葚花色苷的研究提供了一种快速准确且简便易行的检测方法[8]。
1 材料与方法
1.1 材料与仪器
野生桑葚冷冻果 采自安徽;对照品矢车菊素3-葡萄糖苷(纯度>98%) 购自成都曼思特生物科技有限公司;甲醇、甲酸 均为色谱纯;盐酸 分析纯;水 重蒸水。
LC-DAD-ESI-MS 1200/6120高效液相色谱-二极管阵列检测器-电喷雾质谱联用仪 Agilent公司;C9860A超声波清洗器 CBL公司;Laborota 4000旋转蒸发仪 Heidolph公司;12孔固相萃取真空操作系统 Grace公司;Bond Elut-C18,500mg 3mL,50/PK固相萃取小柱 Varian公司。
1.2 野生桑葚花色苷的提取
花色苷为水溶性色素,易溶于甲醇、乙醇、丙酮等溶剂,在pH>5的溶液中不稳定,酸性条件有利于提高花色苷的稳定性,因此,在甲醇、乙醇等提取溶剂中常加入盐酸、酒石酸、柠檬酸等酸化试剂,以防止花色苷的降解,本实验采用0.1%盐酸甲醇溶液对桑葚中的花色苷进行提取。分别称取10g样品,解冻捣碎,溶于100mL 0.1%盐酸甲醇溶液中,静置过夜,过滤,滤渣再另加100mL提取溶剂,振荡浸提三次,过滤,洗涤滤渣至无色,合并3次上清液,40℃减压浓缩,残渣用0.1%盐酸水溶液定容至25mL。
1.3 野生桑葚花色苷的纯化
Bond Elut-C18固相萃取小柱先分别用2mL 0.1%盐酸甲醇溶液和2mL 0.1%盐酸水溶液清洗活化,然后加入2mL花色苷提取液,抽真空至液体缓慢流尽,再用10mL 0.1%盐酸水溶液清洗柱子,弃掉洗脱水溶液,最后用2mL 0.1%盐酸甲醇溶液洗脱,收集甲醇洗脱液。将收集的甲醇洗脱液40℃真空旋蒸至干,用2mL 0.1%盐酸甲醇溶液溶解,以备液质测定。
1.4 液相色谱和质谱条件
液相色谱条件:Zorbax C18色谱柱(250mm×4.6mm,5μm);流动相:A液为甲醇,B液为5%的甲酸水溶液,线性梯度洗脱:0~10min,A液从5%升至20%,保持5min;15~30min,A液从20%升至25%,保持 5min;35~50min,A液从 25%升至 33%;50~60min,A 液从33%升至45%;流速:1mL/min;柱温30℃;进样量10μL;检测波长:520nm;DAD检测器,200~600nm全扫描。
质谱条件:正离子扫描(ESI+,m/z 200~1200),碰撞诱导解离电压:150V;毛细管电压:3.8kV;锥孔电压:30V;光电倍增器电压:650V;离子源温度:120℃;脱溶剂气温度:250℃。
1.5 对照品溶液的配制及线性关系考察
精确称取对照品矢车菊素3-葡萄糖苷5mg溶于 10mL 0.1% 盐酸甲醇溶液,进样 0.5、1.0、2.0、4.0、8.0、16.0μL,液相色谱及紫外检测条件见1.4,各重复进样三次,计算三次平均峰面积。将紫外检测峰面积Y与溶液浓度X进行一元线性回归分析,对照品矢车菊素3-葡萄糖苷在0.25~8.0μg范围内有良好的线性关系,回归方程为Y=2233X+13.38,相关系数R2=0.9999。
2 结果与分析
2.1 桑葚花色苷提取液含量测定
固相萃取(SPE)是一种快速、简单、可靠的纯化方法,可以有效地除去提取液中糖、酸、蛋白质、果胶等杂质,便于提取物中有效成分的分析检测。本文采用以C18键合的硅胶为填料的固相萃取柱对花色苷纯化,来消除质谱离子源的污染,对花色苷进行便捷的分析检测[9-11]。
花色苷的含量测定主要有分光光度法和HPLC法两种方法,分光光度法又分为直接测定法和pH示差法,直接测定法能够快速简单测定花色苷的含量,但是,由于花色苷褐变产生的多聚降解产物导致花色苷测量值偏高,而pH示差法可以有效地消除降解产物的干扰,被众多学术、政府和工业实验室推荐为官方第一测定方案(First Action Official Method)[12]。尽管如此,HPLC方法测定总花色苷有pH示差法不可比拟的优势,图1为桑葚花色苷提取物以520nm为检测波长时的高效液相色谱图,从色谱图中既可以通过保留时间的差异看出桑葚花色苷提取物中含有三种不同的花色苷,又可以对各色谱峰面积进行相加,通过对照品线性回归方程的计算得出,桑葚中总花色苷的含量为154.27mg/100g。
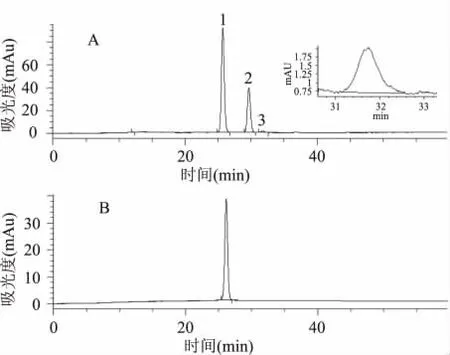
图1 桑葚花色苷提取物(A)和矢车菊3-葡萄糖苷(B)的高效液相色谱图(检测波长520nm)Fig.1 HPLC chromatograms of mulberry anthocyanin extract(A)and cyanidin 3-glucoside(B)(detected at 520nm)
2.2 桑葚花色苷提取液的液相色谱和紫外光谱
20世纪50年代,紫外-可见光谱就被人们应用于花色苷的结构鉴定。在甲醇溶液中,大多数黄酮类成分(如黄酮、黄酮醇、黄烷酮、二氢黄酮等)的紫外吸收光谱有两个主要吸收带,由桂皮酰基系统的电子跃迁引起的吸收带(300~400nm)和由苯甲酰基系统的电子跃迁引起的吸收带(240~280nm)组成,而花色苷是黄酮类成分,其在280nm和520nm左右的两个波长处有特征吸收峰,尤其在520nm左右,除了花色苷,其他成分极少在此有强吸收峰,因此,图1中三个色谱峰的紫外-可见光谱最大吸收都有在500~550nm处(见图2),可以确定它们都为花色苷类成分。

图2 色谱峰1、峰2和峰3的紫外可见吸收光谱图Fig.2 UV-Vis spectra of peaks 1,peak 2 and peak 3

表1 桑葚花色苷提取物的液相色谱和光谱特性Table 1 Liquid chromatographic and spectral characteristics of anthocyanins from mulberry
此外,花色苷的紫外吸收光谱还可确定花色苷元及糖基取代种类及位置。花色苷的紫外可见吸收光谱在紫外光区有相似的吸收,但是在可见光区的吸收差异较为明显。紫外吸收光谱测定值可以确定糖苷在花色素分子上的连接位置,花色苷分子中C3羟基总是糖基化的,此外糖基化也可发生在C5、C7、C3'、C5'的羟基。花色素分子糖基化后,可见光区谱图最大特征吸收波长(λmax)向短波方向移动(即蓝移)。这种蓝移效应取决于糖基化羟基的数目和位置。最大的蓝移效应发生在花色素的C3引入糖苷。天竺葵色素、矢车菊素、飞燕草素在C3引入糖苷,蓝移波长都在 10nm以上,如:天竺葵色素 λmax是520nm,它的C3糖苷为505nm;其在C5引入糖苷,蓝移波长约为7nm。C3和C5糖基化与C3糖基化在光谱最大特征吸收处得差异较小。据J.B.Harborne的测算,花色苷C3和C5双糖糖基化的A440/AλVis-max值是C3单糖糖基化的一半,因此,根据A440与AλVis-max的比值并结合J.B.Harborne的计算值可以判断糖基化的位置[13]。由表1可知,三种花色苷的A440/AλVis-max值都在30及以上,表明糖取代基处在花色苷的C3的羟基上。三个色谱峰在300~330nm处都没有明显的吸收峰存在,说明花色苷分子没有发生酰化,此外,矢车菊苷A440/AλVis-max的平均值在30左右,而天竺葵色素苷 A440/AλVis-max在40左右[8],可以初步确定峰1和峰2为矢车菊素单糖苷,而峰3为天竺葵色素单糖苷。
2.3 花色苷的质谱分析
液质的单级四极杆质谱检测器决定了质谱图只能得到一级质谱图(或分子离子峰谱图),但可以通过调节碰撞诱导解离电压值,在离子源内将部分分子离子峰打碎,对碎片离子进行分析推断得到化合物的结构,故本实验在70V和200V电压范围内优化了质谱的碰撞诱导解离电压,在低电压下,质谱图仅能得到花色苷分子离子谱图,在高电压下,只有碎片离子峰谱图,都难以分析组分的结构和分子量,而在150V条件下,谱图中既可得到分子离子峰和强度适中的花色苷元碎片离子,便于分析推断花色苷的结构。

图3 桑葚花色苷(峰1、峰2和峰3)ESI+质谱图Fig.3 ESI+-MS spectra of mulberry anthocyanins(Peak 1,Peak 2 and Peak 3)
由峰1的质谱图可知,其分子离子[M+H]+为m/z 449.1,碎片离子为 m/z 287.0,是由分子离子丢失了一个162葡萄糖的中性碎片而得。由于对照品矢车菊素3-葡萄糖苷的保留时间与峰1的保留时间一致,因此,峰1所代表的花色苷是葡萄糖和矢车菊形成的苷。确定峰1为矢车菊3-葡萄糖苷。
由峰2的质谱图可知,其分子离子[M+H]+为m/z 596.5,碎片离子为m/z 287,分子离子丢失一个芸香糖的中性碎片即为矢车菊素的碎片离子,故推断峰4为矢车菊素3-芸香糖苷,矢车菊3-葡萄糖苷和矢车菊素3-芸香糖苷是桑葚含有的最普遍、含量最高的花色苷,与文献报道的结果一致[6]。
由峰3的质谱图可知,其分子离子[M+H]+为m/z 433.1,碎片离子为m/z 271,分子离子丢失一个葡萄糖的中性碎片即为天竺葵色素的碎片离子,结合光谱及文献数据[14],故推断峰3为天竺葵素3-葡萄糖苷。

图4 野生桑葚中花色苷成分的结构图Fig.4 Structure of mulberry anthocyanins
3 结论
采用固相萃取纯化技术和高效液相色谱-电喷雾质谱联用技术可以方便、快捷、可靠地分析桑葚中花色苷的含量和成分。结果表明,野生桑葚中总花色苷含量为154.27mg/100g,含有的花色苷为矢车菊3-葡萄糖苷、矢车菊3-芸香糖糖苷、天竺葵素3-葡萄糖苷,相对含量分别为67.52%、31.29%和1.06%。
[1]邱长玉,朱方容,林强.桑果的利用与开发前景[J].广西蚕业,2009,46(3):63-66.
[2]Huang H P,Y C Chang,C H Wu,et al.Anthocyanin-rich Mulberry extract inhibit the gastric cancer cell growth in vitro and xenograft mice by inducing signals of p38/p53 and c-jun[J].Food Chemistry,2011,129:1703-1709.
[3]Basu A,M Rhone,T J Lyons.Berries:emerging impact on cardiovascular health [J].Nutrition Reviews,2010,68(3):168-177.
[4]Wang R J,M L Hu.Antioxidant capacities of fruit extracts of five mulberry genotypes with different assays and principle components analysis[J].International Journal of Food Properties,2010,14(1):1-8.
[5]霍琳琳,苏平,吕英华.分光光度法测定桑葚总花色苷含量的研究[J].酿酒,2005,32(4):88-89.
[6]Du Q,J Zheng,Y Xu.Composition of anthocyanins in mulberry and their antioxidant activity[J].Journal of Food Composition and Analysis,2008,21(5):390-395.
[7]Pan Y L.Progress and prospect of germplasm resources and breeding of mulberry[J].Acta Sericologic Sinica,2002,26:1-8.
[8]Tian Q,M M Giusti,G D Stoner,et al.Characterization of a new anthocyanin in black raspberries(Rubus occidentalis)by liquid chromatography electro-spray ionization tandem mass spectrometry[J].Food Chemistry,2006,94(3):465-468.
[9]Denev P,M Ciz,G Ambrozova,et al.Solid-phase extraction of berries'anthocyanins and evaluation of their anti-oxidative properties[J].Food Chemistry,2010,123(4):1055-1061.
[10]Chandra A,J Rana,Y Li.Separation,identification,quantification,and method validation of anthocyanins in botanical supplement raw materials by HPLC and HPLC-MS[J].Journal of Agricultural and Food Chemistry,2001,49(8):3515-3521.
[11]Wrolstad R E,T E Acree,E A Decker,et al.Handbook of food analytical chemistry:pigments,colorants,flavors,texture,and bioactive food components[M].John Wiley & Sons,Inc,2005:10-11.
[12]Dai J,R J Mumper.Plant phenolics:extraction,analysis and their antioxidant and anticancer properties[J].Molecules,2010,15(10):7313-7352.
[13]Harborne J.Spectral methods of characterizing anthocyanins[J].Biochemical Journal,1958,70(1):22.
[14]Mullen W,M E J Lean,A Crozier.Rapid characterization of anthocyanins in red raspberry fruit by high-performance liquid chromatography coupled to single quadrupole mass spectrometry[J].Journal of Chromatography A,2002,966(1-2):63-70.
Analysis of compositions of anthocyanins in wild mulberry
CHEN Liang1,2,XIN Xiu-lan2,*,YUAN Qi-peng1,*
(1.State Key Laboratory of Chemical Resource Engineering,Beijing University of Chemical Technology,Beijing 100029,China;2.Beijing Electronic Science and Technology Vocational College,Beijing 100029,China)
TS255.1
A
1002-0306(2012)15-0307-04
2011-12-05 *通讯联系人
陈亮(1986-),男,博士生,主要从事天然产物的分离纯化研究。
公益性行业(农业)科研专项(201103037);北京市属高等学校人才强教深化计划资助项目;北京市职业院校职教名师资助项目。

