镉在虾夷扇贝的沉积及对GPx、GST的影响
孟晓林,刘梅,王宝杰,蒋克勇,田雪,王雷
(1.中国科学院 海洋研究所,山东 青岛266071;2.中国科学院 研究生院,北京100049;3.山西农业大学 动物科技学院,山西 太谷030801)
虾夷扇贝(Mizuhopecten yessoensis)隶属于软体动物门(Mollusca)瓣鳃纲(Lamellibranchiata),珍珠贝目(Pterioida),扇贝科(Pectinidae),是中国北部重要的海水养殖品种。到2005年,年产量已达到15万吨。近些年来,由于夏季环境高温、气候变化以及人类活动,沿海水体相关的环境因子已经发生了极大的变化,并且对虾夷扇贝养殖业造成了巨大的损害[1]。
重金属是对生态环境造成极大危害的污染物,具有来源广、残毒时间长、易蓄积、污染后不易被发现且难于恢复等特征,并且对无脊椎动物具有极大的毒性[2]。其中镉(Cadmium,Cd)是目前我国渤海湾海域污染比较严重的重金属[3],因此研究其在虾夷扇贝体组织的蓄积规律和毒性作用具有重要意义。谷胱甘肽过氧化物酶(Glutathione peroxidase,GPx)是一种重要的内源性抗氧化蛋白并且广泛分布于耗氧的生物体组织中,它通过催化过氧化氢还原为水调节组织的抗氧化防御反应[3]。谷胱 甘 肽 硫 转 移 酶 (Glutathione S-transferases,GSTs)是谷胱甘肽复合物解毒酶家族中的重要组成部分,它可增加异源物质的可溶性并使其从细胞中排出[4]。由于GPx、GST在解毒和抗氧化防御中的重要作用,已有研究将其作为环境监控生物标志物[5],但对于在重金属作用下机体相关酶活性的变化还存在诱导或抑制的不同研究结论[6,7]。本研究以不同浓度的Cd在亚急性毒性条件下分别胁迫虾夷扇贝,通过对其鳃、消化腺中两种重金属含量及GPx、GST活性的检测,初步研究了Cd在虾夷扇贝体组织内的沉积规律及对谷胱甘肽依赖性酶活性的影响,明确了GPx、GST作为虾夷扇贝Cd污染生物标志物的可行性。
1 材料与方法
1.1 实验扇贝的来源及养殖条件
成体虾夷扇贝购自大连獐子岛渔业公司。挑选健康及壳高大小为8.730±0.167cm(means±SD,n=30)的虾夷扇贝作为实验用贝。将扇贝在实验条件下养殖于温度为16±1℃及盐度为30‰的过滤海水中,所用海水来源于青岛第一海水浴场。暂养及实验期间以螺旋藻作为饵料进行投喂,并24h不间断充氧,每天换水一半,实验期所换海水以损失的Cd离子进行补充。暂养期为7d。
1.2 实验设计
Cd实验组共4组(1个对照组及3个胁迫组),每组设3个平行,每平行随机放养25只实验用贝于50×40×30cm3的塑料水族箱中。所用胁迫试剂为CdCl2·2.5H2O(购自Sigma公司),加入海水中使Cd2+终浓度分别为0mg·L-1、0.05 mg·L-1、0.1mg·L-1、0.2mg·L-1。Cd的含量为中国渔业水质标准的0、10、20及40倍。实验期为14d,分别在0d、1d、3d、6d、10d、14d随机选取3只虾夷扇贝,并对鳃、消化腺组织采样,冻存于-80℃冰箱供测试分析备用。
1.3 Cd含量测定
取0d、3d、6d、10d、14d的虾夷扇贝鳃、消化腺组织,于60℃烘箱中48h烘干至恒重,取约0.5 g鳃或0.2g消化腺加入30mL大小的特氟龙管中,并加入6mL HNO3在室温下放置1h。将溶液在100℃条件下煮沸6h至澄清,将剩余物在100℃条件下溶解于6mL 1%的HNO3溶液中。Cd含量采用电感耦合等离子质谱仪(ICP-MS,Elan 6100,美国)测定。
1.4 GPx、GST活力测定
取适量虾夷扇贝鳃、消化腺组织,称量后置于10倍体积的预冷缓冲液中(pH 7.5,0.01mol·L-1Tris-HCl,0.0001mol·L-1EDTA-2Na,0.01mol·L-1蔗糖),并在匀浆器上匀浆,匀浆液于4℃条件下10 000g·min-1离心10min,取上清液待测。
GPx活性测定参照Xia等[8]改进的方法进行。活力单位定义为:每毫克组织蛋白质,每分钟扣除非酶反应的作用,使反应体系中GSH浓度降低1 nmol为一个酶活性单位/U·mg-1protein·min-1。
GST活力测定参照Habig等[9]的方法经改进后进行测定。酶活力定义为:每分钟每毫克蛋白催化产生1nmol的2,4二硝基苯谷胱甘肽(2,4-dinitrophenyl glutathione)定义为一个酶活力单位/U·mg-1protein·min-1。
蛋白含量测定采用BradfordG-250染色法进行[10]。所有吸光值均在Powerwave XS2(BioTek,美国)酶标仪上测定。
1.5 数据处理与分析
所有数据均以平均值±标准差(means±SD)表示,所有实验数据均与对照组进行比较,并采用单因素方差分析(ANOVA)和LSD法进行检验。统计软件采用SPSS16.0,取P<0.05做为差异性显著标准。
2 结果与分析
2.1 Cd在虾夷扇贝鳃、消化腺组织的生物累积
亚急性浓度Cd胁迫实验表明(图1),对照组鳃、消化腺组织实验期间Cd的含量分别为1.8~3.2μ·g-1和2.41~2.93μ·g-1。两组织中最大Cd沉积分别出现在10d,0.2mg·L-1胁迫组(鳃,134.20μg·g-1)和14d,0.1mg·L-1胁迫组(消化腺,109.20μg·L-1)。与对照组相比,分别提高了52倍和36倍。鳃组织中0.1mg·L-1、0.2mg·L-1胁迫组Cd的沉积于10d均达到最大值,后开始下降,而消化腺组织中各组Cd沉积浓度均随着胁迫浓度升高、胁迫时间的延长而增大,并且消化腺组织中Cd的累积明显高于鳃组织中Cd的累积。

图1 Cd在虾夷扇贝鳃(A)、消化腺(B)组织中的生物累积Fig.1 Accumulation of cadmium (Cd)in gill(A)and digestive gland(B)of Japanese scallop.
2.2 Cd对虾夷扇贝鳃、消化腺组织GPx活力的影响
亚急性浓度Cd胁迫对虾夷扇贝鳃、消化腺组织GPx活性影响表明(图2),两组织中GPx活性总体随胁迫时间的延长呈先升高后下降的趋势。其中鳃组织在0.05mg·L-1、0.1mg·L-1、0.2 mg·L-1胁迫条件下,分别于6d、3d和1d达到最大值,0.2mg·L-1胁迫组GPx活性在14d达到显著抑制(P<0.05)。消化腺组织在0.2mg·L-1胁迫条件下,于1d达到最大值,在0.05mg·L-1、0.1mg·L-1胁迫条件下,于3d达到最大值。消化腺组织GPx活性显著高于鳃组织。
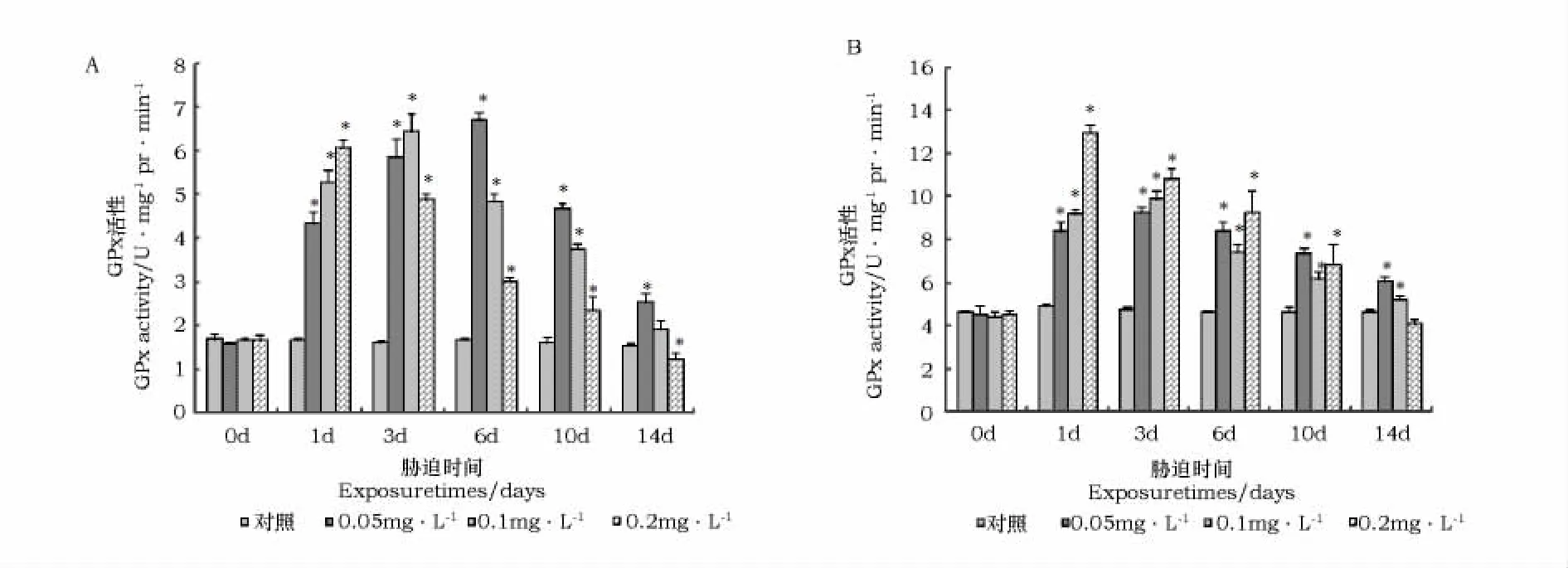
图2 Cd胁迫对虾夷扇贝鳃(A)、消化腺(B)GSH-Px活性的影响Fig.2 The effect of Cd on GSH-Px activity in gill(A)and digestive gland(B)of M.yessoensis
2.3 Cd对虾夷扇贝鳃、消化腺组织GST活性的影响
亚急性浓度Cd胁迫对虾夷扇贝鳃组织GST活性的影响表明(图3A),各胁迫浓度随胁迫时间均呈现先升高后下降趋势,0.05mg·L-1、0.1mg·L-1、0.2mg·L-1分别于10d、6d和1d达到最大值。0.2mg·L-1胁迫组在1d后,GST活性显著下降,6d时与对照相比出现显著性抑制(P<0.05)。
Cd胁迫对消化腺组织GST活性影响表明(图3B),0.2mg·L-1胁迫组在胁迫1d时GST活性出现显著性抑制(P<0.05),后逐步上升。0.05 mg·L-1、0.1mg·L-1胁迫组均呈现先升高后下降趋势,最大值均出现在6d。
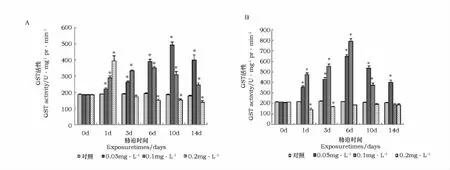
图3 Cd胁迫对虾夷扇贝鳃(A)、消化腺(B)GST活性的影响Fig.3 The effect of Cd on GST activity in gill(A)and digestive gland(B)of M.yessoensis
3 讨论
虾夷扇贝对不同重金属在不同组织间的累积存在较大的差异性[11],本研究结果表明,随着胁迫浓度的增加,Cd在鳃及消化腺组织中的累积均出现了极显著的上升,呈现明显的线性关系。此外发现,鳃组织中0.1mg·L-1、0.2mg·L-1组Cd的含量在10天后下降,说明在前10天的胁迫时间内,细胞内金属绑定配体持续性的与金属离子结合,Cd离子穿过细胞膜而在组织细胞内沉积下来,但10d后由于胞内金属绑定配体绑定位点的饱和,金属离子不在结合,而出现下降。但消化腺组织在整个14天实验期内Cd离子含量均随着时间的延长而增加,这可能与消化腺组织是主要的解毒器官,对金属离子的耐受力更强有关。这与Choi研究结果一致[12]。
抗氧化防御体系是机体受到异源物质胁迫时重要的代谢调节机制,其中谷胱甘肽过氧化物酶(GPx)通过消除H2O2来减少机体损伤。前人研究表明当双壳贝类受到低浓度重金属胁迫或短时间胁迫的条件下,抗氧化酶均出现上升,但随着浓度的上升、胁迫时间的延长,酶活性可能会出现降低甚至抑制[13]。这与本研究结果相一致。Wang等对蛤的研究显示,不同浓度Cd胁迫下,鳃及消化腺GPx活性在胁迫24h时均出现最大值,而本研究结果显示,高浓度(0.2mg·L-1)胁迫条件下,GPx活性均在24h出现高峰,而中低浓度胁迫下(0.05mg·L-1、0.1mg·L-1),GPx活性最大值则出现在3d或6d。这可能和物种不同对Cd的耐受力不同有关。
谷胱甘肽硫转移酶(GST)主要功能是催化某些内源性或外来有害物质的亲电子基团与还原型谷胱甘肽的巯基偶联,增加其疏水性使其易于穿越细胞膜,分解后排出体外,从而达到解毒的目的,保护DNA及一些蛋白质免受损伤[14]。本研究结果显示,中低浓度Cd(0.05mg·L-1、0.1mg·L-1)胁迫条件下,随着胁迫时间的延长,GST活性表现出先升高后降低的趋势,这与 Wang[15]对蛤仔(Ruditapes philippinarum)研究的结果相一致。但在高浓度(0.2mg·L-1)胁迫条件下,鳃中GST在24小时达到最大值后迅速降低,消化腺中GST则出现显著性抑制。这可能与在高浓度下短时间内虾夷扇贝鳃及消化腺细胞受到严重损伤相关。此外,研究结果表明消化腺中GPx、GST活性均高于鳃组织,进一步验证了消化腺是虾夷扇贝的主要解毒器官,而鳃是主要的滤过性器官。
生物标志物(biomarkers)常被用来侦测和诊断毒性物质对海洋生物的影响,对其在分子和细胞水平的检测被推荐用作生物影响评估的早期监测工具[16]。本研究显示虾夷扇贝鳃、消化腺组织GPx、GST活性在不同浓度的Cd胁迫条件下均显现出了敏感、显著的变化,据此我们推断GPx、GST可作为虾夷扇贝养殖过程中受到Cd污染时的早期环境生物监测的敏感生物标志物。
[1]Liu W,He C,Li W,et al.Discovery of host defence genes in the Japanese scallop Mizuhopecten yessoensis Jay by expressed sequence tag analysis of kidney tissue[J].Aquac Res,2010,41:1602-1613.
[2]Viarengo A,Heavy metals in marine invertebrates:mechanisms of regulation and toxicity at the cellular level.Rev[J].Aquat Sci,1989,1(2):295-317.
[3]彭士涛,胡焱弟,白志鹏.渤海湾底质重金属污染及其潜在生态风险评价[J].水道港口,2009,30(1):57-60.
[4]Salazar-Medina A,Garcia-Rico L,Garacia-Orozco K,et al,Inhibition by Cu2+and Cd2+of a mu-class glutathione S-transferase from shrimp Litopenaeus vannamei[J].J Biochem Mol Toxic,2010,24(4):218-222.
[5]Cunha I,Mangas-Ramirez E,Guilhermino L.Effects of copper and cadmium on cholinesterase and glutathione S-transferase activities of two marine gastropods(Monodonta lineata and Nucella lapillus)[J].Comp Biochem Phys C,2007,145(4):648-657.
[6]Canesi L,Viarengo A,Leonzio C,et al.Heavy metals and glutathione metabolism in mussel tissues[J].Aquat Toxicol,1999,46(1):67-76.
[7]Moreira S,Guilhermino L.The use of Mytilus galloprovincialis acetylcholinesterase and glutathione S-transferases activities as biomarkers of environmental contamination along the northwest Portuguese coast[J].Environ Monit Assess,2005,105(1):309-325.
[8]Xia Y,Zhu L.Measurement method of glutathione peroxidase activity in blood and tissue[J].Hygi Res,1987,16(4):29-33.
[9]Habig,W H,M J Pabst,W B Jakoby.Glutathione S-transferases[J].J Biol Chem,1974.249(22):7130.
[10]Bradford M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72:248-254.
[11]王军,翟毓秀,宁劲松,等.养殖虾夷扇贝不同组织中重金属含量的分布[J].海洋科学,2009,33(8):44-47.
[12]Choi H J,Ji J,Chung K H,et al.Cadmium bioaccumulation and detoxification in the gill and digestive gland of the Antarctic bivalve Laternula elliptica[J].Comp Biochem Phys C,2007,145(2):227-235.
[13]Wang X,Yang H,Liu G,et al.Enzyme responses and lipid peroxidation in gills and hepatopancreas of clam Mactra vereformis,following cadmium exposure[J].Chinese Journal of Oceanology and Limnology,2011,29(5):981-989.
[14]马森.谷胱甘肽过氧化物酶和谷胱甘肽转硫酶研究进展[J].动物医学进展,2008,29(10):53-56.
[15]Wang L,Pan L,Liu N,et al.Biomarkers and bioaccumulation of clam Ruditapes philippinarum in response to combined cadmium and benzo[α]pyrene exposure[J].Food Chem Toxicol,2011,49(12):3407-3417.
[16]Cajaraville M P,Bebianno M J,Blasco J,et al.The use of biomarkers to assess the impact of pollution in coastal environments of the Iberian Peninsula:apractical approach[J].The Science of The Total Environment,2000,247:295-311.

