饲粮添加益生菌与酶制剂对黄羽肉鸡生长性能的影响及相关机理
林 谦 戴求仲 宾石玉 蒋桂韬 张建华 张 旭 王照群 王向荣
(1.湖南省畜牧兽医研究所动物营养与饲养技术研究室,长沙 410131;2.广西师范大学生命科学学院,桂林 541004;3.湖南农业大学动物科学技术学院,长沙 410128)
在畜牧养殖业迅猛发展的当代,抗生素在畜禽饲料生产中大量使用已成为常态,有数据显示全球抗生素总产量的50%左右被用于畜牧养殖行业。但抗生素使用带来的抗生素在畜产品中残留对人类健康的危害、过量排泄对环境的污染、长期使用导致耐药菌株产生等问题也成为人们日益关注的焦点。目前很多国家已经禁止或限制了抗生素在饲料中的使用,无抗畜禽产品将成为发展主流,而当前酶制剂与益生菌制剂作为安全、绿色的饲料添加剂引起了极大的关注。酶与益生菌联用对肉鸡生长性能影响的研究报道比较多见,但不同试验间结果[1-3]差异较大,而以黄羽肉鸡作为试验动物的相关研究较少,从机理层面进行的相关探讨更是少见,项延润[4]报道益生菌与酶制剂联用替代抗生素饲喂70日龄左右的广西三黄鸡,结果显示试验组生长速率、存活率及增重耗料比比对照组均有一定的提高,并能促进多种养分的消化吸收,改善肠道微生态区系;李旭红[5]研究显示,在长沙黄鸡饲粮中组合添加100 g/t益生素和0.1%复合酶制剂,试验组肉鸡健康水平、存活率及平均日增重(ADG)比饲喂基础饲粮的对照组更高,而料重比(F/G)较对照组下降2.65%,差异显著(P<0.05),增重成本也下降0.16%。本试验即研究复合酶制剂、益生菌制剂和抗生素对黄羽肉鸡生长性能、养分代谢率与肠道形态结构的影响,考察复合酶制剂与益生菌制剂联用是否具有协同效应及其替代抗生素饲料添加剂的可行性,寻求提高黄羽肉鸡生长性能的最佳添加剂组合,为促进黄羽肉鸡的科学养殖和提高该产业的综合效益提供参考和技术支持。
1 材料与方法
1.1 试验材料
益生菌制剂为复合芽孢杆菌制剂,含枯草芽孢杆菌和地衣芽孢杆菌,由武汉市雄峰科技有限公司提供,有效活菌含量为5×1010CFU/g。
酶制剂为固体复合酶,由上海尤特尔生化有限公司提供,主要成分为酸性纤维素酶(酶活≥2 000 U/g)、木聚糖酶(酶活≥30 000 U/g)。
抗生素采用抗敌素(硫酸黏杆菌素),由广州兴达动物药业有限公司生产,纯度为10%。
1.2 试验动物与分组
选择675羽遗传背景相同、同批次、发育正常的5日龄健康雌性黄羽肉鸡,随机分为5个处理,每个处理设5个重复,每个重复为27羽。各组鸡初始体重无显著差异(P>0.05)。试验在湖南省畜牧兽医研究所试验鸡场内进行,整个试验期按试鸡日龄分为5~28日龄和29~53日龄2个阶段,全期共48 d。
采用单因素随机设计试验,其中空白Ⅰ组饲喂基础饲粮,Ⅱ、Ⅲ、Ⅳ和Ⅴ组饲喂分别在基础饲粮中添加25 g/t益生菌制剂、150 g/t复合酶制剂、150 g/t复合酶制剂 +25 g/t益生菌制剂以及300 g/t抗敌素的试验饲粮。试鸡前期采用粉料饲喂,后期采用颗粒料饲喂。
1.3 基础饲粮及营养水平
基础饲粮参照 NRC(1994)[6]和 NY/T 33—2004《鸡饲养标准》[7]中的黄羽肉鸡营养需要,选用玉米、豆粕、次粉、米糠、菜籽粕等原料配制而成,由湖南光大牧业科技有限公司饲料厂加工生产。其组成及营养水平见表1。
1.4 饲养管理
试鸡采用网上平养,人工持续光照制度,育雏时采用红外灯供暖,保持正常温度,第1周33~34℃,第2周27~31℃,其后视具体气温情况供暖;鸡舍自然通风,定期打扫鸡舍卫生,相对湿度保持在55% ~65%;自由饮水和采食(计量不限量),按常规免疫。
1.5 测试指标与方法
1.5.1 生长性能
试验期间每天记录鸡只死亡情况,按重复记录饲料消耗量,分别于5、28和53日龄早晨称试鸡空腹重(提前12 h停饲),称各重复剩余料重,并计算各处理各阶段和全期的平均日采食量(ADFI)、ADG和F/G及各处理的全期存活率。
1.5.2 养分代谢率
饲养试验结束后,于54日龄分别从各处理中选择接近平均体重、采食正常且无怪癖的健康黄羽肉鸡5羽(每个重复1羽)进行单笼代谢试验,测定各组对饲料干物质、蛋白质、粗纤维和能量的利用效率,另外选择5羽(每个处理1羽)接近平均体重、采食正常且无怪癖的健康黄羽肉鸡作为内源代谢组,测定试鸡的内源排泄量。代谢试验开始前先预饲5 d。正试期4 d,前2天为禁食排空期,禁食期间通过饮水每鸡每日补充葡萄糖50 g,于第3天进行强饲,每次强饲40~50 g各处理饲料并及时按个体进行记录,强饲后采用全收粪法分别收集每只鸡48 h的粪便,每日收集若干次,为防止样品储存期间腐败和氨的挥发损失,每次收集后加0.1 mol/L HCl搅拌均匀,混匀后立即置于-20℃下保存,全部粪尿收集完毕后冷冻干燥备测。在60~65℃烘箱干燥至恒重,置室内回潮24 h,称重、记录,作为风干粪重,然后将其粉碎,过40目筛,再将排泄物混合均匀,装袋封存并立即取样,在100~105℃下测定其绝干粪重(即干物质重);能量用全自动氧弹测热仪测定;粗蛋白质含量用凯氏定氮法测定;粗纤维含量用采用酸碱消煮法测定。养分真代谢率计算公式如下:

1.5.3 肠黏膜形态
在饲养试验54日龄早晨,从每个处理随机选取10只(每个重复2只)接近该处理平均体重的试鸡,屠宰剔出肠道后,立即分离十二指肠、空肠、回肠,采集肉鸡十二指肠、空肠和回肠中段2 cm左右,剪开展平,用玻璃棒轻轻挑去其中内容物,再用生理盐水轻轻涮洗干净,并用滤纸吸干残余水分后,置于10%甲醛磷酸缓冲液中固定。接着将固定的标本经脱水→透明→浸蜡→包埋→修块→切片→展片→常规苏木精-伊红(HE)染色等处理后,制成石蜡切片。之后用显微镜在100倍、250倍和400倍下随机选择多个非连续性视野观察切片,并在100倍下挑选典型视野拍摄成图片,比较各处理肉鸡肠绒毛形态结构发育状况。并用图象分析软件系统进行观察分析,测定平均肠绒毛长度和隐窝深度,计算肠绒毛长度/隐窝深度(V/C)。
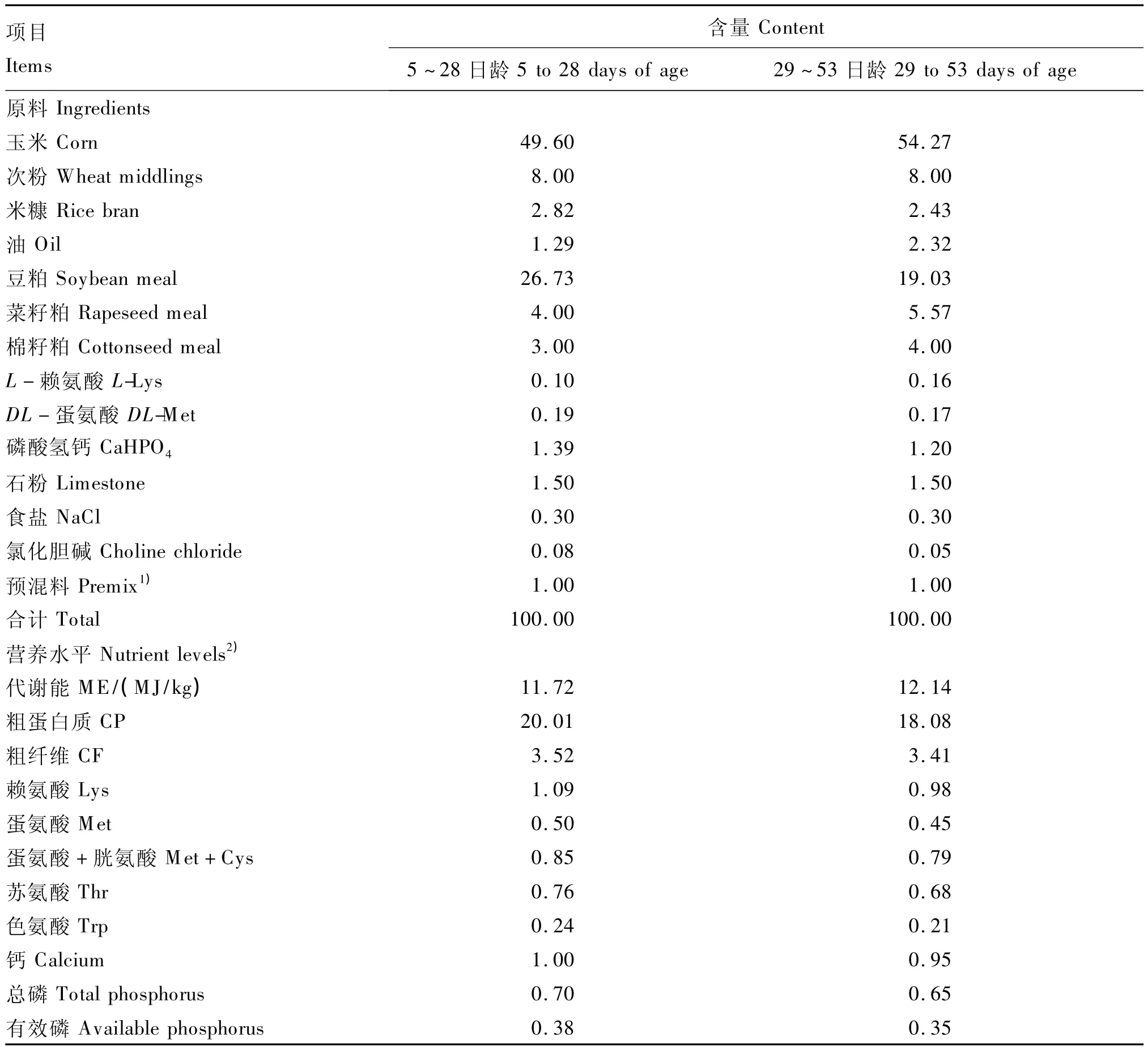
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of basal diets(air-dry basis) %
1.6 数据处理与统计分析
试验数据用Excel 2003软件进行初步处理后,采用SPSS 13.0统计软件进行单因素方差分析(one-way ANOVA),若组间差异显著,则采用Duncan氏法进行多重比较,显著水平为P<0.05。试验结果以“平均值±标准差”表示。
2 结果与分析
2.1 益生菌与酶制剂对黄羽肉鸡生长性能的影响
由表2可知,各组间全期存活率无显著差异(P>0.05),且均在97%以上,但空白Ⅰ组的全期存活率最低。
5~28日龄时,各组间ADG差异不显著(P>0.05),但益生菌Ⅱ组ADG最佳,且Ⅱ、Ⅲ、Ⅳ3组ADG均略高于空白Ⅰ组及抗生素Ⅴ组。关于ADFI,酶制剂Ⅲ组显著高于空白Ⅰ组及组合添加Ⅳ组(P<0.05),而Ⅰ、Ⅱ、Ⅳ、Ⅴ 4组间 ADFI差异不显著(P>0.05)。酶制剂Ⅲ组F/G最高,Ⅰ、Ⅱ、Ⅳ、Ⅴ4组间F/G无显著差异(P>0.05)。
29~53日龄时,组合添加Ⅳ组ADG最佳且较空白Ⅰ组及抗生素Ⅴ组分别提高了5.32%(P<0.01)和3.09%(P>0.05),同时还显著优于益生菌Ⅱ组(P<0.05)。各组间ADFI、F/G无显著差异(P>0.05),但组合添加Ⅳ组 ADFI最高,F/G最低。
从试验全期(5~53日龄)来看,组合添加Ⅳ组的ADG最高,比抗生素Ⅴ组提高了2.12%(P>0.05),且较空白Ⅰ组提高了4.22%,差异显著(P<0.05),Ⅰ、Ⅱ、Ⅲ和Ⅴ组间无显著差异(P>0.05)。同时各组间ADFI和F/G也均无显著差异(P>0.05),不过组合添加Ⅳ组的ADFI最高且获得了最优的F/G。
2.2 益生菌与酶制剂对黄羽肉鸡养分代谢率的影响
由表3可知,酶制剂Ⅲ组、组合添加Ⅳ组真代谢能均极显著高于空白Ⅰ组和益生菌Ⅱ组(P<0.01),且组合添加Ⅳ组的真代谢能还高出抗生素Ⅴ组6.89%(P<0.05)。而各组间干物质真代谢率、粗蛋白质真代谢率均无显著差异(P>0.05),但抗生素及酶制剂单独添加有提高干物质真代谢率、粗蛋白质真代谢率的趋势。酶制剂Ⅲ组粗纤维真代谢率极显著高于Ⅰ、Ⅱ、Ⅴ组(P<0.01),显著高于组合添加Ⅳ组(P<0.05),而组合添加Ⅳ组的粗纤维真代谢率也要显著高于空白Ⅰ组(P<0.05),与抗生素Ⅴ组相比也略有提高(P>0.05)。
2.3 益生菌与酶制剂对黄羽肉鸡肠黏膜形态的影响
由各处理黄羽肉鸡肠道组织切片(图1)可见:各组十二指肠、空肠和回肠绒毛大致呈现出叶状、指状和柱状。空白Ⅰ组3段肠道的绒毛发育不良,排列不规则,大多较短粗,有较多破损及断裂的迹象,绒毛间界限模糊,单位视野中的肠绒毛数少;而Ⅱ、Ⅲ、Ⅳ、Ⅴ组的3段肠的绒毛比空白Ⅰ组均明显变长,比例相对协调,排列更整齐紧密,长度较均匀,绒毛间界限清晰,单位视野内肠绒毛数量较多,从总体上来看,以益生菌与酶制剂组合添加Ⅳ组和抗生素Ⅴ组的肠绒毛形态结构发育程度较好。
由表4可知,空白Ⅰ组十二指肠绒毛长度最短,而Ⅱ、Ⅳ2组的十二指肠绒毛长度相近且均在一定程度上高于其他3组,但各组间十二指肠绒毛长度差异不显著(P>0.05);十二指肠隐窝深度空白Ⅰ组和酶制剂Ⅲ组相对于其他组较浅,但各组间无显著差异(P>0.05);而酶制剂Ⅲ组的十二指肠V/C最高,但各组十二指肠V/C无显著差异(P>0.05)。
空肠绒毛长度,空白Ⅰ组最短,而抗生素Ⅴ组最长且显著高于空白Ⅰ组和酶制剂Ⅲ组(P<0.05),组合添加Ⅳ组空肠绒毛长度在一定程度上高于Ⅰ、Ⅱ、Ⅲ组,但不显著(P>0.05);空肠隐窝深度,抗生素Ⅴ组最深且极显著或显著深于空白Ⅰ组(P<0.01)及酶制剂Ⅲ组(P<0.05),Ⅱ、Ⅳ、Ⅴ3组间空肠隐窝深度差异不显著(P>0.05);空肠V/C,抗生素Ⅴ组最低,空白Ⅰ组和酶制剂Ⅲ组较高,但各组间均差异不显著(P>0.05)。
回肠绒毛长度,抗生素Ⅴ组最长且显著高于益生菌Ⅱ组(P<0.05),Ⅰ、Ⅱ、Ⅲ、Ⅳ组间以组合添加Ⅳ组的回肠绒毛长度最长,但均无显著差异(P>0.05);回肠隐窝深度,益生菌Ⅱ组显著深于其他各组(P<0.05),较空白Ⅰ组及抗生素Ⅴ组,其回肠隐窝深度分别降低了31.84%和36.36%,而Ⅰ、Ⅲ、Ⅳ、Ⅴ组间的回肠隐窝深度无显著差异(P>0.05);回肠V/C,益生菌Ⅱ组最高且显著高于Ⅰ、Ⅲ、Ⅳ3组(P<0.05),与抗生素Ⅴ组比,益生菌Ⅱ组的回肠V/C也较高(P>0.05),而Ⅰ、Ⅲ、Ⅳ、Ⅴ组的回肠V/C无显著差异(P>0.05)。
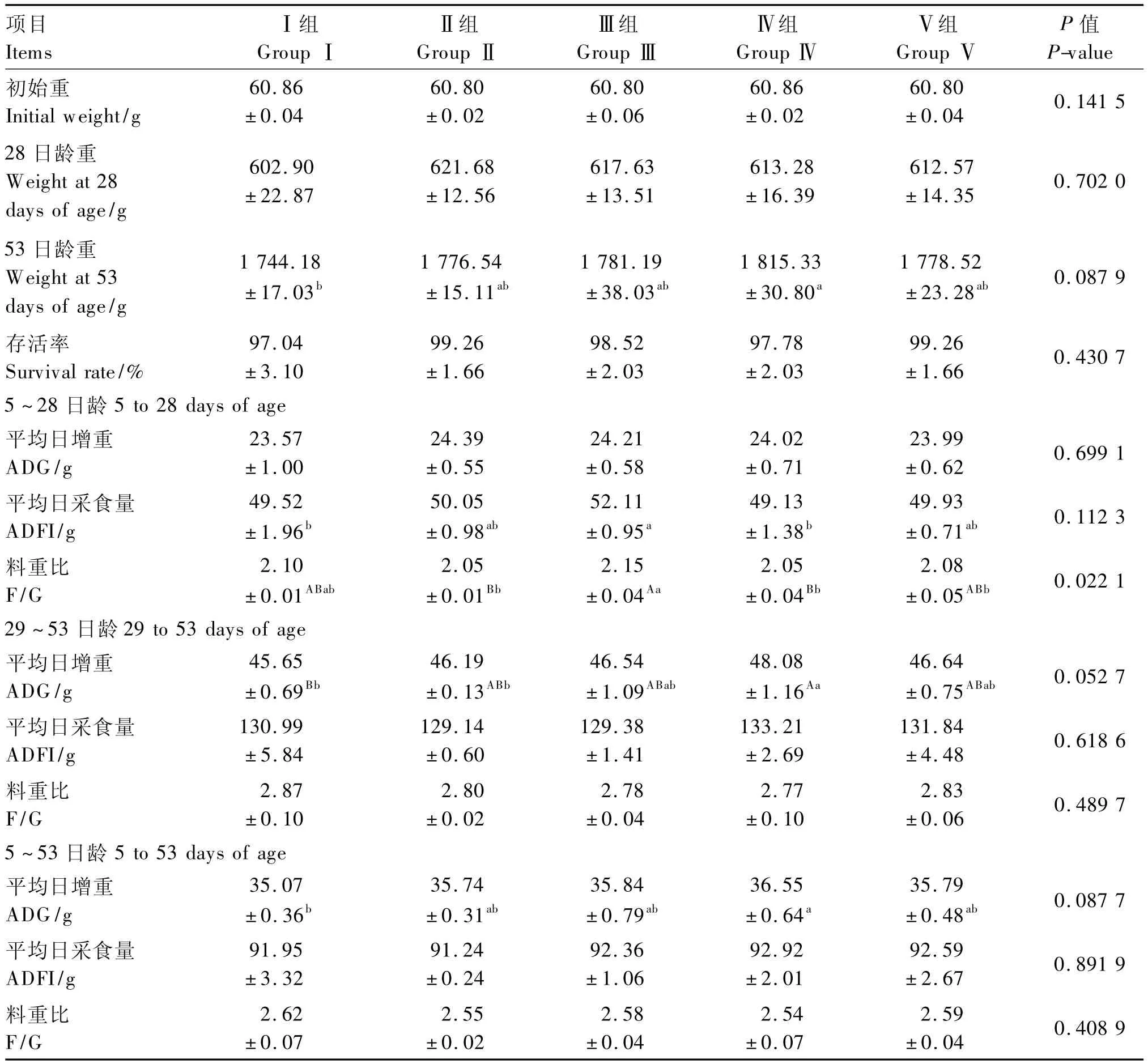
表2 益生菌与酶制剂对黄羽肉鸡生长性能的影响Table 2 Effects of probiotics and enzyme preparation on growth performance of yellow-feathered broilers
3 讨论
3.1 益生菌与酶制剂对黄羽肉鸡生长性能的影响
许多研究报道证实在肉鸡饲粮中组合添加合适比例的益生菌与酶制剂能够不同程度地提高试鸡的ADG及饲料利用率,改善肉鸡生长性能。本试验中,各组全期存活率均在97%以上,益生菌Ⅱ组及抗生素Ⅴ组更是达到99%以上,且各组间存活率无显著差异(P>0.05),说明在本试验条件下益生菌、酶制剂及两者联用与添加抗生素对黄羽肉鸡存活率均无较大影响。5~28日龄时,益生菌Ⅱ组获得了最高的ADG,而酶制剂Ⅲ组的ADFI最高,益生菌Ⅱ组与组合添加Ⅳ组的F/G一致且最低。说明益生菌在提高黄羽肉鸡前期生长性能方面具有很好的潜能,这与潘宝海等[8]、Yeo等[9]、Jin 等[10]的报道相一致。采食量是衡量动物摄入营养物质数量的尺度,动物采食的营养物质只有满足了维持需要后,多摄入的部分才能用于生产,因此,采食量是影响动物生产水平的重要因素[11]。而本试验的结果表明由木聚糖酶、纤维素酶等非淀粉多糖(NSP)酶类组成的复合酶制剂在试鸡生长前期不影响饲料适口性,并能够显著增加肉鸡的前期采食量(P<0.05),但对试鸡生长发育的提升作用不如益生菌。分析原因可能是:一方面试鸡前期受饲料、环境等干扰影响较大,饲喂益生菌能够减小应激反应;另一方面由于肉鸡生长前期消化系统尚未发育成熟,内源酶(如蛋白酶、淀粉酶)分泌不足,胃肠道吸收养分能力弱,成为制约肉鸡早期生长的限制性因素,而芽孢杆菌制剂可以直接产生一些营养物质并且具有较高的淀粉酶、蛋白酶活性,还能够产生一些试鸡本身不能合成分泌的酶类,如多种NSP酶、植酸酶等,同时其产生的挥发性脂肪酸可降低消化道pH,拮抗有害微生物,建立并维持良好的肠道微生态区系平衡,并且还具有免疫佐剂的作用,可以提升肉鸡机体的免疫水平[8,12-13],这些均能够更好地促进黄羽肉鸡机体发育,使肉鸡的消化吸收功能得到完善,从而提高试鸡前期生长性能。综合来看,益生菌与酶制剂联合使用对肉鸡前期生长性能提高具有一定效果,有替代抗生素的潜能,且益生菌在本试验条件下对提高肉鸡前期生长性能方面起主导作用。
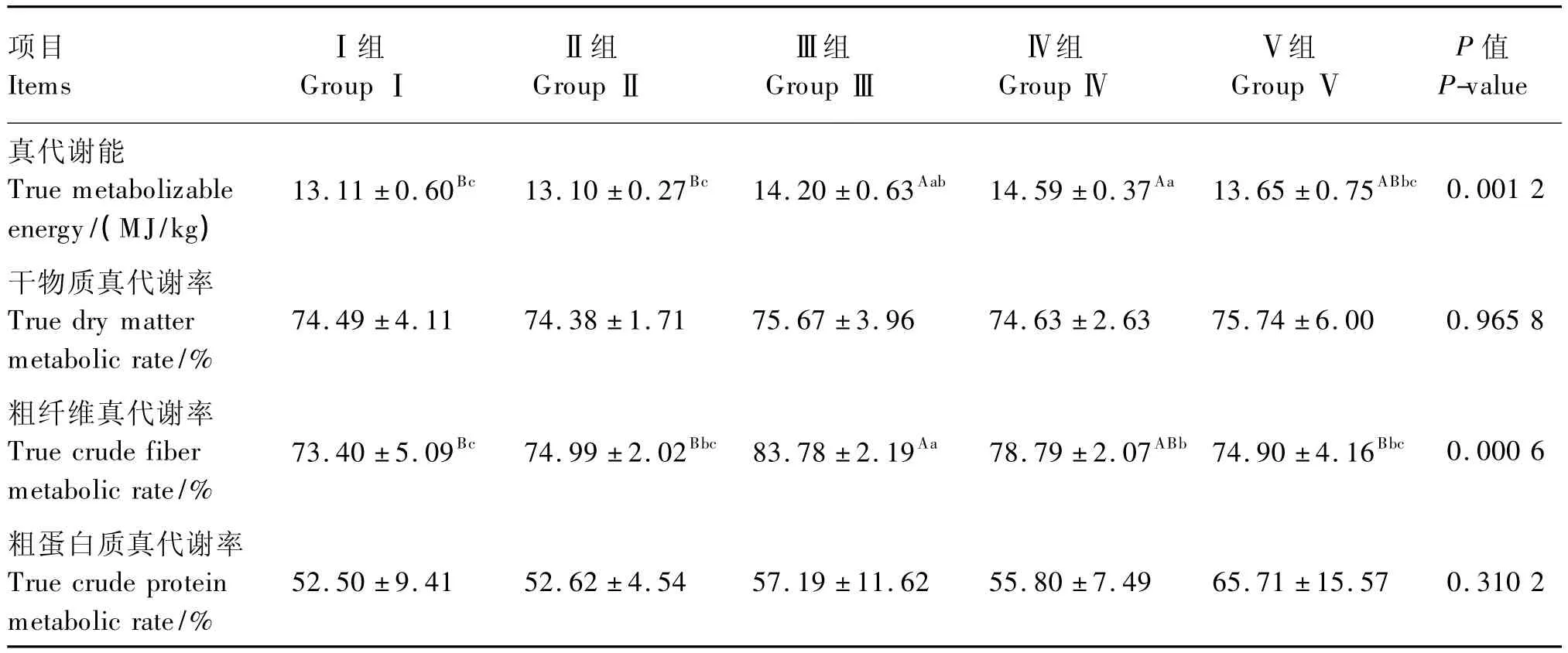
表3 益生菌与酶制剂对黄羽肉鸡养分代谢率的影响Table 3 Effects of probiotics and enzyme preparation on nutrient metabolic rates in yellow-feathered broilers
饲养试验后期,益生菌与酶制剂组合添加Ⅳ组获得了最佳的生长性能,而酶制剂Ⅲ组的ADG也显著高于空白Ⅰ组(P<0.05),与抗生素Ⅴ组增重水平相当(P>0.05),F/G也有较大下降(P>0.05),试验结果与李成良等[14]、蒋桂韬等[15]的接近,表明木聚糖酶、纤维素酶组成的复合酶制剂在肉鸡消化机能已经成熟的饲养试验后期对提高肉鸡后期的生长性能起着关键作用。原因主要是复合酶制剂的效用在该阶段得到了充分发挥,木聚糖酶、纤维素酶消除了饲料中的NSP类抗营养因子,充分破碎了植物性饲粮中的细胞壁成分,提高了饲粮营养价值,为肉鸡生长提供了充足的养分。而酶制剂与益生菌联用体现出了更好的效果,有替代抗生素添加剂的潜能。
从试验全期来看,益生菌Ⅱ组、酶制剂Ⅲ组及组合添加Ⅳ组各项生长性能指标均在一定程度上优于空白Ⅰ组,达到或超过抗生素Ⅴ组,且益生菌与酶制剂两者联合使用效果最佳。许多报道显示益生菌是动物体内酶的重要来源并可提高酶活性,同时外源酶制剂的加入提高了养分消化率,为益生菌也提供了生长所必需的营养物质,促进益生菌繁殖,两者有很强的协同作用[16-17]。而本试验结果结果也综合表明益生菌与酶制剂联合使用对提高肉鸡生长性能来说在本试验条件下能够起到替代抗生素添加剂的作用。
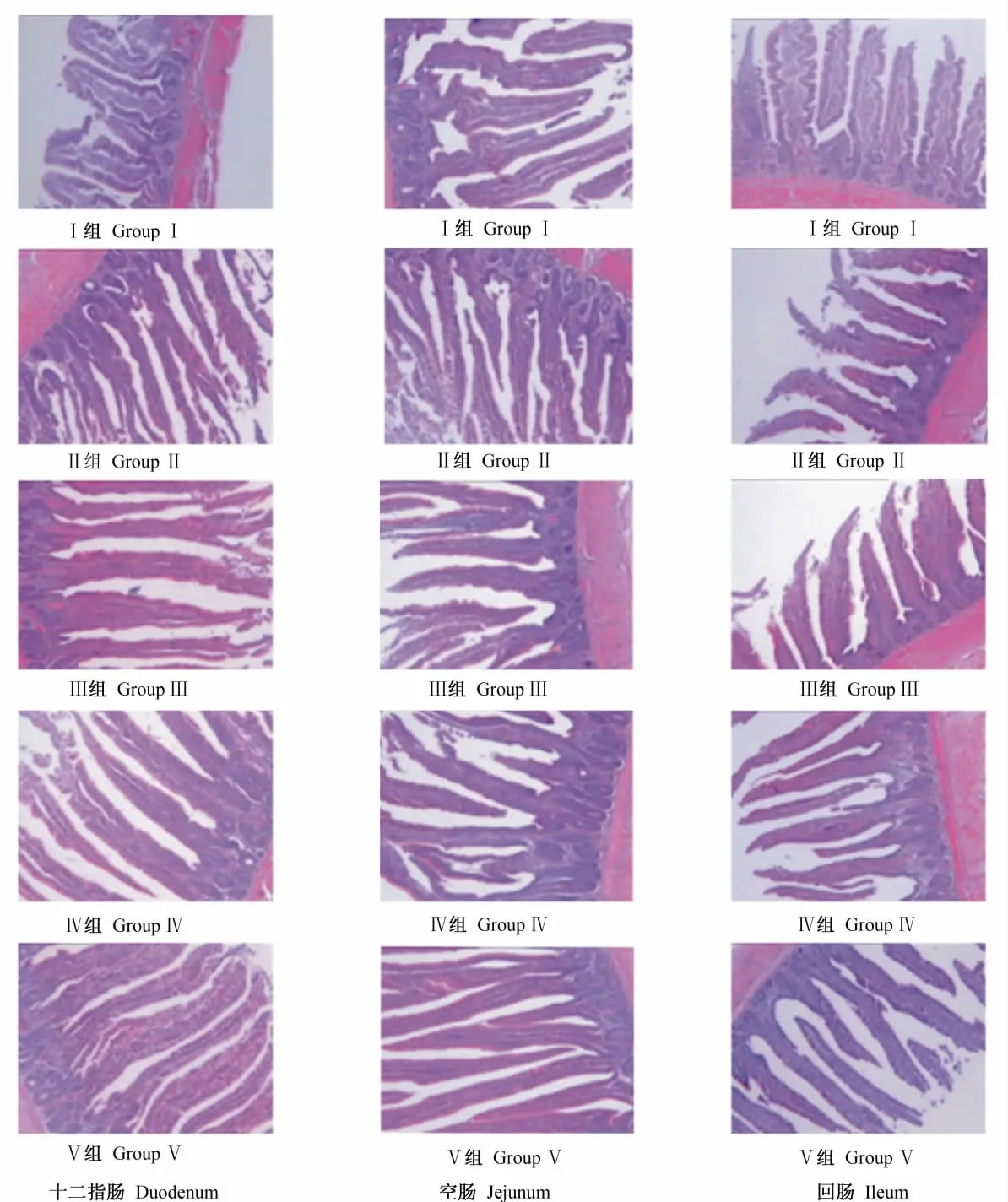
图1 5个饲粮处理黄羽肉鸡的肠道组织切片Fig.1 Intestine tissue sections in yellow-feathered broilers of five treatments(100×)
3.2 益生菌与酶制剂对黄羽肉鸡养分代谢率的影响
饲粮养分代谢率的高低直接影响着家禽的生长速度和生产性能[18],许多研究证实酶制剂与益生菌制剂单独使用有提高肉鸡代谢能及干物质、粗蛋白质、粗纤维等的代谢率的作用。计成等[19]研究发现,肉鸡饲粮中添加枯草芽孢杆菌可提高饲料中粗灰分、钙和磷的利用率(P<0.05),但不影响粗蛋白质利用率(P>0.05);蒋桂韬等[20]报道在小麦基础饲粮中添加250 mL/t细菌性木聚糖酶,试验组比对照组真代谢能及蛋白质、总氨基酸代谢率分别提高了0.29 MJ/kg、4.28%、0.93%(P>0.05)。然而目前鲜见有关于益生菌与酶制剂联用对黄羽肉鸡养分代谢率影响的报道。本试验中,组合添加Ⅳ组获得了最高的真代谢能,分别比空白Ⅰ组及抗生素Ⅴ组提高了1.48(P<0.01)和0.94 MJ/kg(P<0.05);酶制剂Ⅲ组的真代谢能也较高,对比空白Ⅰ组及抗生素Ⅴ组分别提高了1.09(P<0.01)和0.55 MJ/kg(P>0.05)。这表明益生菌与酶制剂组合添加可提高试鸡能量代谢水平,体现出了较强的联用加性效应。本试验中干物质真代谢率和粗蛋白质真代谢率各组差异不显著(P>0.05),说明添加益生菌与酶制剂对干物质真代谢率及粗蛋白质真代谢率的影响与抗生素添加剂相比无较大差异,但是单独添加酶制剂或其与益生菌联用以及添加抗生素均有提高干物质真代谢率、粗蛋白质真代谢率的趋势,而单独添加益生菌在本试验条件下对干物质真代谢率、粗蛋白质真代谢率提升作用不佳,与计成等[19]、李菊[21]报道的结果类似。同时酶制剂Ⅲ组在粗纤维真代谢率中表现突出,极显著优于空白Ⅰ组和抗生素Ⅴ组(P<0.01),组合添加Ⅳ组粗纤维真代谢率也极显著优于Ⅰ、Ⅴ2组(P<0.01),但还是明显比单独添加酶制剂的Ⅲ组差(P<0.05),说明在以木聚糖酶、纤维素酶组成的复合酶制剂中添加芽孢杆菌对粗纤维真代谢率有一定的负影响,这可能是由于木聚糖酶与木聚糖的结合主要是通过离子之间的相互静电作用,在pH低于等电点时,木聚糖酶带正电荷,易与木聚糖结合,而pH等于或高于等电点时,二者基本不结合[22],芽孢杆菌的加入影响了消化道的pH,从而可能干扰木聚糖酶与底物的结合而影响粗纤维的真代谢率。不过受试验条件影响,本试验并没有测定试鸡消化道内上述各种酶的活性及消化道各段pH的变化情况,有必要进一步研究确定。
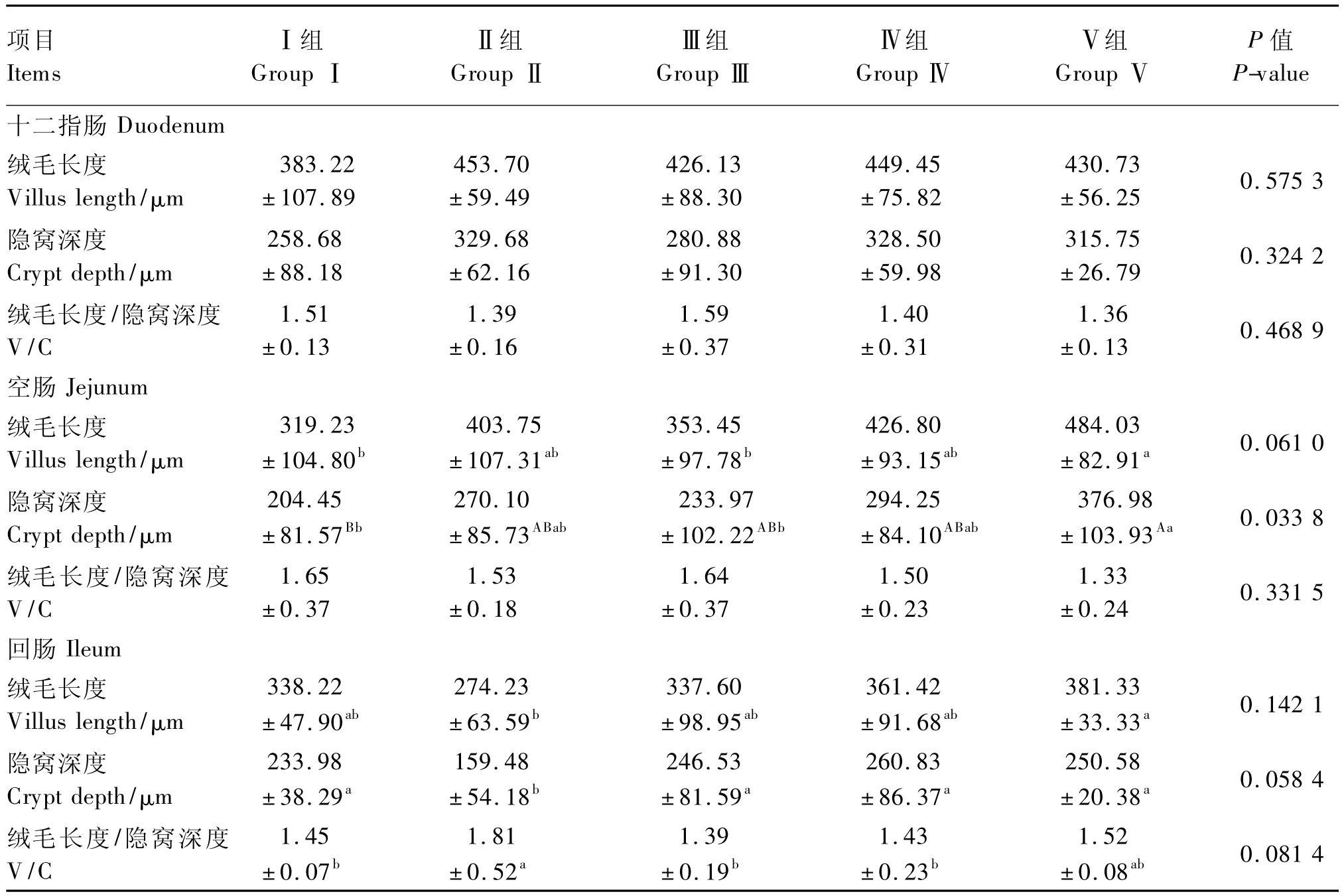
表4 益生菌与酶制剂对黄羽肉鸡肠黏膜形态的影响Table 4 Effects of probiotics and enzyme preparation on the intestinal mucosal morphology in yellow-feathered broilers
3.3 益生菌与酶制剂对黄羽肉鸡肠黏膜形态的影响
绒毛长度、隐窝深度、V/C是衡量肠道消化吸收功能的重要指标。肠绒毛是吸收养分的主要组织,绒毛长度与肠上皮细胞数量相关,绒毛短时,成熟的上皮细胞也减少,同时降低了上皮细胞与食糜接触的表面积,使机体对养分的吸收能力减弱;隐窝深度可反映肠上皮细胞更新速度,不断有细胞从隐窝基部向绒毛端部迁移、分化,形成具有吸收能力的绒毛细胞,以补充绒毛上皮的正常脱落,隐窝变浅表明肠上皮细胞生成率降低,更新过程减慢而成熟率上升,分泌及吸收功能增强;V/C则综合反映小肠功能状态,比值增大,说明肠内膜面积较大,肠黏膜结构改善,单位面积绒毛细胞数上升,消化吸收功能增强,腹泻率下降[23-27]。而本试验的结果表明由木聚糖酶和纤维素酶组成的复合酶制剂具有改善肉鸡十二指肠、空肠绒毛形态结构的趋势,这与前人的研究报道[28-29]相似,而酶制剂促进肠绒毛形态结构发育的机理一般认为有以下几个方面:1)酶制剂消除了饲粮中抗营养因子的破坏作用,同时增加了饲料的可消化性;2)降低了食糜黏度,减少了黏性物质对肠黏膜的吸附破坏性,而饲粮的相对消化时间也变长;3)降低了肠道有害菌数量,有益微生物的繁殖增加,从而减少其产生的毒素或代谢产物对肠黏膜的毒害作用,保护了肠黏膜,同时降低了有害菌对营养物质的消耗;4)酶制剂促进养分消化的同时增大了肠道中小分子氨基酸、低聚糖的含量,这些物质不仅可以直接被肠黏膜上皮细胞吸收利用,促进肠绒毛生长,同时某些寡糖等物质还具有促生长因子的功能,可以调节肠黏膜发育。
多项研究证明益生菌制剂同样具有改善肠黏膜的效用[30-31]。伍金娥等[32]研究表明,在肉仔鸭饲粮中添加芽孢杆菌制剂,能够提高其肠绒毛长度,而对于促进肠黏膜上皮细胞成熟,即引起隐窝深度变浅,在增大V/C方面,则主要集中在回肠。这说明芽孢杆菌制剂在改善动物体肠黏膜结构发育上具有一定的区位选择性,在小肠后段的作用效果更突出,这与本试验在黄羽肉鸡上的研究结果高度一致,本研究分析认为产生这种现象的原因有以下几方面:1)芽孢杆菌定植在回肠内,产生多种挥发性脂肪酸,降低了肠道pH,Lupton等[33]曾报道指出酸性pH可以影响细胞的生长,肠道中pH的降低有利于肠黏膜保持完整的形态结构并促进黏膜细胞的增殖。因此肠道pH下降,能减少肠道有害菌数量,亦可促进受损肠黏膜细胞的修复,使得肠绒毛长度增加,隐窝变浅。2)芽孢杆菌能分泌并活化多种内源消化酶,亦可产生多种NSP酶等,促进饲料降解,产生丰富的营养物质,如游离氨基酸、短肽、寡聚糖等,促进消化道发育。同时养分分解产生的某些小分子物质、芽孢杆菌自身的成分或是其某些代谢产物具有生物活性,能抑制有害菌繁殖,促进有益微生物定植生长或促进肠黏膜发育。3)芽孢杆菌定植入后肠段,与有害微生物产生生物夺氧作用,同时竞争养分,使得很多需氧有害微生物生长受到抑制,降低有害菌对黏膜的损害,如黄俊文等[34]就研究报道了仔猪饲喂纳豆芽孢杆菌后,其结肠中的乳酸杆菌和双歧杆菌数量显著高于对照组(P<0.05),而大肠杆菌的数量要显著低于对照组(P<0.05)。
抗生素在改善肠黏膜的发育状况、提高畜禽生产性能上的作用很早就得到了证实,而本试验中益生菌与酶制剂联合使用在改善小肠绒毛发育方面表现出与抗生素添加剂相当或是稍优的效果。值得一提的是,本试验中空白Ⅰ组的十二指肠、空肠、回肠隐窝深度均较浅,而同样也有报道指出在动物饲粮中添加酶制剂不仅不能改善肠黏膜的形态发育,有些甚至具有反作用[35],同样益生菌制剂对不同肠段黏膜发育的改善效用不一,体现出一定的区位选择性。造成这种差异的原因,我们认为与饲粮成分和类型、动物种类及生长阶段有关,与益生菌的种类、添加剂量及其定植部位等因素有关,同时复合酶制剂的种类及配伍关系、添加剂量、添加技术等也会产生较大影响。例如,王继强等[36]报道添加过多的酶制剂对试鸡的生长性能无改善效果(P>0.05),对鸡的肠黏膜及绒毛结构发育无益(P>0.05)。王佳丽等[37]的研究也显示,在肉鹅小麦型饲粮中加入0.1%、0.2%的木聚糖酶能显著增加肉鹅小肠绒毛长度(P<0.05),但加入0.3%的木聚糖酶对小肠绒毛长度并无更佳的改善作用(P>0.05),说明过多添加酶制剂对肠绒毛长度不一定有益,也许是由于添加过量的酶制剂使得养分浓度变大,其中某些高浓度物质引起了一系列的抑制作用而影响肠黏膜发育,对此还需要进一步的研究证实。
4 结论
在黄羽肉鸡饲粮中添加抗生素、益生菌、酶制剂以及酶制剂与益生菌联用,对试鸡生长性能、养分代谢率和肠道形态结构均有不同程度的改善作用,但益生菌与酶制剂的联合使用表现出了一定的优势,说明其具有替代某些抗生素饲料添加剂使用的潜能。
[1]周克勇,刘长忠,黄健.微生态制剂与酶制剂结合使用对乌骨肉鸡生产性能的影响[J].中国饲料,2001(15):13-14.
[2]MIDILLI M,TUNCER S D.The effect of enzyme and probiotic supplementation to diets on broiler performance[J].Türk Veterinerlik ve Hayvancilik Dergisi,2001,25(6):895 -903.
[3]万伶俐,于振斌,王晓阳,等.几种抗病促生长饲料添加剂在肉仔鸡生产中应用效果的研究[J].吉林农业科学,2004,29(3):43 -46.
[4]项延润.益生素、酶制剂替代抗生素饲喂肉鸡的效果试验[J].浙江畜牧兽医,2005(2):1-2.
[5]李旭红.益生素、酶制剂替代抗生素饲喂肉鸡的效果试验[J].中国饲料添加剂,2009(4):23-24.
[6]National Research Council.Nutrient requirements of poultry[S].9th ed.Washington,D.C.:National A-cademy Press,1994.
[7]中华人民共和国农业部.NY/T 33—2004鸡饲养标准[S].北京:中国农业出版社,2004.
[8]潘宝海,李德发,谯仕彦.益生菌在养鸡生产中的应用[J].中国饲料,2000(16):9-11.
[9]YEO J,KIM K I.Effect of feeding diets containing an antibiotic,a probiotic,or yucca extract on growth and intestinal urease activity in broiler chicks[J].Poultry Science,1997,76(2):381 -385.
[10]JIN L Z,HO Y W,ABDULLAH N,et.al.Probiotics in poultry:mode of action[J].World’s Poultry Science,1997(53):351 -368.
[11]杨凤.动物营养学[M].北京:中国农业出版社,2000.
[12]孙鸣,潘宝海,陈伟兴,等.益生菌、益生元及合生素的作用机制和相互关系[J].饲料研究,2008(4):62 -64,66.
[13]唐建中.芽孢杆菌抑菌耐药和耐热性能及其对黄羽肉鸡生产性能影响的研究[D].硕士学位论文.长沙:湖南农业大学,2010.
[14]李成良,张海燕.非淀粉多糖酶对肉鸡生产性能、养分利用率及盲肠微生物的影响[J].饲料工业,2009,30(6):11 -14.
[15]蒋桂韬,张石蕊,戴求仲,等.细菌性木聚糖酶对21~49日龄黄羽肉仔鸡生产性能的影响[J].中国饲料,2009(8):19-21.
[16]刘一尘,何明清,倪学勤.益生菌剂与益生协同剂的协同作用的研究及应用现状[J].中国微生态学杂志,2001,13(3):179 -180.
[17]黎春辉,陈铁桥,肖兵南,等.益生菌与益生协同剂联合应用的研究进展[J].中国饲料添加剂,2007(8):12-15.
[18]贺永康,赵国先,贺发生,等.中草药对肉鸡生产性能和养分表观消化率的影响[J].饲料研究,2010(6):30-33.
[19]计成,王晓霞,易中华,等.果寡糖和枯草芽孢杆菌对肉鸡肠道菌群数量、发酵粪中氨气和硫化氢散发量及营养素利用率的影响[C]//家禽营养与饲料科技进展:第二届全国家禽营养与饲料科技研讨会论文集.北京:中国畜牧兽医学会动物营养学分会,2007:237-242.
[20]蒋桂韬,张石蕊,胡艳,等.不同来源木聚糖酶对黄羽肉鸡生长性能和养分利用率的影响[J].家畜生态学报,2010,31(3):50 -55.
[21]李菊.肉仔鸡不同菌群状态对肠道化学成分及肉品质的影响[D].硕士学位论文.北京:中国农业大学,2006.
[22]蒋桂韬.小麦型日粮添加细菌性木聚糖酶对黄羽肉鸡生产性能的影响及作用机理研究[D].硕士学位论文.长沙:湖南农业大学,2009.
[23]韩正康.家畜营养生理学[M].北京:北京农业出版社,1991.
[24]成令忠.组织学[M].2版.北京:人民卫生出版社,1994.
[25]杨玉荣,佘锐萍,张日俊,等.大豆活性肽对肉鸡肠道黏膜结构的影响[J].中国畜牧杂志,2006,42(15):13-15.
[26]徐子涵,许丽.不同剂型乳酸菌对雏鸡生长性能和小肠黏膜形态的影响[J].动物营养学报,2011,23(10):1812-1818.
[27]EWTUSHIK A L,BERTOLO R F P,BALL R O.Intestinal development of early-weaned piglets receiving diets supplemented with selected amino acids or polyamines[J].Canadian Journal of Animal Science,2000,80:653 -667.
[28]丁雪梅,张克英.小麦-豆粕型日粮添加木聚糖酶对艾维茵肉鸡免疫指标、肠道形态和微生物菌群的影响[J].动物营养学报,2009,21(6):931-937.
[29]宋小珍,曾福海,杨秀江,等.饲粮中添加不同组合非淀粉多糖酶制剂对1~21日龄肉仔鸡小肠粘膜结构及其养分表观利用率的影响[J].动物营养学报,2010,22(6):1730 -1737.
[30]SAMANYA M,YAMAUCHI K.Histological alterations of intestinal villi in chickens fed dried Bacillus subtilis var.natto[J].Comparative Biochemistry and Physiology Part A:Molecular and Integrative Physiol-ogy,2002,133:95 -104.
[31]谢为天,钟日聪,徐春厚.复合微生态制剂对肉仔鸡血清生化指标和十二指肠组织形态的影响[J].中国畜牧兽医,2010,37(8):13 -17.
[32]伍金娥,常超,王学东,等.益生菌对肉仔鸭肠道结构的影响[J].湖北农业科学,2011,50(22):4670 -4673.
[33]LUPTON J R,JACOBS L R.Fiber supplementation resuits in expanded proliferative zones in rat gastric mucosa[J].Journal of Clinical Nutrition,1987,46(6):980-984.
[34]黄俊文,林映才,冯定远,等.纳豆菌甘露寡糖对仔猪肠道pH微生物区系及肠黏膜形态的影响[J].畜牧兽医学报,2005,36(10):1021 -1027.
[35]姚军虎,袁玖,杨凤霞,等.饲粮中添加酶制剂对肉鸡生产性能及肠道发育的影响[C]//中国畜牧兽医学会家畜生态学分会第七届全国代表大会暨学术研讨会论文集.杨凌:中国畜牧兽医学会家畜生态学分会,2008:101-109.
[36]王继强,张波,刘福柱.小麦型日粮添加酶制剂对蛋鸡生产性能的影响[J].粮食与饲料工业,2005(1):41-43.
[37]王佳丽,杨桂芹.小麦饲粮添加木聚糖酶对肉鹅小肠绒毛形态及食糜pH的影响[J].河南农业科学,2007(7):109-112.

