紫苤蓝花青素合成酶基因BocANS的克隆与分析
袁菱婧,罗 盼,蒋 明,李温平,何建婷
(台州学院 生命科学学院,浙江 临海 317000)
花青素又称花色素、花色苷,在植物中广泛分布,是一类重要的次生代谢产物,决定叶、花和果实等的颜色,在吸引昆虫、鸟类和兽类传粉或传播种子等方面起着重要作用[1]。花青素具有抗诱变、抗氧化、抗菌和抗高血压等功效,因此,在食品加工上得到了广泛应用,常用作天然的食品添加剂和着色剂[2-3]。花青素合成酶是花青素生物合成的关键酶,作用于合成途径的倒数第二步,催化无色花色素转变为有色花色素[4]。近年来,科研人员对花青素合成酶的结构、作用机制、基因克隆和表达等方面开展了广泛研究,并取得了一定进展[5-8]。
紫苤蓝 (Brassica oleraceavar.caulorapa),又名紫球茎甘蓝、紫擘蓝和紫芥蓝头等,为十字花科芸薹属蔬菜,原产地中海沿岸,作为特种蔬菜从国外引进栽培。紫苤蓝具紫色膨大的球茎,形态奇特、色泽亮丽,有一定的观赏价值,可用于庭院栽培或盆栽;球茎肉质脆嫩可口、风味独特,可生吃、熟食或腌制,深受人们的喜爱[9]。近年来,在紫苤蓝栽培技术、指纹图谱、小孢子培养和组培快繁等方面有一些研究[9-13],但有关花青素合成酶基因克隆方面未见报道。本研究以紫苤蓝为材料,通过花青素合成酶基因的克隆、表达和序列分析,为该基因的功能研究奠定基础。
1 材料和方法
1.1 材料和试剂
在花期采集紫苤蓝的叶柄、叶片、茎、花柄和花蕾,用75%的酒精擦拭后置于液氮,带回实验室备用。Taq酶购自北京鼎国生物技术有限公司,dNTP购自上海生工生物工程有限公司,TRIzol®试剂购自Invitrogen公司,cDNA合成试剂盒采用SMARTTMPCR cDNA Synthesis Kit,购自 TaKaRa公司;PCR产物回收纯化试剂盒购自碧云天生物技术研究所;pGEM T-easy载体购自Promega公司。
1.2 方法
1.2.1 RNA的提取和cDNA的合成
叶柄、叶片、茎、花柄和花蕾RNA的分离采用TRIzol法,称取约0.1 g样品用于RNA的提取;cDNA第1链和第2链的合成按照试剂盒中提供的说明书进行。
1.2.2 基因的克隆
以叶片 cDNA 为模板,BocP1(5’-ATGGTGGCAGTTGAAAG-3’) 和 BocP2(5’-TCAGACTTCATCCTTT-3’)为引物,进行 PCR扩增。在20 μL体系中,分别加入 cDNA模板40 ng,Taq酶 1 U,Taq酶缓冲液 2 μL,10 mmol·L-1的dNTP 0.5 μL,20 μmol·L-1的引物各 0.5 μL,并用无菌dd H2O补足20 μL。PCR程序为:94℃预变性 5 min,每个循环包括 94℃变性 30 s,55.6℃退火60 s,72℃延伸90 s,共32次,最后72℃继续延伸 10 min。PCR产物在1.0%的琼脂糖凝胶上电泳,经割胶、回收和纯化后,克隆到pGEM T-easy载体,经蓝白斑筛选、菌液PCR验证后挑取阳性克隆测序。
1.2.3 基因的表达分析
根据测序结果,设计RT-PCR引物用于表达分析,上、下游引物序列分别为 BocRT1(5’-GCTCAAGAAGGCGGCTAT-3’) 和 BocRT2(5’-CCAATCCACGGTGAAGTA-3’)。分别以 40 ng叶柄、叶片、茎、花柄和花蕾cDNA为模板进行PCR扩增,PCR体系同1.2.2。PCR程序为:94℃预变性5 min,每个循环包括94℃变性30 s,53.8℃退火40 s,72℃延伸45 s,共33次。
2 结果与分析
2.1 BocANS基因的克隆
以BocP1和BocP2为PCR引物,从叶片cDNA中扩增到与预期大小一致的条带,经回收、连接、转化和测序,获得BocANS基因的序列。BocANS的编码区全长为1 077 bp,编码358个氨基酸,A,C,G,T 4种碱基分别为 326,206,287和 258个,GC值45.78% (图1)。在 NCBI数据库比对的结果表明,BocANS与甘蓝花青素合成酶基因的序列最为相似,一致性达99%,仅存在3个碱基的差异,与白菜有96%的相似性,存在4个碱基的差异;通过比对发现,BocANS的编码蛋白含两个保守的结构域,分别为 2OG-FeII_ Oxy和DIOX_N。

图1 紫苤蓝BocANS基因的编码区全长序列及其推导的氨基酸序列
2.2 BocANS基因的表达分析
根据测序结果,设计RT-PCR引物BocRT1和BocRT2以等量的叶柄、叶片、茎、花柄和花蕾为模板,进行 PCR扩增。RT-PCR结果 (图2)表明,BocANS在叶片、叶柄、茎、花柄和花蕾中均有表达,在叶柄和茎中的表达量较高,而其他部位相对较低。
2.3 BocANS的序列分析
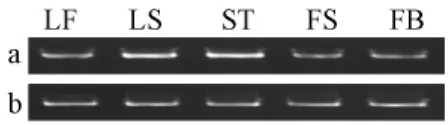
图2 BocANS基因的表达模式
从NCBI数据库下载甘蓝 (登录号AAO73440,后略)、芥菜 (B.juncea,ACH58397)、桃形李(Prunus salicinavar.cordata,AEN19292)、苹 果(Malusxdomestica,BAB92998)、甘薯 (Ipomoeabatatas,ADE08370)、 圆 叶 牵 牛 (I.purpurea,ABW69684)、王妃藤 (I.horsfalliae,ACS71531)、牵牛 (I.nil,BAB71810)、水稻 (Oryza sativa,CAA69252)和 小 麦 (Triticumaestivum,BAE98277)的氨基酸序列,用Clustalx 1.81进行序列比对,再用 Mega 3.1构建系统发育树 (图3),构建方法为邻接法 (Neighbor-joining),经1 000次自举检验。
结果表明,11条氨基酸序列的长度范围为357~438,残基之间存在一定的差异。紫苤蓝与甘蓝ANS之间的差异最小,仅存在个别残基的差异,两者的遗传距离0.008 7;紫苤蓝、甘蓝与小麦ANS之间的差异最大,两者的遗传距离均为0.783 8。从系统发育树上看,3种芸薹属蔬菜即紫苤蓝、甘蓝与芥菜聚为一组,蔷薇科的桃形李与苹果聚为一组,旋花科的王妃藤、甘薯、圆叶牵牛和牵牛处于同一分支,而单子叶植物小麦和水稻单独聚为一组 (图3)。
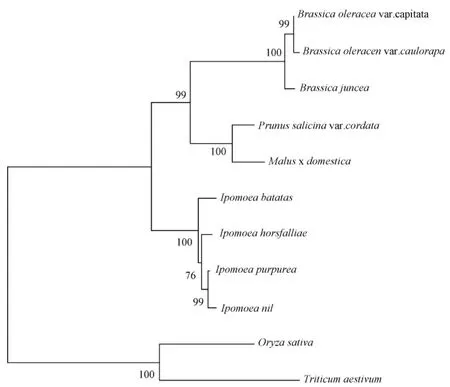
图3 用NJ法构建的花青素合成酶基因编码蛋白系统发育树
3 小结和讨论
在自然界中,存在多种类型的植物色素,如类黄酮、类胡萝卜素、多酚化合物和生物碱类等。花青素属于类黄酮物质,基本结构为2-苯基苯并吡喃,环上的氢被羟基或甲氧基取代后生成不同类型的花色素。由于花青素具有较好的保健和药用功效,富含花青素的作物如紫甘薯、紫苤蓝、紫菜薹、紫玉米、紫花生和黑豆等深受消费者的欢迎。通过基因工程,在植物或微生物中导入花青素合成酶基因获得高含量花青素已成为可能。近年来在蔬菜、食品、饲料和制药行业中已得到了应用[14-15]。目前,科研人员已从紫甘薯、紫菜薹等紫色作物中克隆得到花青素合成酶基因[1,16]。
本研究从紫苤蓝中克隆到一个花青素合成酶基因,该基因的开放阅读框大小与实验室先前在紫菜薹中克隆到的BcANS一样,均为1 077 bp,编码358个氨基酸[16];RT-PCR 结果表明,BocANS在叶片、叶柄、茎、花柄和花蕾中表达,表达模式与BcANS类似,推测它们为同源基因。BocANS的碱基组成、序列长度与同属植物十分接近,但与不同科植物相比,碱基组成和长度差异较大,说明ANS在进化上比较保守,这一规律与传统的植物分类相吻合。紫苤蓝花青素合成酶基因的克隆,为研究该基因的功能奠定了基础,下一步将构建植物表达载体和开展转基因研究。
[1]Liu XQ,Chen M,Li MY,et al.The anthocyanidin synthase gene from sweetpotato[Ipomoea batatas(L.)Lam]:Cloning,characterization and tissue expression analysis[J].African Journal of Biotechnology,2010,9(25):3748-3752.
[2]Parejo I,Viladomat F,Bastida J,et al.Bioguided isolation and identification of the nonvolatile antioxidant compounds from fennel(Foeniculum vulgareMill.)waste [J].Journal of Agricultural and Food Chemistry,2004,52:1890-1897.
[3]陈健,孙爱东,高雪娟.蓝莓花青素的提取及抗氧化性的研究 [J].北京林业大学学报,2011,33(2):126-129.
[4]Winkel-Shirley B.Biosynthesis of flavonoids and effects of stress[J].Current Opinion in Plant Biology,2002,5(3):218-223.
[5]Cheng L Q,Xu Y J,Grotewold E,et al.Characterization of anthocyanidin synthase(ANS)gene and anthocyanidin in rare medicinal plant-Saussurea medusa[J].Plant Cell,Tissue and Organ Culture,2007(89):63-73.
[6]Wilmouth R C,Turnbull J J,Welford R W,et al.Structure and mechanism ofanthocyanidin synthasefromArabidopsis thaliana[J].Structure,2002,10(1):93 -103.
[7]Xu F,Cheng H,Cai R,et al.Molecular cloning and function analysis of an anthocyanidin synthase gene fromGinkgo biloba,and its expression in abiotic stress responses[J].Molecular Cells,2008,26(6):536-547.
[8]Nakajima J,Sato Y,Hoshino T,et al.Mechanistic study on the oxidation of anthocyanidin synthase by quantum mechanical calculation [J].The Journal of Biological Chemistry,2006,281(30):21387-21398.
[9]隋好林,于尧,张志芬.紫茎蓝引种栽培试验 [J].山东农业科学,1996(4):24-25.
[10]林骁.特菜新品种:紫苤蓝栽培技术 [J].农村实用技术,2005(1):12-12.
[11]周荣,任吉君,王艳.POD、PPO指纹图谱在芸薹属蔬菜分类上的研究 [J].中山大学学报:自然科学版,2010,49(4):106-110.
[12]王超楠,闻凤英,刘晓晖,等.球茎甘蓝小孢子培养中影响胚诱导的几个因素 [J].中国蔬菜,2010(10):35-39.
[13]倪春锋,蒋明,胡齐赞,等.紫苤蓝组织培养快繁技术[J].浙江农业科学,2010(3):503-506.
[14]Yan Y,Chemler J,Huang L,et al.Metabolic engineering of anthocyanin biosynthesis inEscherichia coli[J].Applied and Environmental Microbiology,2005,7:3617-3623.
[15]Reddy AM,Reddy VS,Scheffler BE,et al.Novel transgenic rice overexpressing anthocyanidin synthase accumulates a mixture of flavonoids leading to an increased antioxidant potential[J].Metabolic engineering,2007,9(1):95 -111.
[16]蒋明,陈孝赏,李金枝.紫菜薹花青素合成酶基因BcANS的克隆、表达与序列分析 [J].浙江大学学报:农业与生命科学版,2011,37(4):393-398.

