CD147慢病毒表达载体的构建及稳定转染A549细胞系的建立
杨绍兴 汤传昊 王思涵 宋三泰 刘晓晴
肺癌是发病率和病死率均居第一位的肿瘤,其中非小细胞肺癌占80%,按其病理分型依次递减为腺癌、鳞癌、大细胞肺癌等。腺癌易发生血行转移,近年的研究[1]又发现其所占比例有所增长,成为女性和年轻患者中最为常见的一种类型,对肺腺癌细胞的生物学特性进行深入的研究有着非常重要的意义。CD147,又称基质金属蛋白酶诱导因子(EMMPRIN),是一类位于肿瘤细胞膜表面的跨膜糖蛋白,属于免疫球蛋白超家族,能够刺激成纤维细胞产生大量基质金属蛋白酶(matrix metalloproteinases, MMPs)[2],可介导基底膜组成成分和细胞外基质大分子的重塑,促进肿瘤的浸润和转移,诱导肿瘤血管的生成[3]。尽管CD147的功能和作用在其它类型肿瘤研究中已有报道,但在肺腺癌细胞生物学特性中还未见研究报道。本实验拟通过构建CD147的慢病毒表达载体,建立稳定表达CD147的人肺腺癌A549细胞系,检测上调表达CD147后MMP-9及人肺腺癌细胞增殖、侵袭能力的变化情况,为研究CD147在人肺腺癌生物学特性中的功能和作用奠定基础。
1 材料和方法
1.1 材料 过表达慢病毒载体pEGFP购自Addgene公司,慢病毒包装质粒pLP1、pLP2、pLP/VSVG购自Invitrogen公司。pMD-T载体购自TaKaRa公司。SYBR Green real-time PCR mixture购自Qiagen公司。限制性内切酶、dNTP、Taq酶以及快速连接试剂盒均购自TaKaRa公司,引物合成及测序由上海英骏公司完成。CCK-8试剂盒购自DojinDo公司。转染试剂Lipofectamine 2000购自Invitrogen公司。慢病毒包装细胞293FT细胞购自Invitrogen公司。人肺腺癌细胞系A549由清华大学生命科学院肿瘤分子研究室惠赠。
1.2 方法
1.2.1 引物设计 根据PubMed上CD147基因全长序列(NM 001728.3),以及pEGFP载体的酶切位点,进行引物设计:CD147 sense,5' GCTAGCATCATGGCGGCTGCGCTGTT 3',CD147 antisense,5' TCTAGAGGAAGAGTTCCTCTG GCGGACGTT 3'。 其中,分别在上游和下游的5'端加入了XbaI和NheI酶切位点。
1.2.2 RT-PCR扩增人CD147全基因序列 用Trizol试剂按照说明书方法提取A549细胞总mRNA,然后取1 μg反转录成cDNA,用上述引物进行PCR扩增CD147全长序列,扩增条件如下:先94oC预变性5 min,94oC变性30 s,57oC退火30 s,72oC延伸90 s,共计30个循环反应,最后72oC延伸4 min,4oC保存。反应产物进行琼脂糖凝胶电泳,对所需片段进行凝胶回收,获得带有XbaI和NheI双酶切位点的CD147全基因组。
1.2.3 人CD147基因的慢病毒过表达载体的构建及鉴定 将获得的CD147全基因PCR克隆到pMD-T载体中,转化大肠杆菌,进行蓝白斑筛选,挑取阳性克隆后在液体LB中扩大化培养,提取质粒后进行PCR及酶切鉴定,鉴定正确后送去测序。将测序验证后的重组质粒和pEGFP载体分别用XbaI和NheI进行双酶切,回收所需要的基因及载体片段,用快速连接试剂盒进行连接反应,16oC过夜连接后转化大肠杆菌,挑取阳性克隆后在液体LB中扩大化培养,提取质粒后进行PCR及酶切鉴定,鉴定正确后送去测序。将鉴定正确的CD147过表达载体命名为pEGFP-CD147。
1.2.4 慢病毒的包装 慢病毒包装细胞293FT培养条件为添加10%FBS的H-DMEM,取5 μg pEGFP-CD147质粒及对照质粒pEGFP与包装质粒4.2 μg pLP1、2 μg pLP2和包膜质粒2.8 μg pLP/VSVG质粒在无血清培养基中与42 μL Lipofectamine 2000混合,室温孵育20 min,形成DNALipofectamine 2000复合物后,转染293FT细胞,6 h后更换为含有1 mmol/L丙酮酸钠的培养基,48 h后收集培养基上清,用0.45 μM滤器过滤后,超速离心浓缩病毒,分装后-80oC保存。
1.2.5 过表达CD147的A549细胞系的建立 人肺腺癌细胞系A549培养条件为添加10%FBS的H-DMEM,当A549细胞生长至60%密度时,吸去培养皿中的培养基,加入pEGFPCD147和pEGFP慢病毒毒液,同时加入Polybrene,使其终浓度为8 mg/L,置37oC、5%CO2的孵箱中培养过夜。第2天,去除培养基,添加完全培养液,待细胞密度生长至80%-90%时,按1:3传代。流式细胞术分选表达绿色荧光蛋白的细胞。分别命名为A549-CD147、A549-pEGFP。
1.2.6 细胞总mRNA的提取、逆转录反应及实时定量PCR检验干涉效率 用Trizol试剂溶解细胞,然后按照说明书方法提取细胞总mRNA,然后取1 μg反转录成cDNA,用SYBR GREEN mixture做染料,用iQTM5多重实时荧光定量PCR仪进行实时定量PCR检测CD147的过表达效率,用GAPDH做内参,所用引物序列为:5′-CD147 sense,GCTAGCATC ATGGCGGCTGCGCTGTT-3′,5′-CD147 antisense,5′-TC TAGAGGAAGAGTTCCTCTGGCGGACGTT-3′;GAPDH sense,5′-GAGTCAACGGATTTGGTCGT-3′,GAPDH antisense,5′-TTGATTTTGGAGGGATCTCG-3′;MMP-9正义链:5′-TGACAGCGACAAGAAGTG-3′,MMP9反义链:5′-CAGTGAAGCGGTACATAGG-3′。
1.2.7 Western blot 用RIPA溶解细胞后提取细胞蛋白,各取200 μg进行SDS-PAGE,电泳后用电转仪进行转膜,5%脱脂奶粉室温封闭1 h后加入mouse anti-CD147抗体(1:300),4oC过夜,TBST洗涤3次,每次10 min,加入HRP偶联山羊抗小鼠二抗(1:1,000),室温孵育1 h,TBST洗涤3次,每次15 min,ECL显影。同时以β-actin为内参照。
1.2.8 CCK-8法检测细胞增殖能力 将A549细胞、A549-pEGFP、A549-CD147按照每孔 1×104/200 μL的密度接种于96孔板中继续培养,每组设置4个复孔,分别选取24 h、48 h、72 h三个时间节点进行检测。检测前换液1次,每孔加100 μL培养基和10 μL CCK-8,细胞放入37oC、5%CO2培养箱中培养2 h,使用酶联仪在450 nm波长检测光密度值。实验重复3次,取其平均值。
1.2.9 细胞侵袭能力检测 使用Transwell(Corning Inc.,USA)检测转染CD147组及对照组细胞的侵袭能力变化。首先,将Matrigel置于4oC过夜使其融化,用预冷的无血清1640以1:3稀释Matrigel,每个上室加入稀释后的Matrigel 100 μL,室温2 h使其凝固。然后于转染后24 h,收集A549-CD147、A549-pEGFP和A549细胞,用无血清1640液重悬细胞,细胞记数并调整细胞浓度为5×105个/mL。每个上室中加入100 μL细胞悬液,下室加入含10%小牛血清的1640培养液,每种细胞做3孔。继续培养48 h后,取出滤膜,甲醇固定,常规HE染色。显微镜下计数迁移至滤膜外表面的细胞数,每张滤膜随机计数10个视野(×200),取平均值,实验重复3次。
1.3 统计学分析 使用SASS 9.1统计学软件进行数据处理,单组间的比较,采用t检验。多组间采用具有一个重复测量的两因素设计定量资料的方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 pEGFP-CD147慢病毒表达载体的构建及鉴定 利用特异性引物扩增出了大小约为1,150 bp的目的基因条带,与预期的大小片段一致(图1A)。将测序验证正确的pMD-TCD147进行双酶切,回收目的片段,并连接至pEGFP表达载体中,构建重组质粒pEGFP-CD147。提取质粒后进行XbaI和NheI双酶切,结果显示,酶切后呈现两条条带,与CD147目的基因片段和pEGFP载体片段的大小一致(图1B),对质粒进行PCR,琼脂糖凝胶电泳后出现了与CD147大小一致的片段(图1C),将酶切及PCR鉴定正确的质粒送去测序。测序的结果与预期的CD147基因序列完全相同。将鉴定正确的CD147过表达载体命名为pEGFP-CD147。
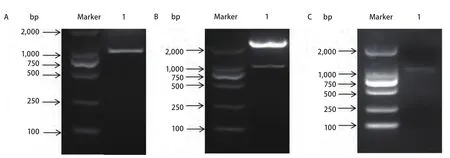
图 1 CD147慢病毒表达载体的构建及鉴定Fig 1 Construction and identification of CD147 lentiviral expression vector. A: Human CD147 whole genome obtained; 1: Human CD147 gene. B:Restriction map analysis of CD147 lentiviral expression vector; 1: pEGFP vector and CD147 gene; C: Identification of CD147 lentiviral expression vector by RT-PCR; 1: CD147 gene.
2.2 pEGFP-CD147慢病毒表达载体的包装和转染人肺腺癌A549细胞系 分别将pEGFP-CD147慢病毒表达载体和pEGFP空载体,与包装质粒pLP1、pLP2及包膜质粒pLP/VSVG、Lipofectamine 2000共转染293FT细胞,48 h后荧光显微镜下发现大部分细胞呈绿色荧光表达(图2A)。收集病毒并去除漂浮细胞和细胞碎片,浓缩后分别感染A549细胞,48 h后荧光显微镜下均见到部分A549细胞发绿色荧光,说明pEGFP-CD147及pEGFP成功转入A549细胞中(图2B)。连续将细胞培养1个月,分别提取感染pEGFP-CD147慢病毒表达载体的细胞和pEGFP-CD147空载体的细胞的总RNA。半定量RT-PCR分析表明,转染pEGFP-CD147慢病毒表达载体后的细胞,CD147的mRNA表达水平明显增高(图2C),进一步的实时荧光定量PCR结果表明,对比转染pEGFP空载体组,转染pEGFP-CD147慢病毒表达载体后的细胞的CD147表达水平增加了2.5倍(图2D)。说明所构建的载体在A549细胞中表达。
2.3 A549-CD147细胞系的建立 选取转染pEGFP-CD147慢病毒表达载体的A549细胞和转染pEGFP空载体的A549细胞进行流式细胞术分选(图3A),分选后经扩增培养1个月,荧光显微镜下可见满视野的绿色荧光标记的细胞(图3B)。两组细胞的real-time PCR分析显示,转染pEGFPCD147组细胞的CD147的mRNA表达水平比转染pEGFP空载体组高17.32倍(图3C),Western blot结果表明,与对照组相比,pEGFP-CD147组细胞的CD147蛋白表达水平明显升高(图3D),表明我们已经成功建立了稳定过表达CD147的人肺腺癌A549细胞系,命名为A549-CD147。
2.4 过表达CD147对MMP-9及人肺癌细胞增殖、侵袭能力的影响 Real-time PCR结果显示转染CD147基因后,A549-CD147细胞中MMP-9 mRNA的表达明显增加(P<0.001)。CCK-8法检测结果表明,转染后的第1天,3种细胞的增殖率没有明显差别,而第2、3天,与对照组相比,A549-CD147细胞的增殖能力明显增强。A549-pEGFP细胞与A549细胞的增殖能力对比未见统计学差异(P<0.001)(图4)。Transwell结果显示,穿透Matrigel到达滤膜的A549-CD147细胞数明显多于A549-pEGFP和A549细胞(P<0.001)。
3 讨论
在包括对卵巢、肺、前列腺、胰腺、乳腺等恶性肿瘤的研究中发现,MMPS的活性程度与肿瘤的侵袭转移潜能关系密切。而肿瘤细胞表面高表达的CD147使得MMPS表达数量及活性增加,从而降解基底膜的主要成分,破坏天然组织的机械屏障,促进肿瘤的浸润和转移[4]。CD147是一个在多种生理和病理过程中发挥重要作用的关键分子,但大家关注的重点还是其在肿瘤生长和发展中的功能和作用。Zheng等[5]发现上调CD147的表达可促进胃癌细胞的生长和血管的生成。Wang等[6]在体外实验研究中发现,CD147的表达与胃癌SGC7901细胞的增殖速度密切相关。Bougatef等[7]发现CD147的表达可促进恶性黑色素细胞瘤细胞的浸润、转移。Hao等[8]已证实CD147的表达可能是前列腺癌细胞耐药的一个关键因素。为探讨CD147在肺腺癌细胞生物学特性中的功能和作用,我们首先构建了CD147慢病毒表达载体和稳定表达CD147的人肺腺癌A549细胞系。

图 2 pEGFP-CD147慢病毒的包装和感染人肺腺癌A549细胞系Fig 2 pEGFP-CD147 lentiviral packaging and infection of human lung adenocarcinoma cell line A549. A: pEGFP-CD147 lentiviral expression vector was transfected in 293FT cells; B: pEGFP-CD147 lentiviral venom infected A549 cells; C: Detection of CD147 mRNA expression levels in the respective cells by RT-PCR; D: Detection of CD147 mRNA expression levels in the respective cells by real-time PCR.
对比其它研究应用的普通质粒载体的方法,我们所构建的慢病毒载体具有获得病毒周期短,滴度高,可以感染分裂、非分裂细胞,能将外源基因高效导入宿主细胞,从而在细胞中稳定长期表达siRNA、cDNA或报告基因,且不会产生化学转染或腺病毒转染引起的细胞损伤及免疫反应。慢病毒实验系统被广泛应用于各类基因治疗的实验研究中[9,10]。为实现CD147基因在人肺腺癌A549细胞中的高效、稳定表达,我们首先成功构建了pEGFP-CD147重组表达质粒,随后进行293FT细胞包装慢病毒。因我们采用的慢病毒载体上表达GFP,慢病毒毒液感染A549细胞后,经荧光显微镜观察可以见到部分细胞中有GFP表达,表明A549细胞已经有效地被慢病毒感染。感染后的细胞经过流式细胞术分选,培养扩增1个月后,细胞荧光显示镜下可见到满视野的绿色荧光标记的细胞。Real-time PCR结果显示,与对照组相比,pEGFP-CD147组CD147的表达水平上调17.29倍,Western blot检测结果也显示,pEGFPCD147组的CD147的表达在蛋白水平也明显增加。说明我们已经成功建立了过表达CD147的人肺腺癌A549细胞系,命名为A549-CD147。我们随后对CD147靶产物MMPS家族的MMP-9的表达水平进行了real-time PCR检测,发现过表达CD147可上调MMP-9的表达。CCK-8和Transwell法证实A549-CD147细胞的增殖和侵袭能力明显增强。根据上述研究所显示CD147具有的功能特性,推测其有可能是一个潜在的治疗靶点,这也是我们后续研究关注的重点。

图 3 A549-CD147细胞系的建立Fig 3 Established the A549-CD147 cell line. A: The A549 cells transfected with p-EGFP lentiviral expression vector and p-EGFP empty vector were sorted by flow cytometry respectively; B: The A549-pEGFP cells and A549-CD147 cells after sorted by flow cytometry; C: Detection of CD147 mRNA expression levels in the respective cells by real-time PCR; D: Detection of CD147 in protein level by Western blot in cells.

图 4 过表达CD147对MMP-9及人肺癌细胞增殖、侵袭能力的影响Fig 4 Effects on MMP-9, proliferation and invasive ability of the human lung adenocarcinoma cells after overexpression CD147. A: The relative expression rate of MMP-9 mRNA was significantly enhanced in A549-CD147 cells than that in A549 and A549-pEGFP cells; B: The growth curves indicated that the growth rates had not significant difference among A549-CD147, A549-pEGFP and A549 cells in the first day after transfection,but in the second day (P<0.05) and the third day (P<0.01), the growth rate was significantly higher in A549-CD147 cells than that in A549-pEGFP and A549 cells; C: Representative microscope field of filters under the Matrigel from A549-CD147, A549-pEGFP and A549 cells respectively (×100);D: The Histogram showed that the number of invasive cell was significantly more in A549-CD147 cells than that in A549-pEGFP and A549 cells(P<0.01) .
综上所述,我们成功构建了CD147慢病毒表达载体,建立了稳定上调表达CD147的A549-CD147细胞系,并对其在促进细胞增殖和侵袭方面进行了初步的研究。我们将利用成功构建载体和细胞系进一步研究CD147在人肺腺癌生物学特性中的功能和作用。

