硫氰酸盐氧化反应的动力学分析
尹翠
(中国矿业大学 化工学院,江苏 徐州 221008)
硫氰酸盐氧化反应的动力学分析
尹翠
(中国矿业大学 化工学院,江苏 徐州 221008)
本文开发了一种毛细管电泳分析方法以用于SCN--H2O2反应体系的动力学研究。利用此方法,在7-10的pH区间内对硫氰酸盐的氧化反应进行了定性和定量分析。通过对反应溶液的实时分离,检测到了重要的氧化中间物次硫氰酸根离子OSCN-。通过测定反应物和氧化产物的浓度变化关系确定了这一反应对硫氰酸盐和过氧化氢的反应级数均为1。并且,发现pH值对反正速率存在显著的影响。在本实验的条件范围内,增加溶液的pH值将导致反应速率的降低。在实验结果的基础上,提出了可能的氧化反应机理。
硫氰酸盐;过氧化氢;氧化;动力学;毛细管电泳
硫氰酸盐(SCN-)是重要的含硫化合物之一。由于硫氰酸盐特有的物理和化学性质,因此被广泛应用于浸金、电镀、洗印工业以及染料加工等领域[1-3]。也正因如此,硫氰酸盐常出现于各种工业废水中。尽管硫氰酸盐的毒性较弱,但当它与酸接触时将通过化学反应生成有毒气体,造成人体呼吸困难,严重时将引发死亡,从而为人类和水栖生态系统带来严重威胁[4]。因此,出于环境方面的考虑,硫氰酸盐的氧化降解一直备受关注[2,5-9]。近年来,随着对硫氰酸盐在生物化学和医学方面所起作用的发现,进一步激发了人们对这一体系研究的兴趣[10-13]。目前,较为普遍的观点是,在人体的宿主免疫防御体系中,在过氧化物酶(如乳过氧化物酶、唾液过氧化物酶、髓过氧化物酶和嗜酸性粒细胞过氧化物酶等)的催化作用下,硫氰酸盐将与双氧水反应形成次硫氰酸根离子(OSCN-),它具有比过氧化氢更强的杀菌功能,但并不会对人体细胞造成危害[14]。因此,过去有大量研究集中在对各种生物体系中酶催化[15-18]以及无酶催化的H2O2/SCN-反应[19-22],并揭示出具有活性的OSCN-既可以通过对SCN-的直接氧化生成,也可先将SCN-氧化成(SCN)2,然后通过水解形成OSCN-离子[23]。有实验证据表明,除了HOSCN/OSCN-外,硫氰酸盐的氧化过程中可能存在着其他具有高度活性的氧化中间物,并且这些中间物具有较短的寿命因此难以在最终产物中检测到[18],而对SCN-氧化机理的认识也需要进一步的研究。
最近三十年以来,在硫氰酸盐的氧化过程中观察到了大量的非线性动力学行为[24-27]。这些现象也表明硫氰酸盐的氧化过程中可能有多种产物生成,并且伴随着化学反应之间的正负反馈等相互耦合的过程[28]。然而,目前无论是对硫氰酸盐抗菌机制,还是氧化过程中非线性动力学行为的机理都缺乏足够的认识。其中最关键的缺乏对反应产物和关键中间物的检测以及对其动力学变化关系的描述。因此,对相关物质的识别及其浓度变化的同步测定,无疑将有助于揭示这一体系的机理。
作为一种相对较新的分离与分析手段,毛细管电泳(CE)在离子分析方面具有十分明显的优势[29]。与离子色谱相比,毛细管电泳具有高效、快速和灵敏和特点,完全可以应用于反应速率较低的化学动力学研究中。因此,本文将利用毛细管电泳方法对硫氰酸盐和过氧化氢的反应进行监测,检测反应中的未知中间物,并记录它们随时间变化的关系,从而对其机理作进一步的分析。
1 实验部分
本实验中所用的试剂均为分析纯,其中磷酸二氢钾、磷酸氢二钾和高锰酸钾购自于上海试剂一厂综合经营公司,氢氧化钠和氢氧化钾购自于上海化学试剂公司,硫酸、盐酸、过氧化氢、甲醇、无水乙醇、氯化钾、硫氰酸钾、氯化铵、氢氧化锂、硫酸钾和四硼酸钠则由国药集团化学试剂有限公司供应。所用溶液均由MilliQ超纯水(18.2 M·cm)配制。反应溶液的pH值通过氨水和氯化铵调节,总浓度为20mM。
毛细管电泳实验在Beckman Coulter P/ACE MDQ毛细管电泳仪(Beckman,USA)上完成。该系统采用自动进样器进样,并配备了二极管阵列检测器(DAD,190~400 nm),实验控制以及数据的采集分析在32 Karat Software软件中进行。在数据分析时,为了对多种物质定量,分别对210、230和235 nm的光谱信号进行分析。实验采用压力进样(0.5psi.×5s),分离在熔融石英毛细管柱(75μmi.d.×375μm o.d.,总长度57.5cm,有效长度50cm,河北永年锐沣光导纤维厂)中进行。溶液的pH值由PHS-10A型数字式pH-离子计(上海日岛科学仪器有限公司)测定,进样前,所有溶液均通过0.45μm微孔滤膜过滤以除去可能形成的不溶性固体颗粒。通过对分离条件的优化,最终确定适合于本实验的工作条件为:采用间接紫外法为检测手段,以20mM KNO3为背景电解质,并加入2.0×10-5mM的电渗流改性剂HDB,最终溶液的pH值由LiOH调节。分离过程所施加的电压为20 kV,分离检测温度为25℃。
2 结果与讨论
为了对SCN--H2O2反应过程进行实行的监测,在不同时刻提取反应溶液进行毛细管电泳分析。通过与标准参照物的对比,离子淌度的估算以及DAD检测器中获得的各组分的UV-Vis光谱数据,在一定程度上可以对电泳图中的各个色谱峰进行识别,并根据峰的积分面积与校正曲线的关系,可以定量计算出反应过程中各物质浓度随反应时间的变化。图1所示的即为不同时刻所得到的电泳图,其中SCN-和H2O2的浓度分别为0.5和35 mM,溶液的pH值为9.85,选取的检测波长为210 nm。在反应的初始阶段(曲线a,35 min),在2.37min处存在一较高的峰,为缓冲溶液中的Cl-。反应物SCN-则出现在2.60min处。除此之外,电泳图中还可观察到另一组分,其对应的迁移时间tm =2.53min。通过与可能的产物标准品对比,可以确定该产物为硫酸根SO42-。随着反应的进行,反应物SCN-对应的峰逐渐降低,表明SCN-通过与H2O2的反应而被消耗,同时硫的最高价氧化产物SO42-的量也逐渐增加。当反应时间达到70 min时(曲线b),在tm = 2.68min处可以明显观察到另一氧化产物。根据前人研究的结果[23]以及该组分在UV-Vis光谱中所具有的特征,可以判断该产物为次硫氰酸根离子OSCN-。随着反应的进一步进行,OSCN-和SO42-的含量进一步增加,同时初始反应物SCN-的浓度随时间逐渐降低并趋于消失(曲线c和d)。值得注意的是,OSCN-的浓度并非随时间呈单调的变化关系。随着反应物SCN-的消耗,OSCN-的生成速率逐渐降低。当反应时间达到一定值时,OSCN-的浓度逐渐降低直至完全消失(曲线e)。同时,在电泳图中可以观察到SO42-对应的峰的高度(浓度)进一步增加,表明OSCN-可通过直接或间接的过程氧化生成

图1 不同时刻SCN--H2O2反应体系的电泳图:(a) 35 min;(b) 70 min;(c) 386 min;(d) 870 min;(e) 1697 min。SCN-和H2O2浓度分别为0.5和35 mM,溶液pH值为9.85.Fig.1 Electrophergrams obtained in the SCN--H2O2reaction at different reaction time:(a) 35 min; (b) 70 min; (c) 386 min; (d) 870 min; and (e) 1697 min. The concentration of SCN- and H2O2is 0.5 and 35 mM, respectively, and the pH is 9.85.

图2 SCN-的氧化过程中各物质浓度随时间的变化关系。初始溶液的组成为[SCN-]0 = 0.90 mM,[H2O2]0 = 35 mM,pH = 9.85。Fig.2 The plot of concentration involved in the oxidation of SCN- against reaction time. The initial composition of the solution is [SCN-]0 = 0.90 mM,[H2O2]0 = 35 mM and the pH is 9.85.

图3 不同SCN-浓度下ln[c/c0]对反应时间t的变化关系图H2O2浓度为35 mM,pH为9.85。Fig.3 The plot of ln[c/c0]vs. tat various SCN- concentrations. The concentration of H2O2is 35 mM and the pH of the solution of 9.85.
为了进一步描述反应过程中各物质的动力学变化关系,对电泳图中各个峰作积分,通过积分面积与标准品的校正曲线,得到其浓度随时间变化的关系,如图2如示。其中,SCN-的起始浓度为0.90mM,其他条件与图1中一致。由于氧化中间物OSCN-不稳定,并且缺乏高纯的标准品,因此并不能获得对应的校正关系。通过对OSCN-人为引入一校正系数,则图2中OSCN-对应的曲线表示相对于一任意单位的浓度。从图中可以看出,随着反应的进行,反应物SCN-的浓度不断降低,同时产物中SO42-的含量不断增加。在反应的初始阶段,随着反应的进行,OSCN-的含量逐渐增加。当反应时间达到约500分钟时,溶液中SCN-的浓度约为反应前的1/2,此时OSCN-的量达到最大值。随后,随着反应的进一步进行,OSCN-的浓度开始呈现出下降趋势。这表明硫氰酸盐与过氧化氢的反应必然涉及两步或两步以上的连续过程。也就是说,在SCN-与H2O2反应生成的OSCN-将继续与氧化剂H2O2作用,以直接或间接的方式转变成最终氧化产物
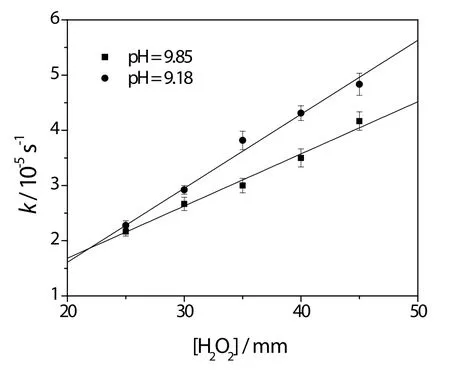
图4 表观速率常数随H2O2浓度变化关系Fig.4 The dependence of apparent rate constant on the H2O2concentration.
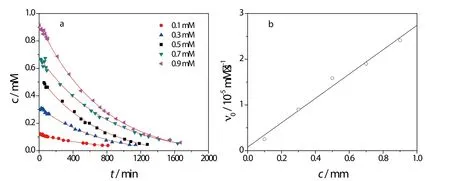
图5 (a)不同初始浓度下SCN-浓度随反应时间曲线图(b)初始速率随SCN-浓度的变化关系H2O2浓度为35 mM,pH为9.85。Fig.5 (a) The plot of SCN-concentration vs. reaction time at different initial SCN-concentration; (b)The dependence of instant reaction rate on initial concentration of SCN-.The concentration of H2O2is 35 mM and the pH of the solution of 9.85.

表1 SCN-H2O2体系在不同pH条件下的反应级数和速率常数。Table 1 Reaction order and rate constant for the SCN--H2O2at various pHs.
当通过ln[c/c0]对反应时间t作图时,可以得到图3。其中c和c0分别为SCN-在不同时刻测得的浓度和初始溶液(t = 0)的浓度。在图3中,由于H2O2远远过量,因此其浓度变化可以忽略而被视作常数。在实际的测量中,H2O2对应色谱峰(位于tm> 3 min处,未在图1中给出)也在整个实验过程中没有明显变化。由图可以看出,在不同浓度条件下,ln[c/c0]均与t成较好的线性关系,并且几乎重合。这表明这一体系对SCN-的反应级数为1级。从这些线性关系的斜率,可以计算出准一级速率常数,在这一条件下为1.8×10-3min-1。
图4所示的为不同pH条件下表观速率常数k随H2O2浓度的变化关系。由图可以看出,在各个pH条件下,准一级速率常数k均随[H2O2]线性增加。这一线性关系表明该反应对过氧化氢也为一级反应,反应速率可以表述为v = k0[SCN-][H2O2]的形式。其中图3和图4中的表观速率常数k = k0[H2O2]。因此,通过图4中各线性关系的斜率可以计算得到速率常数k0。
为了进一步确认这一体系中对各反应物的反应级数和速率常数,采用了初始速率法进行了独立的分析。首先,SCN-反应速率可表示为:

当固定溶液中H2O2和pH值时,通过改变SCN-的浓度,获得一系列不同初始浓度下反应物SCN-浓度随时间变化的曲线,如图5a所示。通过在反应初始阶段(t趋近于零)时在浓度-时间曲线上作切线,从其斜率可以获得该浓度下的初始反应速率。图5b所示的为不同浓度下计算得到的初始反应速率。由于其大小与硫氰酸盐SCN-的浓度成线性关系,因此该反应对SCN-为一级反应。同样,通过改变H2O2的浓度,可以得到在本实验所使用的pH范围内,这一反应对过氧化氢也为一级反应。这与采用动力学曲线得到的结果一致。根据这些结果,可进一步计算得到各pH条件下的速率常数,其结果可见表1。
根据毛细管电泳分离和检测的结果,OSCN-为主要的氧化中间物,结合前人的研究结果[8,10,22,23],OSCN-的形成可表示为:

随后,生成的OSCN-将与H2O2发生进一步所反应形成最终氧化产物SO42-,这一过程中包含的具体反应可能包括:

其中,OSCN-主要通过R1生成,表观上对SCN-和H2O2都是一级反应,并且随着pH值的增加,速率常数呈现出降趋势。
3 结论
通过在开发毛细管电泳方法的基础上,对硫氰酸盐与过氧化氢之间的氧化还原反应进行了详细的研究。在实验所研究的pH范围内均可检测到氧化中间物次硫氰酸根离子OSCN-的存在,并且它将通过与H2O2之间的一系列作用形成最终的氧化产物SO42-。由于OSCN-在SCN-被完全氧化消耗之后仍能在较长时间内存在,因此它的消耗速率应与生成速率相当,而这一过程也将有待于在今后的工作中作进一步研究。在定量分析的基础上,确定了该反应对硫氰酸盐和过氧化氢的反应级数均为1,并且这一体系的氧化速率强烈依赖于溶液的pH值。当pH值增加后,反应的速率常数将显著减小。
[1]AKCIL A. Destruction of cyanide in gold mill effluents: Biological versus chemical treatments [J]. BiotechnolAdv 2003, 21 (6): 501-511.
[2]DASH R R, GAUR A, BALOMAJUMDER C. Cyanide in industrial wastewaters and its removal: A review on Biotreatment [J]. J Hazard Mater 2009, 163 (1): 1-11.
[3]PAPADIMITRIOU C A, SAMARAS P, SAKELLAROPOULOS G P.Comparative study of phenol and cyanide containing wastewater in CSTR and SBR activated sludge reactor [J]. BioresTechnol 2009, 100 (1): 31-37.
[4]BHUNIA F, SAHA N C, KAVIRAJ A. Toxicity of thiocyanate to fish,plankton, worm and aquatic ecosystem [J]. 2000, 64 (2): 197-204.
[5]EBBS S. Biological degradation of cyanide compounds [J]. Biotechnology 2004, 15 (3): 231-236.
[6]STAIB C, LANT P. Thiocyanate degradation during activated sludge treatment of coke-ovens wastewater [J]. BiochemEng J 2007, 34 (2):122-130.
[7]SHARMA V, OICONOR D, CABELLI D. Oxidation of thiocyanate by iron(V) in alkaline medium [J]. InorgChimActa 2004, 357 (15): 4587-4591.
[8]WILSON I, HARRIS G.The oxidation of thiocyanate ion by hydrogen peroxide. I. The pH independent reaction [J]. J Am ChemSoc 1960, 82(17): 4515-4517.
[9]VICENTE J, DIAZ M. Thiocyanate wet oxidation [J]. Environ SciTechnol 2003, 37 (7): 1452-1456.
[10]BARNETT J J, MCKEE M L, STANBURY D M. Acidic aqueous decomposition of thiocyanogen [J]InorgChem 2004, 43 (16): 5021-5033.
[11]ASHBY M T, ANEETHA H. Reactive sulfur species: Aqueous chemistryofsulfenylthiocyanates [J]. J Am ChemSoc 2004, 126 (33):10216-10217.
[12]FURTMUELLER P G, JANTSCHKO W, REGELSBERGER G, et al.Reaction of lactoperoxidaxe compound I with halides and thiocyanate [J].Biochemistry 2002, 41 (39): 11895-11900.
[13]NAGY P, ALGUINDIGUE S S, ASHBY M T. Lactoperoxidaxecatalyzed oxidation of thiocyanate by hydrogen peroxide: A reinvestigation of hypothiocyanite by nuclear magnetic resonance andoptical spectroscopy [J]. Biochemistry 2006, 45 (41): 12610-12616.
[14]CARLESSON J, EDLUND M B HANSTROM L. Bactericidal and cytotoxic effects of hypothiocyanite-hydrogen peroxide mixture [J].Infect. Innun. 1984, 44 (3): 581-586.
[15]HOGG D M, JAGO G R. The antibacterial action of lactoperoxidase.The nature of the reaction inhibitor [J].Biochem J 1970, 117: 779-790.
[16]BOSCH E H, VAN DOORNE H, DE VRIES S. The lactoperoxidase system: The influence of iodide and the chemical antimicrobial stability over the period of about 18 months [J]. J ApplMicrobiol 2000, 89 (2):215-224.
[17]VAN DALEN C J, KETTLE A J. Substrates and products of eosinophil peroxidase [J].Biochem J 2001, 358 (1): 233-239.
[18]PRUITT K M, TENOVUO J, ANDREWS R W, et al. Lactoperoxidasecatalyzed oxidation of thiocyanate: Polarographic study of the oxidation products [J]. Biochemistry 1982, 21 (3): 562-567.
[19]ROSIN M, KOCHER T, KRAMER A. Effects of SCN-/H2O2combinations in dentifrices on plaque and gingivitis [J]J Clin Periodontology 2001, 28 (3): 270-276.
[20]ROSIN M, KRAMER A, BRADTKE D, et al. The effect of a SCN-/H2O2toothpaste compared to a commercially available triclosancontaining toothpaste on oral hygiene and gingival health - A 6-moth home-use study [J]. J Clin Periodontology 2002, 29 (12): 1086-1091.
[21]CHRISTY AA, EGEBERG P K. Oxidation of thiocyanate by hydrogen peroxide - A reaction kinetic study by capillary electrophoresis [J].Talanta 2000, 51 (): 1049-1058.
[22]FIGLAR J N, STANBURY D M. Thiocyanogen as intermediate in the oxidation of thiocyanate by hydrogen peroxide in acidic aqueous solution [J]. InorgChem 2000, 39 (22): 5089-5094.
[23]DUA S, MACLEAN M J, FITZGERALD M, et al. Is the hypothiocyyanite anion (OSCN)- the major product in the peroxidase catalyzed oxidation of the thiocyanate anion (SCN)-? A joint experimental and theoretical study [J]. J PhysChem A 2006, 110 (14): 4930-4936.
[24]ORBAN M. Oscillations and bistability in the Cu(II)-catalyzed reaction between H2O2and KSCN [J]. J Am ChemSoc 1986, 108 (22): 6893-6898.
[25]SIMOYI R H, EPSTEIN I R, KUSTIN K. Complex dynamical behavior in the oxidation of thiocyanate by iodate [J]J PhysChem 1989, 93 (5):1689-1691.
[26]VALENT I, ADAMCFKOVA L. Irregular oscillations in a bromatethiocyanate batch system under constant nitrogen gas-flow [J]. J PhysChem 1994, 98 (16): 4303-4306.
[27]LENGYEL I, GYORGYI L, EPSTEIN I R. Analysis of a model of chlorite-based chaotic chemical oscillators [J]. J PhysChem 1995, 99(34): 12804-12808.
[28]SCOTT S K. Oscillations, Waves, and Chaos in Chemical Kinetics [M].Oxford: Oxford University Press, 1994.
[29]WEINBERGER R. Practical Capillary Electrophoresis, 2nd Edition [M].San Diego: Academic Press, 1999
Kinetic of the Oxidation of Thiocyanage Using Capillary Electrophoresis
Yin Cui
(1College of Chemical and Environment,2College of Materials Science and Engineering,North University of China,Taiyuan,030051,Shanxi)
Icapillary electrophoresis method was developed for the kinetic study of the oxidation of thiocyanage by hydrogen peroxide. With such method, the oxidation reaction was qualitatively and quantitivelyanalyzed in the pH range between 7 and 10.The key intermediate OSCN- was detected in the real time separation of the solution, and the reaction order was determined to be 1 for both thiocyanate and hydrogen peroxide. It was also noted that the reaction rate significantly depended on the pH value of the reaction medium. In our experiment conditions, the rate constant decreases with the pH.
Thiocynate; Hydrogen peroxide; Capillary electrophoresis; Oxidation; Kinetics.
O 657
A
T1672-8114(2012)06-055-06
尹翠,中国矿业大学化工学院研究生。

