氧化苦参碱对结肠炎模型大鼠结肠黏膜NOD2与TNF-α的影响*
唐庆,范恒,胡慧,寿折星,刘星星
(华中科技大学同济医学院附属协和医院中西医结合科,武汉430022)
近年来,我国炎症性肠病(inflammatory bowel disease,IBD)尤其是溃疡性结肠炎(ulcerative colitis,UC)的发病率呈逐年上升趋势[1]。该病治疗难度大,愈后易复发,被世界卫生组织列为难治病之一。UC发病与环境、遗传、肠道黏膜免疫功能失调等多种因素有关。NOD2蛋白是一种新发现的细胞内病原相关模式识别受体(PRRs),NOD2能识别细菌细胞膜酸二肽,介导核因子κB(neclear factor-κB,NF-κB)的激活与α肿瘤坏死因子(tumor necrosis factor α,TNF-α)等的表达[2-3]。已有研究表明,NOD2蛋白与UC发病密切相关[4-5]。笔者在本实验中采用三硝基苯磺酸(trinitrobenzene-sulfonic acid,TNBS)制备大鼠UC模型,采用氧化苦参碱(oxymatrine,OMT)治疗,检测大鼠结肠黏膜NOD2和TNF-α表达情况。
1 材料与方法
1.1 材料雄性SPF级SD大鼠32只,体质量(250±20)g,购自华中科技大学同济医学院实验动物中心,实验动物生产许可证号:SCKY(鄂)2004-0007,实验动物使用许可证号:SYXK(鄂)2004-0028。TNBS购自Sigma公司(批号:P2297)。NOD2山羊抗鼠多克隆抗体购自SANTA CRUZ公司。大鼠TNF-α酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒购自上海西唐生物科技有限公司。美沙拉嗪由法国爱的发制药集团生产。苦参素注射液(有效成分为OMT)由天津市生物化学制药厂生产,OMT纯度达98%。
1.2 动物分组将大鼠随机分为对照组、模型组、OMT组、美沙拉嗪组,每组8只。对照组从实验开始至实验结束正常饮水、喂食,其他3组用TNBS造模。造模后24 h,模型组肌内注射等体积0.9%氯化钠溶液;OMT组给予OMT肌内注射,63 mg·kg-1·d-1[6];美沙拉嗪组给予美沙拉嗪纯化水溶液灌胃,0.42 g·kg-1·d-1,均给药15 d。第16天开始,禁食24 h后处死大鼠。
1.3 造模方法大鼠适应性饲养1周,禁食不禁水24 h,10%水合氯醛按0.3 mL·(100 g)-1腹腔注射麻醉。将直径2.0 mm橡胶输液管由肛门轻缓插入8 cm,将5%TNBS液(TNBS溶于50%乙醇)0.6 mL用注射器缓慢推入橡胶导尿管,注入TNBS液后将大鼠尾巴提起,持续倒置30 s,然后使大鼠平躺,自然清醒后自由饮食。
1.4 结肠黏膜标本的制备将大鼠颈椎脱位处死,仰位固定于手术台,切取肛门至回盲部结肠,取出结肠后沿纵轴切开,并用0.9%氯化钠溶液冲洗干净,观察大鼠结肠黏膜的病变损伤程度,然后立即用4%多聚甲醛溶液固定,由本院病理室石蜡包埋切片,苏木精-伊红(HE)染色,光镜下评估黏膜损伤程度。
1.5 结肠黏膜NOD2的检测免疫组织化学法检测结肠黏膜NOD2表达,组织切片脱蜡,修复抗原,切片放入3%过氧化氢溶液,室温下孵育10 min,以阻断内源性过氧化物酶,滴加正常山羊血清封闭液,室温孵育15 min,按稀释度1∶150滴加山羊抗鼠NOD2多克隆抗体50 μL,4℃孵育过夜,磷酸盐缓冲液(phosphate buffered solution,PBS)冲洗3次,滴加复合生物素标记的二抗,室温孵育20min,二氨基联苯胺(diamionobenzidine,DAB)显色,显微镜下控制显色程度,纯化水终止显色反应,苏木精复染30~60 s,脱水,透明,中性树胶封片。显微镜下,细胞质和细胞核内出现棕黄色或褐色颗粒为阳性反应物,弥漫分布于黏膜固有层及部分上皮内,在40倍镜下选取典型视野计数100个细胞,记数其中阳性细胞数,并以率表示。
1.6 结肠黏膜TNF-α的检测取大鼠结肠黏膜标本,用载玻片轻刮肠黏膜表面黏液,再置于上清液中清洗,继用载玻片用力刮取肠黏膜组织标本,将标本转入匀浆器中,加入3倍0.9%氯化钠溶液充分匀浆,4℃1 000×g离心10 min,取上清液检测。严格按照ELISA试剂盒说明书进行操作,画出标准曲线,计算出各标本TNF-α的浓度。
1.7 统计学方法采用SPSS16.0软件进行统计学分析。实验数据以均数±标准差(±s)表示,计量资料两组间比较采用t检验,计数资料采用q检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 一般情况对照组大鼠体质量、大便、饮食、活动正常,其余组大鼠于灌肠后第2,3天开始出现明显稀便、黏液脓血便、体质量减轻及活动度明显下降。OMT组大鼠治疗4~5 d后腹泻、脓血便明显减轻,体质量及活动度较对照组略有下降,但明显轻于模型组。模型组大鼠死亡1只,解剖尸体可见结肠黏连、狭窄。
2.2 结肠大体形态及组织病理评分对照组大鼠结肠黏膜基本正常,模型组大鼠结肠黏膜充血水肿、糜烂坏死,可见多发小溃疡及肠壁黏连,肠腔扩张,肠壁增厚,病变部位以回盲部和结肠为主,部分可累及末端回肠,美沙拉嗪组和0MT组病变明显减轻,可见充血、水肿、糜烂和红色瘢痕[7]。将病变组织切片,HE染色,光镜下观察:模型组结肠黏膜高度水肿,上皮脱落、坏死,溃疡形成,大量淋巴细胞和多核中性粒细胞浸润至黏膜层、黏膜下层甚至肌层,肉芽肿形成,杯状细胞减少;美沙拉嗪组结肠黏膜糜烂,黏膜下层水肿、充血,固有层大量中性粒细胞、浆细胞浸润,黏膜下层水肿、充血;OMT组结肠黏膜杯状细胞增多,黏膜固有层可见淋巴细胞、单核细胞浸润。各组大鼠结肠损伤和组织病理评分[8]见表1。
2.3 结肠黏膜NOD2蛋白表达光学显微镜下,大鼠结肠黏膜组织免疫组织化学切片可见结肠黏膜NOD2蛋白主要表达于上皮细胞和单核细胞。对照组结肠黏膜内少量细胞的细胞质内可见浅黄色颗粒,模型组上皮细胞和单核细胞的细胞质内均可见大量深棕黄色或褐色颗粒,美沙拉嗪组和OMT组上皮细胞和淋巴细胞细胞质内可见少量黄色颗粒。阳性细胞数计数显示,模型组大鼠结肠黏膜NOD2蛋白表达较对照组明显升高(P<0.01),美沙拉嗪组、OMT组大鼠结肠黏膜NOD2蛋白表达较模型组显著降低(P<0.05)(表1)。
2.4 结肠黏膜TNF-α表达模型组大鼠结肠黏膜TNF-α明显升高(P<0.01),美沙拉嗪组、OMT组大鼠结肠黏膜TNF-α较模型组显著降低(P<0.05)(表1)。
3 讨论
该实验结果表明,TNBS诱导的大鼠结肠炎模型中,大鼠结肠黏膜NOD2蛋白过度表达,结肠黏膜TNF-α增多,这是TNBS诱导的大鼠结肠炎的重要机制之一。宿主细胞对入侵病原体的识别依靠表达在细胞表面或活细胞内的能够识别病原相关分子模式的受体介导。NOD2蛋白是一种新发现的细胞内病原相关模式识别受体。研究表明,NOD2能识别存在于革兰阴性和革兰阳性细菌细胞壁的胞壁酸二肽,调控NF-κB的激活,从而广泛参与细胞内病原微生物的识别和炎症应答的诱导,是联系天然免疫与特异性免疫的重要桥梁[9-10]。NOD2蛋白是核苷酸结合寡聚化结构域蛋白家族中的一员,编码NOD2的基因位于人类染色体16q12。NOD2蛋白分子主要由3个功能结构域构成:N端的胱冬酶募集域、位于中间的NOD域、C端的富亮氨酸重复序列域,其中NOD域包含P环和MgCl结合位点[11-12]。NOD2表达于单核细胞、树突状细胞、粒细胞和少量T细胞,肠道上皮细胞也有NOD2表达。研究表明,NOD2可以介导NF-κB活化,活化通路主要有受体相互作用蛋白-2和IκB激酶复合体参与。当NOD2蛋白LRR域识别细菌产物后,可诱导蛋白分子间通过NOD域相互联系进行自身寡聚化反应形成受体复合体,随后受体复合体通过同型CARD-CARD相互作用将RIP2分子募集到周围。RIP2与IκKγ亚基相连接,激活IκK酶复合体,引起IκB磷酸化,产生一系列效应—降解磷酸化的IκB,NF-κB核易位、含κB位点的靶基因转录活化[13]。促进多种炎性细胞因子如TNF-α的基因转录,这些炎性细胞因子可促进NF-κB进一步活化,通过正反馈使炎性细胞因子分泌增加,产生瀑布级联反应,使炎症过程得到放大和持续[14]。目前,已有许多实验证据表明NOD2蛋白与IBD发病密切相关[5,15],本实验应用TNBS诱导大鼠结肠炎模型进一步验证了这种观点。
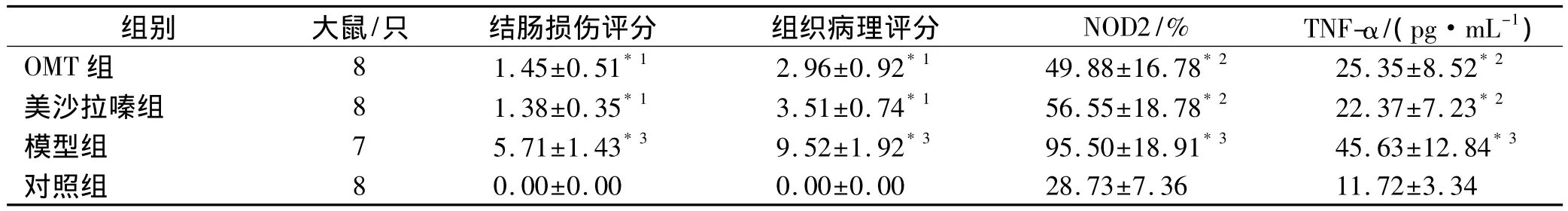
表1 4组大鼠结肠损伤、组织病理评分与结肠黏膜NOD2、TNF-α表达测定结果Tab.1Colon lesion scores,histological score and expression of NOD2 and TNF-α in colon mucosa of 4 groups of rats x±s
本实验结果显示,OMT对TNBS诱导的大鼠结肠炎有明显的治疗作用,可以减轻大鼠结肠黏膜损伤,改善结肠黏膜病理组织学评分,其机制与抑制结肠黏膜NOD2蛋白过度表达,降低大鼠结肠黏膜TNF-α有关。综上所述,结肠黏膜NOD2蛋白过度表达、TNF-α分泌增多参与了UC的发生发展过程,而OMT可以通过抑制NOD2蛋白过度表达、降低TNF-α分泌,起到减轻结肠黏膜炎症、保护肠黏膜的作用,可能是OMT治疗UC的机制之一[16]。
[1]WANG Y F,ZHANG H,OUYANG Q.Clinical manifestations of inflammatory bowel disease: East and West differences[J].J Dig Dis,2007,8(3):121-127.
[2]KAMBE N,NISHIKOMORI R,KANAZAWA N.The cytosolic pattern-recognition receptor Nod2 and inflammatory granulomatous disorders[J].J Dermatol Sci,2005,39(2):71-80.
[3]LE B L,BENKO S,GIRARDIN S E.NOD1 and NOD2 in in-nate immunity and human inflammatory disorders[J].Biochem Soc Trans,2007,35(6):1479-1484.
[4]QUEIROZ D M,OLIVEIRA A G,SARAIVA I E,et al.Immune response and gene polymorphism profiles in Crohn's disease and ulcerative colitis[J].Inflamm Bowel Dis,2009,15(3):353-358.
[5]LI M,GAO X,GUO C C,et al.OCTN and CARD15 gene polymorphism in Chinese patients with inflammatory bowel disease[J].World J Gastroenterol,2008,14(31):4923-4927.
[6]苗明三.实验动物和动物实验技术[M].北京:中国中医药出版社,1997:142-150.
[7]JANDRA K,LE T,SWAIN M G.Experimental colitis attenuates development of toxin-induced cholangitis in rats[J].Dis Sci,2002,47(7):1216.
[8]GONZA'LEZ R,RODR I'GUEZ S,ROMAY C.Antiinflammatory activity of phycocyanin extract in acetic acidinduced colitis in rats[J].Parmacol Res,1999,39(1):55-59.
[9]KAMBE N,NISHIKOMORI R,KANAZAWA N.The cytosolic pattern-recognition receptor Nod2 and inflammatory granulomatous disorders[J].J Dermatol Sci,2005,39(2):71-80.
[10]LE B L,BENKO S,GIRARDIN S E.NOD1 and NOD2 in innate immunity and human inflammatory disorders[J].Biochem Soc Trans,2007,35(6):1479-1484.
[11]OGURA Y,INOHARA N,BENITO A,et al.NOD2,a NOD1/Apaf-1 family member that is restricted to monocytes and activates NF-kappa VB[J].J Biol Chem,2001,276(7):4812-4818.
[12]RIETDIJK S T,BURWELL T,BERTIN J,et al.Sensing intracellular pathogens-NOD-like receptors[J].Curr Opin Pharmacol,2008,8(3):261-266.
[13]BIELIG H,ZUREK B,KUTSCH A,et al.A function for AAMP in Nod2-mediated NF-kappaB activation[J].Mol Immunol,2009,46(13):2647-2654.
[14]VALLABHAPURAPU S,KARIN M.Regulation and function of NF-kappaB transcription factors in the immune system[J].Annu Rev Immunol,2009,27:693-733.
[15]QUEIROZ D M,OLIVEIRA A G,SARAIVA I E,et al.Immune response and gene polymorphism profiles in Crohn's disease and ulcerative colitis[J].Inflamm Bowel Dis,2009,15(3):353-358.
[16]张岩,姜挺,夏冰.溃疡性结肠炎患者药物保留灌肠效果的Meta分析[J].护理学杂志,2009,24(23):69-71.

