川芎嗪对顺铂所致大鼠肾氧化损伤的保护作用
薛英,黎七雄,李爽
(1.武汉大学中南医院耳鼻喉科,430071;2武汉大学基础医学院药理学系,430071;3.武汉市儿童医院泌尿科,430016)
顺铂(cisplatin,DDP)是一种广谱抗癌药,由于其抗癌作用强,与其他抗肿瘤药物无交叉耐药性,在睾丸癌、卵巢癌、头颈部肿瘤及小细胞肺癌等恶性肿瘤的治疗中取得了显著疗效[1]。但DDP有严重的肾毒性,而肾毒性是其临床应用剂量受限制的主要因素[2]。因此,研究对DDP肾毒性有较好防治作用的药物,对提高DDP抗肿瘤疗效,发挥DDP应有的作用,具有重要的临床价值。川芎嗪(ligustrazine)又名四甲基吡嗪(tetramethypyrazine,TMP),是川芎中的一种生物碱单体,临床主要用于治疗心脑血管疾病,在治疗肾小球及肾小管疾病方面也有较好的疗效[3]。笔者之前的研究表明,TMP对大鼠加速型抗肾小球基底膜抗体肾炎具有较好的保护作用,其机制与抗氧化损伤有关[4]。TMP可能通过降低凋亡相关蛋白Bax和增强Bcl-2表达,并降低Bax/Bcl-2比值而抑制DDP引起的肾细胞凋亡,使肾脏免受损伤[5]。笔者在本实验观察TMP对DDP肾氧化损伤的影响。
1 材料与方法
1.1 动物雄性Sprague-Dawley(SD)大鼠,体质量200~250 g,SPF级,由武汉大学医学院实验动物中心提供。
1.2 试药DDP(山东省德州制药厂生产,批号:030604,临用前用0.9%氯化钠溶液配制),盐酸川芎嗪注射液(购于北京市永康药业有限公司,批号:03020601)。血清尿素氮(blood urea nitrogen,BUN)、肌酐(serum creatinine,SCr)及丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、一氧化氮(nitric oxide,NO)、一氧化氮合酶(nitric oxide synthase,NOS)试剂盒均购于南京建成生物制品研究所。
1.3 实验方法取SD大鼠,实验前代谢笼收集24 h尿液,测尿蛋白含量。将符合要求大鼠随机分为4组,每组8只:对照组、DDP组、DDP+TMP 50 mg·kg-1·d-1组、DDP+TMP 100 mg·kg-1·d-1组。TMP给药组分别腹腔注射TMP 50和100 mg·kg-1·d-1,给药体积为5 mL·kg-1,连续给药5 d;对照组和DDP组给予0.9%氯化钠溶液,5 mL·kg-1。给药第3天,除对照组外,其他3组腹腔注射DDP 1次,8 mg·kg-1,给药第5天收集代谢笼中24 h尿,测尿蛋白含量;大鼠称质量后处死,取血测BUN、SCr;取肾脏,制备肾皮质匀浆,测MDA、还原型谷胱甘肽(glutathione,GSH)含量及SOD、谷胱甘肽-S-转移酶(glutathione-S-transferase,GST)、NO、NOS活性。
1.4 观察指标与测定方法磺基水杨酸比浊法测定尿蛋白定量,二乙酰一肟法测定BUN含量,碱性苦味酸法测定SCr含量,硫代巴比妥酸反应法测定MDA含量,活性邻苯三酚自氧化法测定SOD,二硫代双硝基苯甲酸比色法测定GSH,1-氯-2,4-二硝基苯比色法测定GST,硝酸还原酶法测定肾组织NO含量,吸光度比色法测定NOS活力。
1.5 统计学方法采用SPSS11.0软件包,所有数据用均数±标准差(±s)表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠BUN、SCr及24 h尿蛋白含量结果见表1。与对照组比较,DDP组大鼠BUN、SCr和24 h尿蛋白含量显著升高,分别是对照组的2.68,2.84和10.94倍;与DDP组比较,DDP+TMP50 mg·kg-1·d-1组和DDP+TMP100 mg·kg-1·d-1组大鼠24 h尿蛋白分别下降41.45%,65.33%;BUN分别下降18.12%,57.51%;SCr含量分别下降14.39%,48.89%。
2.2 大鼠肾皮质MDA与SOD测定与对照组比较,DDP组大鼠肾皮质匀浆MDA含量增高(是对照组的1.58倍),SOD活性下降(较对照组下降32.34%);与DDP组比较,DDP+TMP100 mg·kg-1·d-1组MDA含量降低36.73%,SOD活性升高(为DDP组的1.66倍),见表1。
2.3 大鼠肾皮质GSH与GST测定见表1。与对照组比较,DDP组大鼠肾皮质GSH含量和GST活性均明显下降(分别下降27.25%和37.50%);与DDP组比较,DDP+TMP100 mg·kg-1·d-1组GSH和GST均升高(分别为DDP组的1.33和1.57倍)。
2.4 大鼠肾皮质NO与NOS测定见表1。DDP组肾皮质NO含量和NOS活力分别为对照组的2.66和1.28倍;与DDP组比较,DDP+TMP 100 mg·kg-1·d-1组肾皮质NO含量和NOS活力明显降低,分别降低45.39%和22.86%。
3 讨论
研究表明,TMP能降低肾损伤大鼠尿蛋白、BUN、SCr含量,减轻肾组织病理性损害,表明TMP对DDP所致的肾损害具有一定的保护作用[5]。有文献报道,DDP诱导肾毒性的机制与其肾组织过氧化损伤有关[6]。DDP进入机体后可产生大量羟自由基和活性氧自由基,引起膜脂质过氧化,导致膜通透性和膜脂流动性改变[7-8]。
SOD是体内重要抗氧化酶,可阻断脂质过氧化连锁反应。GST是体内重要的催化结合解毒反应的酶系之一,可通过催化GSH的结合反应或自身与底物的自杀性结合而降低化合物的毒性[9]。NO是一种重要的生物调节剂,由NOS以L-Arg为底物合成。NO并不直接造成组织损害,而是与超氧化物阴离子(O-2)反应生成超氧亚硝基阴离子(ONOO-)后分解产生羟自由基(·OH)而产生毒性[10]。NO可与SOD竞争O-2,与O-2反应生成ONOO-。ONOO-又可通过使蛋白中的酪氨酸硝基化,抑制SOD活性。体外研究表明,外源性NO能抑制SOD和CAT的活性,引起明显的脂质过氧化形成[11]。NOS是NO生物合成的关键酶。SOD等抗氧化酶活性下降对NOS具有抑制作用。本研究结果显示,DDP可增加大鼠肾皮质MDA、NO含量和NOS活力,降低GSH含量和SOD、GST活性,表明DDP肾毒性与氧化损伤密切相关。TMP降低肾组织MDA、NO含量和NOS活力,增加GSH含量和SOD、GST活性。TMP增加肾组织GSH的含量,诱导GST的活性可能与TMP的抗氧化特性和抑制DDP所致巯基消耗有关。TMP还可通过降低大鼠肾脏NO含量和NOS活力而减少NO与自由基相互作用引起的肾脏损伤。
表1 4组大鼠BUN、SCr、24 h尿蛋白含量测定结果Tab.1The content of BUN、SCr and urine protein in 24 hours in 4 groups of rats ±s
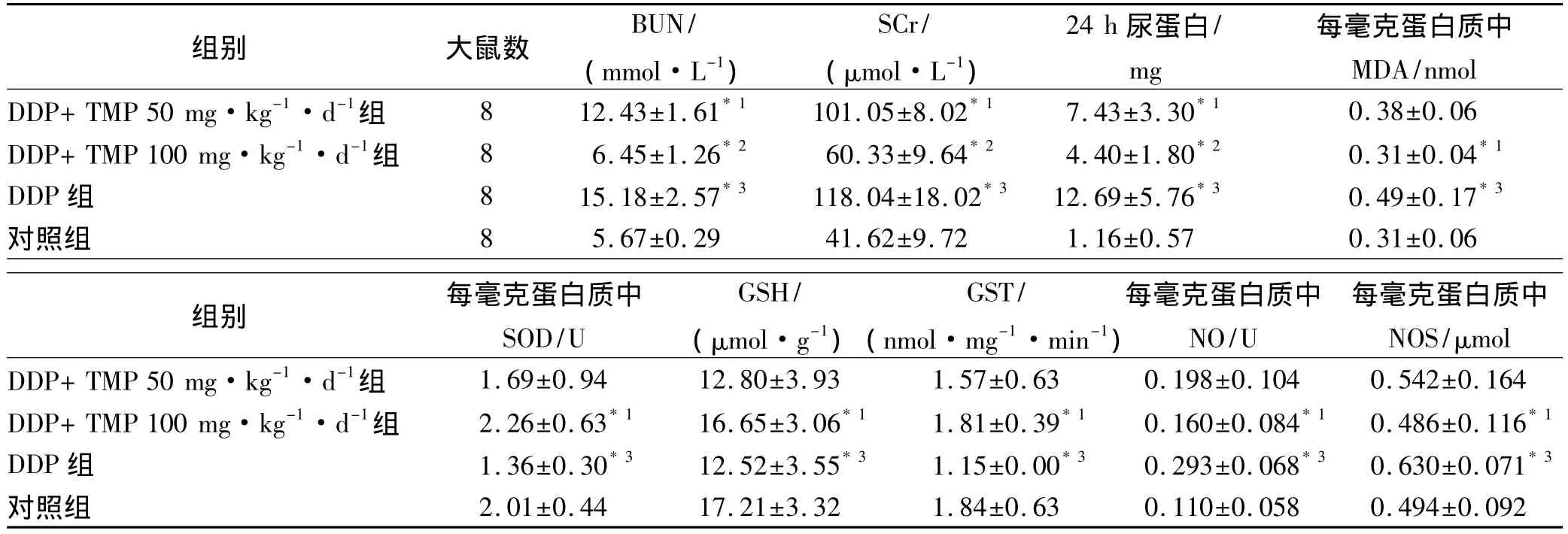
表1 4组大鼠BUN、SCr、24 h尿蛋白含量测定结果Tab.1The content of BUN、SCr and urine protein in 24 hours in 4 groups of rats ±s
与DDP组比较,*1P<0.05,*2P<0.01;与对照组比较,*3P<0.01Compared with DDP group,*1P<0.05,*2P<0.01;compared with control group,*3P<0.01
?
本研究提示,TMP对肾脏有保护作用,其可能机制是通过抗氧化损伤作用对DDP所致的肾脏损伤产生保护。
[1]ROSENBERG B.Fundamental studies with cisplatin[J].Cancer,1985,55(10):2303-2316.
[2]BADRY O A,ABDEL-MAKSOUD S,AHMED W A,et al.Naringenin attenuates cisplatin nephrotoxicity in rats[J].Life Sci,2005,76(18):2125-2135.
[3]常子军.川芎嗪治疗肾脏疾病的药理及临床研究进展[J].中国中医急症,2002,11(2):131-132.
[4]FU H,LI J,LI Q X,et al.Protective effect of ligustrazine on accelerated anti-glomerular basement membrane antibody nephritis in rats is based on its antioxidant properties[J].Eur J Pharmaco,2007,563(3):197-202.
[5]刘晓华,黎七雄.川芎嗪对顺铂肾损伤大鼠肾细胞凋亡及凋亡蛋白表达的影响[J].中国药理学与毒理学杂志,2005,19(5):352-356.
[6]HANNEMANN J,BAUMANN K.Cisplatin-induced lipid peroxidation and decrease of gluconeogenesis in rat kidney cortex:different effects of antioxidants and radical scavengers[J].Toxicology,1988,51:119-132.
[7]KUNIHIKO S,KAZUTO M,YOSHNORI I,et al.Protection by a radical scavenger edaravone against cisplatin-induced nephrotoxicity in rats[J].Eur J Pharmaco,2002,451(2):203-208.
[8]JARIYAWAT S,KIGPITUCK P,SUKSEN K,et al.Protection against cisplatin-induced nephrotoxicity in mice byCurcuma comosa Roxb.ethanol extract.[J].J Nat Med,2009,63(4):430-436.
[9]BALIGA R,ZHANG Z,BALIGA M,et al.Role of cytochrome P450as a source of catalytic iron in cisplatin-induced nephrotoxicity[J].Kidney Int,1998,54(5):1562-1569.
[10]FUJIHARA C K,SENA C R,MALHEIROS D M,et al.Shortterm nitricoxide inhibition induces progressive nephropathy after regression of initial renal injury[J].Am J Physiol Renal Physiol,2006,290(3):632-640.
[11]PASSAUER J,PISTROSCH F,BUSSEMAKER E.Nitric oxide in chronic renal failure[J].Kidney Int,2005,67(5):1665-1667.

