蛋白质回收率控制图在检测质量控制方面的应用
王海宏,柳乃奎
[通标标准技术服务(上海)有限公司,上海 200233]
蛋白质回收率控制图在检测质量控制方面的应用
王海宏,柳乃奎
[通标标准技术服务(上海)有限公司,上海 200233]
绘制了蛋白质回收率的控制图,利用控制图中的数据以核密度估计、正态性检验等统计方法分析数据的分布及检测质量。结果表明,在测定蛋白质时,酸盐比[浓硫酸的体积(mL)∶硫酸钾质量(g)]约2∶1、消化时间在2.5~3.0 h时,蛋白质检测的回收率理想。
控制图;核密度估计;正态检验;蛋白质检测
为保证实验室检测结果的质量,ISO 17025[1]和GB/T 27404[2]均提出了内部质量控制的要求。内部质量控制有多种方式,基于数据统计属性的常规控制图是常用的内部质量控制工具。影响测量结果的因素有偶然因素和异常因素,通过控制图可以理解和控制测量过程并且能够区分测量过程中的异常因素和偶然因素,当一个测量过程中只有偶然因素时,该过程就是稳定的。在控制图判稳后,计算其控制限、中心线等参数,则控制图由用于分析转为用于控制。在控制图应用过程中,每做一个点,其目的不是关注于当天所测数据的变异是多少,而是关注当天数据变异的原因是否有异常因素。
当控制图数据积累到一定程度时,可利用多种统计方法对其分析。笔者对过去一段时间蛋白质的检测质量进行分析总结,以便更好地控制检测质量。
1 控制图
1.1 分析用控制图的建立
收集了某实验室以往345个工作日控制图的数据,该质控是在每次日常检测蛋白质时同时检测色氨酸中蛋白质含量,但不做平行试验,然后计算回收率[3]。色氨酸回收率反映了整个蛋白测试系统的稳定性,包括称样、消化、蒸馏、滴定、出报告等步骤。
为便于分析,把这345个数据分为69个子组(每5个1组),子组均值和极差见表1。前18个子组消化时酸盐比(浓硫酸的毫升数∶硫酸钾克数)约3∶1,消化时间为1.5~2 h;从19组到36组酸盐比约2∶1,消化时间为2.5~3 h;37组到69组酸盐比3∶1,消化时间为2.5~3 h。把这3个阶段分别称为0阶段、1阶段、2阶段。利用所有数据绘制的均值、极差控制图分别见图1、图2。均值图中,上下控制限=总均值±0.577×极差均值;极差图中,上控制限=2.114×极差均值[4]。
由图1、图2可知,数据分层很明显,0阶段回收率明显低于1阶段和2阶段的回收率。在0阶段的18个子组中,回收率低于下控制限有16个,占89%,原因为消化时间偏短。由于0阶段的回收率偏低,因此将其删除,然后利用1阶段和2阶段的数据重新绘制控制图,分别见图3、图4。
1.2 控制图分析
每个子组均值的数学模型为:X=真值+实验室偏倚+方法偏倚+子组间变异。在应用GB/T 4091[4]的判异规则时主要考虑是否超出控制限,其它异常模式仅作参考。常规控制图的控制限分别位于中心线两侧的3σ距离处。如果过程处于控制状态则大约有99.7%的点数落在控制限内,风险水平大约0.3%。当数据分布形式有所偏离时,此概率值会有轻微波动。在1阶段和2阶段数据的均值-极差控制图中共51个子组,子组均值都在控制限内,但1阶段有2个子组均值正好等于上控制限,2阶段有4个子组均值等于下控制限,提示2阶段的数据分散性可能要比1阶段大。

表1 子组均值和极差 %
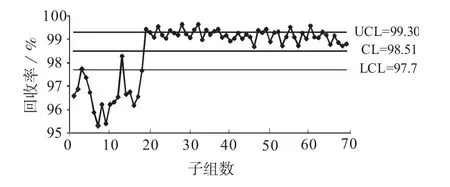
图1 3个阶段回收率均值图

图2 3个阶段回收率极差图
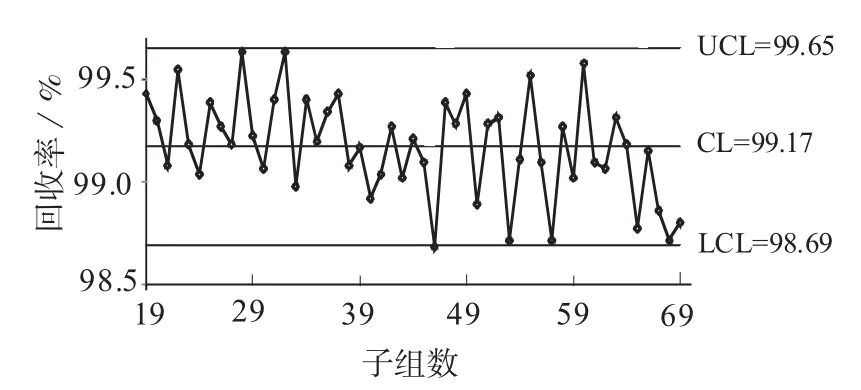
图3 删除0阶段后回收率均值图
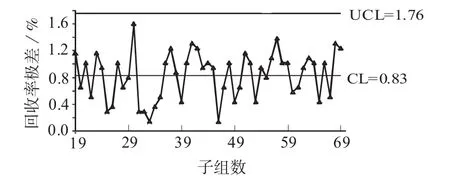
图4 删除0阶段后回收率极差图
延长消化时间能够提高回收率,这在图上表现很明显。起初发现回收率一直偏低后,按照IDF[3]中的建议,在消化液澄清后,再消化1 h。消化效果与消化时间与消化液的温度有关。增大硫酸钾的量,会提高沸点,从而加强消化效果,沸点提高后,消化时间可适当降低。不过消化温度和时间不能过高和过长,因为硫酸钾加入量不能太大,否则温度太高,生成的硫酸氢铵也会分解,放出氨而造成损失。因此,一般会同时使用另外一种质控样硫酸铵。硫酸铵的回收率反映了消化是否过于激烈,同时也反映蒸馏和滴定等步骤的效果。
对1阶段和2阶段的回收率进行t检验,P<0.05,统计上有显著差别,这可能是由于酸盐比不同所致,2∶1酸盐比的回收率要略好于3∶1的回收率。1阶段回收率的均值为99.29%,2阶段回收率均值为99.12%,其差值为0.17%,从技术上看,这个均值的差别已很小。
2 数据正态性
计量控制图的一个前提假设是数据服从正态分布,但允许小的偏离。由于中心极限定理,平均值总会趋向于正态分布,即使单个观测值不服从正态分布时也如此。鉴于此,“定期检查正态性假设的持续有效性是明智的”[4]。对回收率的数据分布进一步了解后,对不确定度评定等涉及到数据分布的质控项目能提供深入的信息。判断正态性有多种统计方法,如Kolmogorov-Smirnov检验、Shapiro-Wilk检验,Anderson-Darling检验、偏度和峰度检验等[5,6]。该实验使用核密度估计[7]作图并结合Shapiro-Wilk检验法进行分析。
2.1 核密度估计原理
对色氨酸回收率数据作核密度函数估计,其原理是在对密度估计时让每一个样本都起一定的作用,但作用的大小与样本xi到x点的距离有关,核函数的选定依赖于各样本作用距离增加而下降的方式和速度。采用高斯核的核密度估计,函数为:
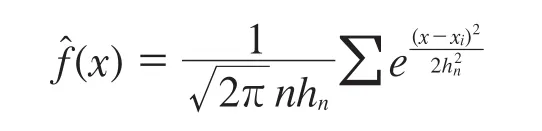
n——样本容量,其值为252;
xi——各样本的数据,即为色氨酸的回收率数据。
窗宽的大小影响所得曲线的形状,按照文献方法[5]计算最优窗宽。对于任意x,所有样本xi对x处密度的贡献可由公式得到,因此可绘制x-散点图反映数据分布。
2.2 色氨酸回收率的核密度估计
窗宽等信息见表2。图5是利用子组均值绘制的核密度估计曲线,0阶段和1阶段分布基本对称,为单峰,近似正态分布。相比1阶段和2阶段,0阶段峰形较宽,数据分散性太大,这和其标准偏差比1阶段和2阶段大很多相一致。

表2 3个阶段的样本量、标准偏差和窗宽

图5 回收率核密度估计曲线
2.3 核密度分布曲线和正态分布曲线的比较
利用表1中3个阶段的密度最高点和标准差作为一个正态分布的均值和标准差,绘制正态分布图并与各阶段核密度曲线进行比较。用Shapiro-Wilk法对这3个阶段子组均值作正态性检验,得到0,1,2阶段的P值分别为0.594,0.649,0.391(2011 年10月24日用SPSS检验P值分别为0.590,0.635,0.369),P值越高说明越接近正态分布,这与图6中核密度曲线与正态分布曲线的关系是一致的。

图6 核密度分布曲线
3 结语
综合分析正态性、回收率和标准偏差3个指标的情况,得出1阶段的实验条件最好。因此该实验室应把蛋白质检测条件调整到酸盐比为2∶1、消化时间为2.5~3.0 h。
[1]ISO/IEC17025:2005 检测和校准实验室能力的通用要求[S].
[2]GB/T27404–2008 实验室质量控制规范 食品理论检测社[S].
[3]ISO 8968–2:2001 (IDF 20–2:2001) Milk––Determination of nitrogen content––Part 2:Block-digestion method (Macro method)[S].
[4]GB/T 4091–2001 常规控制图[S].
[5]刘庆武,胡志艳.如何用SPSS、SAS 统计软件进行正态性检验[J].湘南学院学报(自然科学版),2005,7(3):56-58.
[6]朱红兵,何丽娟.在SPSS10.0 中进行数据资料正态性检验的方法[J].首都体育学院学报,2004,16,9(3):123-125.
[7]SilvermanB W. Density estimation for statistics and data analysis [M]. London:Chapman and Hall,1986.
Applycation of Protein Recovery Control Chart in the Quality Control of Detection
Wang Haihong, Liu Naikui
[SGS–CSTC Standard Technical Service (Shanghai) Co.,Ltd., Shanghai 200233, China]
Control chart of protein recovery was drawn. The information obtained from the chart was used to analyse data distribution and quality of detection by using kernel density estimation and normality test. Analysis results showed that protein recovery was satisfied when acid-salt ratio (volume of concentrated sulfuric acid∶mass of potassium sulphate) was 2∶1 and digestion time was 2.5–3.0 h.
control chart; kernel density estimation; normality test; protein determination
TS207.7
A
1008-6145(2012)01-0082-03
联系人:柳乃奎;E-mail:Leo.Liu@sgs.com
2011-11-13
10.3969/j.issn.1008-6145.2012.01.026

