肥胖患者的腹腔镜辅助胃癌根治术
黄 峰 应敏刚 周 东 杨春康 臧卫东
(福建医科大学教学医院 福建省肿瘤医院腹部外科,福州 350014)
外科手术目前是治疗胃癌的主要手段。1994年Kitano等[1]首次报道早期胃癌施行腹腔镜胃癌根治术。1997年Goh等[2]对进展期胃癌开展腹腔镜胃癌D2根治术,证实其在技术上的安全可行性,并取得良好的近期疗效,腹腔镜胃癌根治手术逐步得到认可与推广。临床实践中我们体会肥胖患者由于腹腔内大量脂肪组织的影响,手术操作空间变小,术野显露困难,手术难度增大。本研究通过回顾性分析腹腔镜辅助胃癌根治术BMI≥25与BMI<25的2组患者的临床资料,探讨肥胖因素对腹腔镜辅助胃癌根治术近期疗效的影响。
1 临床资料与方法
1.1 一般资料
我院腹部外科2006年3月~2011年10月施行412例腹腔镜辅助胃癌根治术,根据《2007年中国肥胖病外科治疗指南》[3],将BMI≥25的94例列入肥胖组,BMI<25的318例列入非肥胖组。全部患者术前均经胃镜检查病理确诊为胃癌,并行血生化、心电图、肺功能、胸片、腹部B超、腹部CT等检查,排除肝脏及其他部位转移,排除心、肺、肝、肾等重要脏器疾病无法耐受手术者。按照2002年第6版UICC分期[4]标准进行TNM分期。2组一般资料除合并基础疾病有统计学差异外,其余指标无统计学差异(P>0.05),有可比性,见表1~3。
病例选择标准:①一般情况能够耐受手术;②无远处转移;③肿瘤未明显侵犯周围组织或脏器;④胃周肿大淋巴结未明显包绕重要血管;⑤患者知情同意。
表1 2组患者一般资料比较(±s)
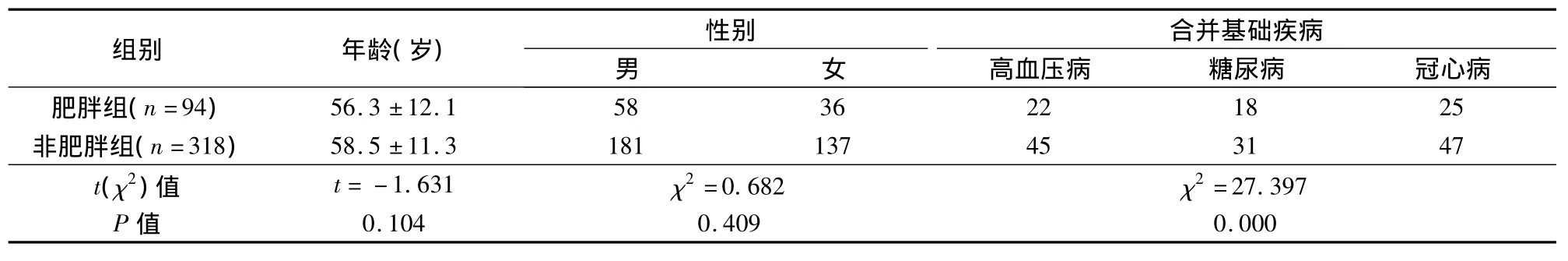
表1 2组患者一般资料比较(±s)
组别 年龄(岁)性别 合并基础疾病男高血压病 糖尿病 冠心病肥胖组(n=94)女56.3 ±12.1 58 36 22 18 25非肥胖组(n=318) 58.5 ±11.3 181 137 45 31 47 t(χ2)值 t= -1.631 χ2=0.682 χ2=27.397 P值0.104 0.409 0.000
表2 2组患者肿瘤情况及病理资料比较(±s)
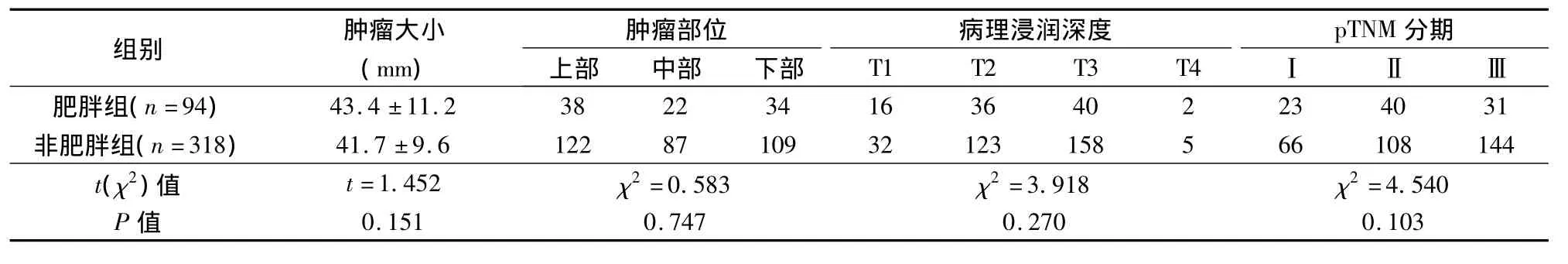
表2 2组患者肿瘤情况及病理资料比较(±s)
组别 肿瘤大小(mm)分期上部 中部 下部 T1 T2 T3 T4肿瘤部位 病理浸润深度 pTNM 43.4 ±11.2 38 22 34 16 36 40 2 23 40 31非肥胖组(n=318) 41.7 ±9.6 122 87 109 32 123 158 5 66 108 144ⅠⅡⅢ肥胖组(n=94)t(χ2)值 t=1.452 χ2=0.583 χ2=3.918 χ2=4.540 P值0.151 0.747 0.270 0.103

表3 2组患者手术方式比较
1.2 方法
所有手术均参照《腹腔镜胃恶性肿瘤手术操作指南》[5]进行操作。
1.2.1 腹腔镜辅助根治性远端胃次全切除术 将手术台调整至头高脚低位,并根据情况做适当的侧倾。助手用三叶拉钩将肝脏顶起,充分暴露术野。将大网膜向头侧翻起,超声刀离断结肠肝曲部大网膜,进入横结肠系膜前后叶间隙,紧贴胰头表面分别解剖、裸化胃网膜右动、静脉,紧贴根部上血管夹后切断,清扫幽门下(第6组)淋巴结。分离胰腺背膜至胰腺上缘。打开肝十二指肠韧带,清扫肝十二指肠韧带内肝固有动脉周围(12a)、肝十二指肠韧带内门静脉周围(12v)淋巴结。于胃右动脉根部上血管夹后切断,清扫幽门上(第5组)淋巴结。分离裸化十二指肠起始部,用线形切割吻合器(美国强生公司,Endo-GIA 45 mm)距幽门2~3 cm切断十二指肠。继续分离胰腺被膜,肝总动脉骨骼化,清扫肝总动脉周围(第8组)淋巴结。解剖、骨骼化胃左动、静脉,根部上可吸收血管夹后切断,清扫胃左动脉周围(第7组)淋巴结。显露脾动脉近端,清扫脾动脉周围(第11组)淋巴结。沿肝下缘切断小网膜至贲门右侧,分离腹段食管并向下清扫贲门右(第1组)、胃小弯(第3组)淋巴脂肪组织至肿瘤上缘约5.0 cm处;切断结肠脾曲大网膜至胃大弯侧无血管区,至此腹腔镜下清扫操作结束。取上腹正中切口长5~6 cm,保护切口,将胃提出腹腔外,剥除横结肠中段大网膜及系膜前叶至胰腺下缘,常规行远端胃次全切除及毕Ⅰ或Ⅱ式吻合术。术毕常规放置1根右上腹腔引流管,逐层关腹。
1.2.2 腹腔镜辅助根治性全胃切除术 常规腹腔探查后,游离全胃及处理血管、清扫各组淋巴结,方法同根治性远端胃次全切除术。脾胃韧带用超声刀离断。取上腹正中切口,长5~8 cm,保护切口,将胃提出腹腔外,剥除横结肠中段大网膜及系膜前叶至胰腺下缘,距贲门口上方2~3 cm做荷包,切除全胃,重建消化道。术毕常规放置1根右上腹腔引流管,逐层关腹。
1.3 观察指标
淋巴结清扫总数、手术时间、术中出血量、肛门排气时间、术后并发症等。
2 结果
2.1 2组患者淋巴结清扫情况比较
肥胖组清扫淋巴结总数(20.8±7.5)枚(中位数22.5枚),非肥胖组清扫淋巴结总数(27.1±8.7)枚(中位数27.0枚),2组比较有统计学差异(t= -6.356,P=0.000)。
2.2 2组患者术中及术后恢复情况比较
肥胖组手术时间明显长于非肥胖组,术中出血量明显多于非肥胖组,2组术后肛门排气时间虽有统计学差异,但无实际临床意义,见表4。
表4 2组患者术中、术后情况比较(±s)
组别 手术时间(min)术中出血量(ml)肛门排气时间(d)肥胖组(n=94)220.7 ±40.4 132.1 ±34.1 3.6 ±1.0非肥胖组(n=318)185.5 ±29.1 106.2 ±18.6 3.4 ±0.8 t值9.365 9.572 2.005 P值0.000 0.000 0.046
2.3 2组患者术后并发症及围手术期死亡率比较
肥胖组术后并发症18例,发生率19.1%(18/94):2例围手术期死亡,1例为术后第3天出现急性心肌梗死死亡,1例合并甲状腺机能亢进性心脏病术后11 d出现肺部感染,继发心力衰竭死亡;1例吻合口漏,1例十二指肠残端漏,经禁食、持续胃肠减压、静脉高营养、腹腔引流后治愈;1例腹腔内出血,1例吻合口出血,经输血、补液等保守治疗后痊愈;1例腹腔内出血经再次手术止血治愈;5例肺部感染,4例腹腔感染经应用有效抗生素等处理后痊愈;2例切口感染换药处理后愈合。非肥胖组术后并发症发生率13.2%(42/318):1例术后第5天出现十二指肠残端漏,再次手术后发生严重腹腔感染死亡;2例腹腔内出血经再次手术止血治愈;2例吻合口漏,1例十二指肠残端漏,经应用抗生素、禁食、肠内营养、腹腔引流等处理后治愈;3例吻合口出血,4例腹腔出血,经输血、补液、应用善宁等保守治疗后痊愈;10例腹腔感染经应用抗生素、腹腔引流后治愈;11例肺部感染经应用有效抗生素等治疗后恢复;7例切口感染换药处理后愈合;1例急性心肌梗死转综合性医院心内科治疗后痊愈。2组术后并发症发生率无统计学差异(χ2=2.058,P=0.151)。围手术期死亡率肥胖组2.1%(2/94),非肥胖组0.3%(1/318),2组比较无统计学差异(P=0.132)。
3 讨论
腹腔镜手术治疗胃癌相对于开腹手术具有创伤小、术后恢复快、并发症少等明显的优势,并取得了较好的近远期疗效[6]。丁卫星等[7]报道71例腹腔镜辅助胃癌根治术,其中Ⅰ期20例,Ⅱ期8例,Ⅲ期27例,Ⅳ期16例,近期疗效良好。肥胖患者由于腹壁及腹腔内大量脂肪组织堆积,术野显露困难,手术难度加大。同时肥胖是糖尿病、高血压及肿瘤发病的高危因素[8]。肥胖会增加开腹胃癌手术的手术时间、手术出血量及术后并发症发生率[9]。2003年日本学者Noshiro等[10]首次报道早期胃癌肥胖患者腹腔镜手术的研究,结果显示肥胖组手术时间及术后肠道恢复时间长于正常组。由于肥胖患者胃周脂肪组织多,解剖层次不清,显露困难,分离时易出血,导致手术时间延长。本研究结果也显示肥胖组手术时间明显长于非肥胖组(t=9.365,P=0.000),术中出血量多于非肥胖组(t=9.572,P=0.000)。
崔明等[11]报道腹腔镜辅助胃癌根治术清扫淋巴结数目(22.2 ±9.9)枚,与开腹手术(23.4 ±9.4)枚无显著性差异。韩国学者Lee等[12]对1485例腹腔镜辅助胃癌根治术进行回顾性分析,结果显示,肥胖组淋巴结清扫数目少于非肥胖组,本研究结果也支持这一观点。可能原因为:国内大多数医院开展腹腔镜胃癌手术时间不长,例数不多,经验有限;肥胖患者解剖层面不清,术中易出血,完全做到骨骼化清扫难度较大,影响了清扫效果。腹腔镜胃癌根治术肥胖患者与非肥胖患者术后并发症发生率相当[13,14],本研究也证实了这一观点。
钱锋等[15]研究显示,腹腔镜胃癌根治手术的学习曲线大致为50例。我们认为肥胖会增加腹腔镜胃癌手术难度,延长手术时间,增加术中出血量,增加术后并发症发生率,进而影响术后恢复及近期疗效。在开展腹腔镜胃癌手术初期,特别是还未通过学习曲线阶段,应坚持将手术根治性及安全性放在首位,选择BMI<25的非肥胖病例。在积累了一定经验后,可以选择部分肥胖病例进行临床探索。我们的体会是,首先应有一个成熟的腹腔镜手术团队,特别是第一助手的显露尤其重要;应由易到难,先选择远端胃癌根治术,积累经验后再做根治性全胃切除术;手术过程中重视寻找正确的手术层面,耐心操作;肥胖患者(BMI≥30)应列为腹腔镜胃癌手术相对禁忌证。
1 Kitano S,Iso Y,Moriyama M,et al.Laparoscopy-assisted Billroth Ⅰgastrectomy.Surg Laparosc Endosc,1994,4:146 -148.
2 Goh PM,Khan AZ,So JB,et al.Early experience with laparoscopic radical gastrectomy for advanced gastric cancer.Surg Laparosc Endosc Percutan Tech,2001,11(2):83 -87.
3 中华医学会外科学分会内分泌外科学组,中华医学会外科学分会腹腔镜与内镜外科学组,中华医学会外科学分会胃肠外科学组,等.中国肥胖病外科治疗指南(2007).中国实用外科杂志,2007,27(10):759 -762.
4 Sobin LH,Wittekind CH.TNM Classification of Malignant Tumors.6th ed.New York:John Wiley & Sons,2002.11 -14.
5 中华医学会外科学分会腹腔镜与内镜外科学组.腹腔镜胃恶性肿瘤手术操作指南(2007版).外科理论与实践,2007,12(6):610-614.
6 Sakuramoto S,Kikuchi S,Kuroyama S,et al.Laparoscopy-assisted distal gastrectomy for early gastric cancer:experience with 111 consecutive patients.Surg Endosc,2006,20(1):55 -60.
7 丁卫星,龚建平,杨 平,等.腹腔镜辅助胃癌切除术71例临床报告.中国微创外科杂志,2008,8(8):716 -718.
8 National Task Force on the Prevention and Treatment of Obesity.Overweight,obesity,and health risk.Arch Intern Med,2000,160(7):898-904.
9 Tsujinaka T,Sasako M,Yamamoto S,et al.Influence of overweight on surgicalcomplicationsforgastric cancer:resultsfrom a randomized control trial comparing D2 and extended para-aortic D3 lymphadenectomy(JCOG9501).Ann Surg Oncol,2007,14(2):355-361.
10 Noshiro H,Shimizu S,Nagai E,et al.Laparoscopy-assisted distal gastrectomy for early gastric cancer:is it beneficial for patients of heavier weight?Ann Surg,2003,238(5):680 -685.
11 崔 明,李子禹,刑加迪,等.腹腔镜与开腹胃癌根治术D2淋巴结清扫的比较研究.中国微创外科杂志,2010,10(5):395-398.
12 Lee HJ,Kim HH,Kim MC,et al.The impact of a high body mass index on laparoscopy-assisted gastrectomy for gastric cancer.Surg Endosc,2009,23(11):2473 -2479.
13 Kunisaki C,Makino H,Takagawa R,et al.Predictive factors for surgical complications of laparoscopy-assisted distal gastrectomy for gastric cancer.Surg Endosc,2009,23(9):2085 -2093.
14 Hottenrott C.Body mass index and risks of laparoscopic gastrectomy.Surg Endosc,2009,23(13):2864 -2866.
15 钱 锋,孙 刚,唐 波,等.腹腔镜胃癌根治手术的学习曲线.中国微创外科杂志,2008,8(6):510 -512.

