大菱鲆疾病早期快速检测方法——胶体金免疫层析试纸的研制与建立
王蔚芳,柴书军,刘庆堂,雷霁霖,丁福红,洪 磊,刘新富,苏 柯
(1.中国水产科学研究院黄海水产研究所,青岛市海水鱼类种子工程与生物技术重点实验室,青岛 266071;2.河南省农业科学院,河南省动物免疫学重点实验室,郑州 450002;3.青岛通用水产养殖有限公司,青岛 266404)
1 前言
鱼类是具有细胞免疫和体液免疫系统的水生脊椎动物,抗体(免疫球蛋白)是机体免疫应答反应的最主要介质。当鱼体受到外来物质刺激后(如病害、疫苗等),其体内会产生相应的抗体以保护机体免受病害的侵袭[1]。据此,通过对特异性抗体的检测,便可实现对疾病的早期诊断和预警,并能对疫苗免疫效果进行评价。然而,现有的抗体检测方法如酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)、免疫荧光、核酸杂交技术等,均存在检测费时费力、成本高且需要专用仪器或专业人员操作等问题,不利于抗体的现场快速检测,限制了鱼病的早期快速诊断。因此,在当前水产养殖高度发达时期,研究建立一种适用于鱼类抗体的快速、灵敏、经济适用、操作简便的现场快速检测方法就显得特别迫切。
通过胶体金免疫层析原理研制成功的检测试纸可以做到不需要专业技能和仪器,操作简单,易于推广应用,是实现养殖鱼类抗体现场快速检测和病害早期快速诊断的一种有效方法。自20世纪80年代末以来,这一方法已应用于多种分析物,包括抗原、半抗原、抗体和核酸的定性和半定量快速检测[2],已成为当代最快捷、敏感的免疫学检测技术之一,并广泛应用于医学领域[3],然而在水产养殖领域,该研究与检测方法的建立尚属首次。
大菱鲆(Scophthalmus maximus)是从欧洲引进我国的海水养殖名贵鱼种,现已成为我国北方工厂化养殖的主养品种之一。随着养殖规模的迅速扩大和养殖密度的不断增加,疾病问题日显突出[4]。为了推进大菱鲆工厂化养殖的健康持续发展,研究病害的早期快速诊断和及时有效的防治技术显得极为重要。分析胶体金免疫层析检测试纸在陆生动物、畜牧业上的成功应用,引发人们考虑将其引入海水养殖鱼类中应用的可行性。文章采用胶体金免疫层析原理,结合水生动物的免疫学与生态环境特点进行结构与方法上的整体改造,以成分单一的牛血清白蛋白(bovine serum albumin,BSA)为模拟病原,制作大菱鲆抗体检测试纸,用以检测其BSA抗体,建立起首个大菱鲆抗体快速检测技术。一方面可以验证胶体金免疫层析检测试纸在海水鱼类中应用的可行性,另一方面有利于建立大菱鲆抗体检测试纸的通用模型并使之迅速达到实用化。在此基础上,如更换试纸上的BSA印记,便可以制备成其他疾病的抗体检测试纸,进而可供研发水产动物系列病害和药物残留等多种用途的新型快速检测工具。这一方法的成功建立在水产养殖领域中无疑具有重要的理论意义和广阔的应用前景。
2 材料与方法
2.1 实验动物
实验用健康大菱鲆系购自青岛通用水产养殖有限公司,平均体重为700~800 g;用于制备多克隆抗体的新西兰白兔系购自河南省农业科学院,体重约2 kg,饲养于实验室动物房内备用。
2.2 大菱鲆血清免疫球蛋白的提取与纯化
从健康大菱鲆尾静脉采血,室温下静置1 h,4 ℃过夜,次日离心(5000 r/min,30 min,4 ℃)分离血清,分装并保存于-70℃冰箱待用。
大菱鲆血清免疫球蛋白(immunoglobulin M,IgM)分离纯化的操作方法如下:大菱鲆血清以等体积0.01 mol/L(pH=7.4)磷酸盐缓冲液(phosphate buffered saline,PBS)稀释后,在 0.01 mol/L(pH=5.4)磷酸缓冲液(phosphate buffer,PB)中4 ℃透析,离心(3000 r/min,30 min,4℃)收集沉淀后,将沉淀溶解于0.1 mol/L(pH=5.4)PB中后继续按上述方法透析,再次离心收集沉淀后将其溶解于0.1 mol/L(pH=8.6)PB中,通过 Sephadex-200凝胶柱(80 cm × 1.5 cm)的进一步纯化,以0.1 mol/L(pH=8.6)PB为洗脱缓冲液,用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检验,收集纯度高的样品,-70℃保存备用。
2.3 多克隆抗体的制备及检测
将纯化的大菱鲆血清IgM与等体积的弗氏完全佐剂(Pierce,USA)混匀乳化后,对新西兰白兔背部皮下多点注射,每兔注射1 mL(含0.1 mg IgM)(首免);21 d后,将 IgM与弗氏不完全佐剂(Pierce,USA)等比混匀乳化后,进行加强免疫,每兔注射1 mL(含0.2 mg IgM)(二免);21 d后,以相同剂量和方法再次加强免疫(三免);21 d后,以2 mL(含0.3 mg IgM)的量再次加强免疫(四免)。四免21 d后通过心脏取血并分离血清,保存于-70℃冰箱备用。免疫期间定期从兔耳缘静脉取血,分离抗血清,用间接ELISA法检测兔血清抗体效价。
2.4 间接ELISA法的建立及抗体的检测
兔抗IgM血清效价检测:以0.05 mol/L(pH=9.6)碳酸盐溶液稀释 IgM 至 2 μg/mL,取 50 μL 稀释液加入96孔酶标板孔中,置4℃冰箱中过夜包被,次日以0.01 mol/L(pH=7.4)磷酸盐吐温缓冲液(phosphate buffered saline with 0.05%Tween-20,PBST)洗涤3次,每次3 min;用5%猪血清于37℃封闭1 h,封闭结束后以PBST同法洗涤;将兔抗IgM血清作为第一抗体,以1︰100开始倍比稀释,每孔加入50 μL,阴性对照为PBS,于37℃反应15 min后以PBST同法洗涤;每孔加入50 μL羊抗兔IgG-HRP(1︰1000稀释),于37℃反应30 min后洗涤;每孔加入新配制的50 μL显色液四甲基联苯胺 (3,3′,5,5′-tetramethylbenzidine,TMB)显色5 min后,加入2 mol/L硫酸溶液50 μL终止反应;结果判定用自动酶标仪读取OD450值(P/N≥2.1时判定为阳性)。此处的OD450为450 nm波长时的光密度值;P为酶标板各孔的读值;N为酶标板阴性对照孔的读值。
本实验室已制备保存的大菱鲆BSA免疫血清效价检测:BSA包被、封闭方法同上,将BSA免疫血清作为第一抗体;本实验制备的兔抗IgM血清(1︰10000)作为第二抗体,其他反应同上。
2.5 检测试纸制备
2.5.1 材料准备
实验用主要材料为玻璃纤维素膜、AE99硝酸纤维素膜(NC膜)、支持板(购自德国S&S公司),氯金酸(由上海化学试剂公司提供)、葡萄球菌A蛋白(staphylococcal protein A,SPA)(由北京本元正阳基因生物有限公司提供)。另外,X-only单向喷点仪、CM4000切割机、BioDot-TSR 3000读条仪由美国BioDot公司提供。
2.5.2 多抗的纯化
采用辛酸-硫酸铵盐析法[5]纯化由2.3获得的多抗,即兔IgG。透析后测定其效价水平及蛋白质含量,分装并于-20℃冻存备用。
2.5.3 金标抗体及金标抗体玻璃纤维素膜的制备
采用柠檬酸钠还原法制备胶体金[5],制备的胶体金颗粒直径为20 nm。多抗的胶体金标记按照文献[5]进行,其中胶体金溶液的 pH值为8.5,多抗的标记浓度为0.3 mg IgG每毫升胶体金。
玻璃纤维素膜用正常兔血清完全浸润以降低其非特异吸附性,43℃干燥3 h后,在干燥器内室温保存备用。将胶体金标记的多抗溶液用X-only单向喷点仪均匀喷洒于已处理过的玻璃纤维素膜(20 mm ×4 mm)上,43℃干燥3 h后,加入干燥剂密封保存于干燥的室温环境。
2.5.4 印膜制备
将NC膜置于喷点仪平台上,BSA(4 mg/mL)放入贮存池A,SPA(0.8 mg/mL)放入贮存池B。展平NC膜,并放上压条,开机后将BSA和SPA分别点射于NC膜上形成检测线和对照线。两线相距0.5 cm,位于NC膜的中间,距离膜的边距均为0.75 cm。在室温下自然干燥后,置于密闭室温保存备用。
2.5.5 试纸的组装
将NC印膜、金标抗体玻璃纤维素膜(结合垫)、玻璃纤维素膜(样品垫)及吸水纸(吸水垫)按照从下到上的顺序组装在不干胶支持板上(见图1)。将组装的半成品试纸放入CM4000切割机槽内,进行切割,以塑料外壳包装后制备成品试纸,注明生产日期,放入干燥剂一起密封,置于室温下保存备用。

图1 检测试纸各部分组装结构示意图Fig.1 Schematic diagram of the test strip showing its several components
2.5.6 试纸工作原理及程序
应用试纸进行检测时,将待检样品滴入样品垫区,在毛细作用下,滴入的样品会沿着试纸一直迁移扩散到吸水垫处。当检测样品呈阳性时(含抗BSA的IgM,即BSA-IgM),样品中待检测的BSA-IgM会与结合垫上的金标抗体(兔抗IgM)结合形成胶体金抗体复合物,此复合物会与NC印膜上检测线处的BSA结合,并在检测线区形成肉眼可见的胶体金红色条带。如果检测线不显红色,则说明检测样品为阴性。无论检测样品是阳性还是阴性,金标抗体都会与NC印膜上对照线处的SPA结合并显红色条带。
2.5.7 试纸性能测定
1)试纸检测特异性分析。将已制备的大菱鲆抗BSA抗血清(BSA免疫后1~10周的样品)以生理盐水10倍稀释后作为阳性血清,健康大菱鲆血清以生理盐水10倍稀释后作为阴性血清,用生理盐水作为对照。取100 μL样品滴加在半成品试纸的样品垫区,5 min内可裸眼观察结果,同时用BioDot-TSR 3000读条仪对检测线进行读值,量化结果。
2)试纸检测灵敏度分析。将已制备的大菱鲆抗BSA抗血清从1︰100开始以生理盐水倍比稀释以检验试纸的灵敏度,健康大菱鲆血清以生理盐水100倍稀释后作为阴性血清,用生理盐水作为对照。取100 μL样品滴加在半成品试纸的样品垫区,5 min内可裸眼观察结果,同时用BioDot-TSR 3000读条仪对检测线进行读值,量化结果。
3 结果与分析
3.1 大菱鲆血清IgM的纯化及其兔抗血清的纯化
大菱鲆血清经过盐析粗提和过分子筛纯化后,再经SDS-PAGE检验纯化后的血清IgM有2个条带,分子量分别是76 kD和27 kD,代表免疫球蛋白的重链和轻链(见图2),结果与文献[6]报道一致。
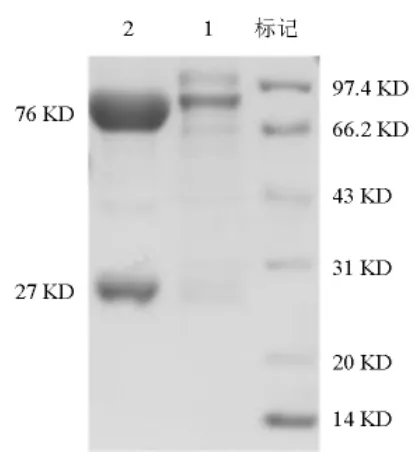
图2 纯化的大菱鲆血清免疫球蛋白IgM的SDS-PAGE图谱Fig.2 SDS -PAGE analysis of IgM purified from turbot serum
将纯化的大菱鲆血清IgM免疫新西兰白兔,经过4次免疫后,以间接ELISA法检测兔抗血清效价为1︰256000,将此兔抗血清进一步纯化获得其IgG用于制备检测试纸,检测其效价为1︰128000。
3.2 间接ELISA法检测大菱鲆BSA免疫血清效价
大菱鲆经过BSA免疫后,第4周开始产生特异性抗体,抗体效价为1︰800;第5周至第7周抗体水平逐步升高;第8周开始抗体水平升高到1︰51200并维持在这一水平至第10周。
3.3 试纸条的特异性检测
以组装后的试纸条检验制备保存的大菱鲆BSA免疫血清,结果显示,从大菱鲆免疫后第4周开始的血清样品经试纸检测,其检测线出现明显的显色反应,即阳性反应;试纸条检测线的颜色反应随着大菱鲆免疫时间的延长而显色且逐渐加深,其变化趋势与间接ELISA法检测结果一致;其中第10周的显色与第9周相比较显得略弱,这与ELISA法检测时第10周的显色相对光密度读值与第9周比较略低相一致。试纸条与健康大菱鲆血清和生理盐水均呈阴性反应。试纸条反应结果经BioDot-TSR 3000读条仪进行读值量化后见表1。大菱鲆BSA抗体检测试纸的阳性和阴性两个检测代表结果如图3所示。

表1 检测不同样品后试纸条检测线的相对光密度值Table 1 The relative optical density(ROD)of test lines on the strip with different samples
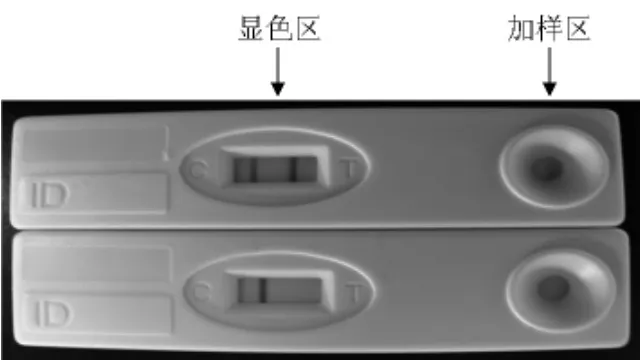
图3 大菱鲆BSA抗体检测试纸Fig.3 An immunochromatographic strip for the serological detection of antibodies against BSA in turbot,Scophthalmus maximus
3.4 试纸条的灵敏性检测
组装后的试纸条与1︰100开始倍比稀释的大菱鲆BSA免疫血清反应,随着稀释倍数的增加,裸眼可见试纸条的颜色反应逐渐减弱。以大菱鲆免疫后第九周血清为例,当血清稀释到1︰25600时显色为弱阳性,继续稀释则不见显色反应,试纸条检测结果与间接ELISA法检测结果相当。试纸条与健康大菱鲆血清和生理盐水均呈阴性反应。试纸条反应经BioDot-TSR 3000读条仪进行读值量化后结果见表2。

表2 检测不同稀释梯度的样品其试纸条检测线的相对光密度值Table 2 ROD of test lines on the strip with different dilutions of the samples
4 总结与讨论
当前,水产养殖业正处于高度发达时期,研究和建立一种简易、快捷的鱼类早期疾病检测方法是业界最为迫切的需求之一。研究发现,在鱼类免疫系统中有4种免疫球蛋白(Immunoglobulin,Ig),即IgM、IgD、IgT 和 IgZ[7],其中 IgM 是在真骨鱼类中发现最早、研究最多的Ig,也就是当前鱼类抗体检测的主要Ig。因此,研究人员可以通过对IgM的检测实现对鱼类疾病的早期诊断。抗体检测的优势相对于抗原检测,因可以在疾病的潜伏期内发现其踪迹,而受到人们的高度重视。然而,对于IgM的检测,现有方法的最大不足是步骤繁琐、周期长,且需专业人员操作。为此,养殖生产一线人员特别渴望获得一种操作简便、可以现场快速检测的方法,以实现真正意义上的鱼病早发现、早诊断。
据有关文献报道,胶体金具有肉眼可以观察到的红色、与多种生物大分子(包括抗原、抗体)结合后不会影响其活性等优点,而被广泛应用于标记组织和细胞、电镜分析、免疫斑点渗滤和免疫层析等领域[8~11]。近年来,由胶体金标记物与膜载体相结合而构建完成的胶体金免疫层析检测试纸,其灵敏性已在畜禽疾病检测中得到证实,并且迅速发展成为一种简便、实用的病害检测方法而被畜禽界普遍采用。这种检测试纸现已实现了商品化生产,并显示出巨大的市场潜力[3]。
本研究吸取了畜牧业疾病检测试纸的基本原理和方法,首次制备的鱼类疾病检测试纸已经成功地应用于水生动物——大菱鲆抗BSA抗体的检测,其检测的特异性和灵敏性与ELISA检测水平相当。由此可见,该项快速检测技术的建立将可在海水鱼类养殖中普遍推广应用,其不仅可为鱼类疾病的早期检测提供新技术、新方法,而且可以为疫苗免疫效果的评价提供一种比过去更为便捷、直观的新方法。
文章建立的大菱鲆BSA抗体检测试纸之所以具有较高的特异性和敏感性,分析其原因主要与制作试纸所用的材质及其处理方法、胶体金标记抗体时采用的pH值和标记的蛋白浓度有关[12]。本研究选取玻璃纤维素膜作为结合垫,将其安置于层析系统的中间,其网格均匀且非特异性吸附低,并具有一定的硬度,能够很好地负载胶体金标记物和待检测样品而不致被吸附;同时对结合垫进行封闭处理后,可以更好地降低其非特异性吸附及非特异性反应。本试验发现,当用猪血清IgG对玻璃纤维素膜进行封闭处理时,检测试纸会发生非特异性反应——即检测生理盐水时检测线会显色;当用正常兔血清进行封闭处理时,则不会发生非特异性反应。另外,胶体金与标记蛋白之间的电荷引力是实现标记的重要作用力之一,当胶体金溶液的pH值接近标记蛋白的等电点时,两者的吸附力最强;标记蛋白的浓度是否合适也是影响标记的一个重要因素,蛋白浓度过高会造成一定的浪费,同时容易引起试纸的拖带现象,反之则会导致胶体金标记不完全,从而降低试纸的灵敏度,并可能出现假阳性现象。通过梯度标记试验,反复比较不同标记pH值和标记蛋白的浓度,确定胶体金溶液的pH值为8.5,且多抗的IgG标记浓度为0.3 mg/mL时,即可达到最佳标记效果。
检测实验证明,笔者等制备的鱼类疾病专用检测试纸使用方便,检测快速,可裸眼即时判读结果而无需特殊操作技能和仪器设备的辅助。因此,在养殖生产实践中可用作对疫苗的应用效果进行现场快速评估,也可对病害的发生过程进行实时跟踪检测。但是,目前尚存在如下问题期待以后的研究来解决:
1)该试纸尚不能区分所检测的抗体是由疫苗诱导抑或自然发病所产生,如果已知鱼体接种过疫苗,则可应用该试纸评估抗体产生情况;如已知鱼体未接种过疫苗,应用该试纸检出抗体则说明鱼体正感染此病或者曾经感染过此病。至此目前只能结合鱼体平时表现进行分析再做出最终判断,实现免除实验室繁琐的检验过程,为提高病害防控能力赢得宝贵时间。
2)实验中,试纸的颜色反应会随鱼体抗体水平的升高而逐渐加深,即试纸的颜色反应与待检抗体水平存在一定的线性关系,只通过裸眼观察尚无法进行定量判断;所采用的BioDot-TSR 3000读条仪虽然可以量化结果,但是操作复杂,需要有专业技能,且不便携带,限制了野外配合检测试纸的操作与应用。因此,今后需开发便携式试纸条阅读器,以便为终端用户提供更多的选择,方可达到获得定性检测结果的同时也可获得定量检测的效果,如结合网络运用,则可实现数据的远程传送。
3)制备的检测试纸虽已达到了ELISA法的检测水平,但尚不能在鱼体免疫初期即当抗体水平处于较低水平的状态下检出结果,故今后尚需进一步提高试纸检测的灵敏度,如采用单克隆抗体技术则有可能更精准地捕获靶目标,或者采用信号放大系统,如生物素-亲和素系统或免疫金银染色法进行银加强等,结合使用简易检测仪器,便可进一步提高检测灵敏度,以拓宽其检测范围。
5 结语
笔者等应用胶体金免疫层析试纸快速检测技术,首次在大菱鲆上成功研制出抗体检测试纸(此抗体检测试纸已获得国家实用新型专利授权,专利号:ZL201120131593.7),表明该项技术可以推广应用于鱼类病害的抗体检测,还可以设计改造制作成病原检测试纸,为水产养殖动物疾病(包括真菌性、细菌性、病毒性及寄生虫性等疾病)的早期诊断和治疗提供快捷手段。该项技术的诞生使养殖生产现场检测与监测疾病早期发生成为可能,其理论与技术经济价值很高,应用前景广阔。为了使其在水产养殖领域能够达到快捷、简便、高效的应用阶段,应该在今后进一步开展精准化检测试纸的研制与建立。
[1]肖克宇.水产动物免疫与应用[M].北京:科学出版社,2007.
[2]张改平,郭军庆,李青梅,等.动物疫病免疫试纸快速检测技术概况[J].河南农业科学,2009(9):174-176.
[3]王蔚芳,李青梅,郭军庆,等.胶体金免疫层析快速检测技术及其在水产养殖业中的应用前景[J].渔业科学进展,2010,31(3):113-118.
[4]秦 蕾,王印庚,阎斌伦.大菱鲆微生物性疾病研究进展[J].水产科学,2008,27(11):598-601.
[5]朱立平,陈学清.免疫学常用实验方法[M].北京:人民军医出版社,2000.
[6]魏鉴腾,陈吉祥,王淑娴,等.大菱鲆血清免疫球蛋白IgM的纯化及应用研究[J].中国海洋大学学报,2008,38(6):932-936.
[7]Warr G W.The immunoglobulins and the genes that encode them[J].Developmental& Comparative Immunology,1995,19:1-12.
[8]Faulk W P,Taylor G M.An immunocolloid method for the electron microscope[J].Immunochemistry,1971,8(11):1081-1083.
[9]Anon K,Paulsen A Q,Tilley M B,et al.Use of electron microscopic and immunogold labeling techniques to determine polyomavirus recombinant VP1 capsid-like particles entry into mouse 3T6 cell nucleus[J].Journal of Virological Methods,2000,90:91-97.
[10]Zhang L,Volknandt W,Gundelfinger E D,et al.A comparison of synaptic protein localization in hippocampal mossy fiber terminals and neurosecretory endings of the neurohypophysis using the cryo-immunogold technique[J].Journal of Neurocytology,2000,29(1):19-30.
[11]Brorson S H.A method for measurements of the efficiency of immunogold labeling of epoxy-embedded proteins subjected to different retrieval techniques[J].Micron,2004,35:619-621.
[12]张付贤,王兴龙.免疫胶体金技术影响因素分析[J].中国畜牧兽医,2009,36(5):199-202.

