猪瘟病毒强弱毒株通用性RT-PCR检测方法研究进展
杨宗照,王剑峰,谢 正,李洪洲 ,陈 阳
(1.杭州市畜牧兽医局,浙江杭州 310020;2.杭州市原种场,浙江杭州 3111153;3.杭州市萧山区畜牧兽医局,浙江杭州 311203)
猪瘟(classical swine fever,CSF)是由猪瘟病毒(CSFV)引起的一种急性、发热性、高度接触性传染病,可导致各年龄猪发病。CSFV为黄病毒科瘟病毒属有囊膜的正链RNA病毒。猪瘟因其流行程度高和致死率高,给养猪业带来了严重损失。OIE将其列为必须通报的传染病。我国将其定为一类传染病。
1955年我国研制出的具有良好免疫效果的猪瘟兔化弱毒株疫苗应用至今,对世界范围内猪瘟疫情的控制做出了重大贡献,目前我国对猪瘟实行强制免疫政策。近年来,CSFV流行毒株在抗原性及毒力方面发生变异[1],根据E2和NS5B的基因,目前共分为3个主型,10个亚型,即1.1-1.3、2.1-2.3、3.1-3.4亚型[2]。许多国家流行的猪瘟在临床症状和病理变化方面均出现了新变化,出现了典型猪瘟和非典型猪瘟共存、持续感染和隐性感染共存等新特点[3-5],猪瘟、蓝耳病等疾病混合感染的情况也逐渐增多。猪瘟病理变化不具典型性,且多种病毒混合感染现象日益突出,这些都增加了猪瘟诊断及防控的难度。
国内传统的CSF诊断方法包括免疫荧光试验、病毒分离培养、动物接种试验、新城疫病毒强化试验、酶联免疫吸附试验(ELISA) 、血清学试验等,为CSF的鉴定和诊断提供了有效的手段。但这些方法在特异性、敏感性以及时效性等方面都有各自的不足,不适用于CSFV感染的早期快速诊断。近年来,分子生物学检测技术,尤其是RT-PCR技术发展迅速,使猪瘟的检测变得快速、准确,本文主要对猪瘟强、弱毒株通用的RT-PCR检测技术作以综述,以期为CSFV检测及防控工作提供参考。
1 猪瘟病毒的基因结构
CSFV基因组长约12.5 k b,仅含有一个大的开放性阅读框架(ORF),ORF两侧是5'端非翻译区(5'UTR)和 3'端非翻译区(3'UTR),且5'-端无帽子结构,3'-端无 poly(A)尾巴。ORF翻译成含3 898个氨基酸残基,分子质量约438 k u的多聚蛋白,并进一步在病毒和宿主细胞蛋白酶的作用下加工为成熟蛋白,CSFV的所有结构蛋白和非结构蛋白均由该ORF所编码。前体蛋白以共翻译和后翻译的形式在细胞蛋白酶和病毒特异蛋白酶作用下,加工成结构蛋白和非结构蛋白,病毒RNA上的编码结构蛋白和非结构蛋白的顺序为 Npro、C、Erns(E0)、E1、E2、P7、NS2-3、NS4A、NS4B、NS5A、NS5B(图1),部分基因别名(表1)。NS2-3 可被加工成 NS2、NS3,除C、E0、E1和E2为结构蛋白外,其余均为非结构蛋白,最具有免疫防制研究价值的是 E0和E2。其中E2构成了CSFV的主要免疫原,与牛病毒性腹泻(BVDV)以及羊边界病毒(BDV)都存在较强的交叉免疫反应。
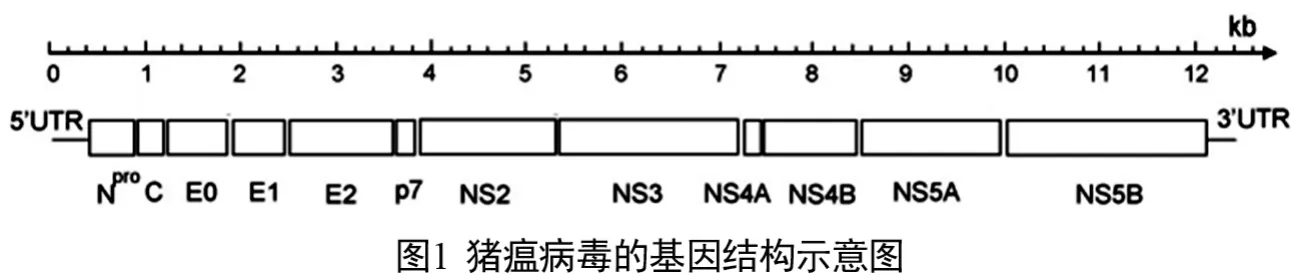

表 1 猪瘟病毒部分基因的别名
基因序列分析发现弱毒疫苗株HCLV与强毒株Shimen的E2基因主要抗原编码区序列中分别有10个和16个限制性内切酶酶切位点,可用来鉴别两种毒株[7]。猪瘟典型毒株有Alfort、石门毒株(Shimen)、Brascia、Alfort、猪瘟兔化弱毒疫苗C株(HCLV)等。
2 普通RT-PCR
普通RT-PCR是最早采用的技术,在RT-PCR结束后需要电泳拍照。最早是普通单重RT-PCR,即一次只检测一种病原,后来产生了普通多重RT-PCR,即一次可以检测出两种及以上的病原。
2.1 单重 PCR
2.1.1 两步法
傅烈振针对CSFV 5'端非编码区设计了引物,扩增产物为194 bp的两步法RT-PCR检测方法。其引物为 P1:5'-CCATGCCCATAGTAGGACTAGC-3'(正向引物,88~109 nt,Alfort);P2: 5'-ATGTGATTTCACC CTAGCGACC-3'(反向引物,261~282 nt,Alfort)。乔军设计了引物:TC(GA)(AT)CAACCAA(TC)GAGATAGGG(X87939 Alfort,2 477-2 497 nt);CACAG(CT)CC(AG)AA(TC)CC(AG)AAGTCATC(X87939 Alfort,2 748-2 726 nt),建立了扩增产物为272 bp的RT-PCR方法,这被农业部2007年制定的《猪瘟防治技术规范》所采用。
刘建柱对猪瘟RT-PCR诊断方法与兔体交叉试验诊断方法的相关性进行了研究。通过计算机软件设计了针对猪瘟病毒E2基因保守区的1对引物(5'-CAGGTATGCGATCTCGTCAACCA-3',5'-GGGCA CAGCCCAAATCCGAAGT-3'),建立猪瘟病毒RTPCR检测方法,同时应用兔体交叉试验进行对比,结果表明,二者的符合率为 100%,但RT-PCR可大大降低检测所用的时间,更便于猪瘟的快速诊断。该方法仅应用于7份临床送检病例,样品数如能扩大,结论更具有说服力。
贾赟参考猪瘟兔化弱毒C株E2区基因和猪蓝耳病病毒的基因序列,各设计了引物,猪瘟上游引物: 5'-CGCGTCGACCGA TACTTGGCATCATTG-3',下游引物:5'-AACCTGCAGCCCCAACTTACAG TAGA-3',产物长375 bp。周斌对贾赟建立的检测猪瘟、蓝耳病的方法的检测对象进行了拓展,对江苏、浙江等省市的17个大中型猪场送检的186份种公猪精液样品进行了检测,结果24份样品呈CSFV阳性,其中有11份为PRRSV和CSFV的混合感染,约占送检精液样品的5.91%。试验结果表明,所建立的RT-PCR方法可用于精液中这2 种野毒感染的快速鉴定和分子流行病学调查。该方法能够同时检测猪瘟和蓝耳病,因此实用价值比较大。
俞伏松[8]参照CSFV NS3基因序列,设计上游引物(HCV1):5'- GCTCCTGGTTGGTAACCTCGG-3'位于基因组的5 076~5 096位;下游引物(HCV2):5'- TGATGCTGTCACACAGGTGAA- 3'位于基因组的5 584~5 564 位,预期扩增片段长度为509 bp。应用RT- PCR以CSFV兔化弱毒株RNA为模板进行扩增,获得与预期大小相符特异性目的片段,敏感性达到10 pg CSFV-RNA;15份临床疑似病料应用RT-PCR的检出率(66.7%)与直接荧光抗体试验(DFA)的检出率(60.0%)总符合率为80%。表明RT-PCR方法比DFA更敏感,两种方法均可用于猪瘟的快速诊断。
2.1.2 一步法
焦莉[9]针对猪瘟病毒5'端非编码区保守序列设计了一对引物,5'-AAACGGAGGGACTAGCCGT-3'(上游引物 120~138 nt,Alfort 187),5'-GATTCAACTC CATGTGCCATG-3'( 下 游 引 物 366~386 nt,Alfort 187),扩增产物长267 bp,建立了检测CSFV的一步法RT-PCR方法,该方法对 5 株CSFV扩增结果均为阳性,对照毒株扩增结果均为阴性;对CSFV检测的敏感性为 1.09×10-1ng总RNA量。
吴鑫[10]根据猪瘟病毒石门毒株的E2 基因序列,设计合成了1 对检测猪瘟病毒E2 基因的RTPCR引物。上游引物Pf:5'-CAGGTATGCGATC TCGTCAACCA-3',下游引物Pr:5'-GGGCACAGCCC AAATCCGAAGT-3',预期扩增的片段大小267 bp。建立了猪瘟病毒E2基因RT-PCR 检测方法,应用建立的方法从26份疑似猪瘟病料中检出阳性病料24份,阳性检出率为92.3%;结果表明,建立的RT-PCR 方法具有良好的特异性和敏感性,可用于CSFV临床病料的检测和分子流行病学调查。
2.1.3 巢式RT-PCR
朱小甫[11]根据Shimen 株(AF092448)基因序列设计了 2 对引物。P1:5'-GTAACTGGGGCACAAGG-3',P2:5'-TTATCACTATCAGCCACAGGACAT-3',PED1:5'-TCGACAACCAATGAGATAGGG-3',PED2:5'-CACAGCCCAAATCCAAAGTCATC-3',预计扩增片段长度为272 bp。优化了猪瘟病毒(CSFV)的RT-nested PCR 检测方法,并对所优化的RT-nested PCR 特异性进行了检验。结果表明,该方法检测CSFV cDNA含量的最低极限为1×10-7ng/mL,特异性强。应用此方法对福建省133 份病料进行检测,结果有60 份病料为阳性,阳性率为45.1%。结果提示优化的检测方法灵敏度高,特异性强。
2.2 多重 PCR
随着养猪业规模化的发展,混合感染逐渐增多,猪瘟与蓝耳病的混合感染最为常见,因此设计多种病原同时检测的多重RT-PCR方法也应运而生。 建立多重PCR 检测方法有许多需要注意的地方: 在引物的设计与选择方面,要注意引物二聚体的形成;在选择反应条件时,要注意各引物与模板的比例及退火温度的选择,反应条件要有利于片段较小的一方等。同时注意各扩增片段的大小,以便在琼脂糖凝胶电泳中能清晰分开。
刘建柱根据CSFV E2基因、猪细小病毒(PPV)VP2基因和猪伪狂犬病病毒(PRV) gⅡ基因的保守序列,分别设计3对引物。用这 3 对引物优化后,得到3条与试验设计相符的288 bp(CSFV)、575 bp(PPV) 和700 bp(PRV) 特异性条带,敏感性检测结果表明,该多重PCR可以检测到14.5 ng/L的CSFV核酸模板。针对CSFV的上下游引物分别为:5'-CAGGTATGCGATCTCGTCAACCA-3',5'-GGGCAC AGCCCAAATCCGAAGT-3'。
猪瘟、蓝耳病和流行性乙型脑炎都可引起种猪繁殖障碍,刘辉[12]根据猪瘟病毒的E2 基因保守序列,蓝耳病病毒的ORF7及部分ORF6 和3'-UTR和猪乙型脑炎病毒的E基因保守序列,设计了3 对引物,建立了同时检测猪瘟、蓝耳病、乙型脑炎的多重RTPCR。薛媛[13]根据JEV的E 基因保守序列,并参考罗廷荣所使用的CSFV引物,建立检测CSFV、JEV的复合RT-PCR方法。
刘杉杉[14]为建立同时检测猪捷申病毒(PTV)、猪瘟病毒(CSFV)和猪繁殖与呼吸综合征病毒(PRRSV)的多重RT-PCR (mRT-PCR)检测方法,以 CSFV Erns 基因、PRRSV ORF6 基因和 PTV 5'-UTR基因为对象,建立检测3种病毒的 mRT-PCR 方法。CSFV 的最低核酸检出量为7.81×103拷贝,略低于单一RT-PCR 敏感性;应用该方法对69份送检样品进行检测,其中PRRSV和CSFV混合感染检出率为4.35%,CSFV 和 PTV 的混合感染检出率为13.04%,3 种病毒的混合感染检出率为 8.70%,该方法对临床早期诊断和流行病学调查具有重要意义。
猪也可能感染与同属的BVDV、BDV,Díaz[15]建立了一种区分它们的RT-PCR方法,扩增的靶序列为NS5B区,敏感度可达0.89TCID50。缺点是扩增的片段只有174 bp,在电泳后条带不易与引物二聚体区分,使用该方法的引物对扩增过程稍加改进或许可以成为荧光定量方法。
Jiang[16]建立了一种同时检测猪瘟、蓝耳、伪狂犬、圆环病毒的多重RT-PCR方法,其优点是可以同时检测多重病原,缺点是其敏感度不高,对CSFV的最低检出限为 2.66×107拷贝 /µL。
Xu[17]建立了一种两步法检测猪瘟、蓝耳、乙脑、圆环病毒2型、伪狂犬、细小病毒等6种病原的多重RT-PCR方法,其中猪瘟等RNA病毒核酸在经过RT生成cDNA后,与伪狂犬等DNA病毒的DNA一起进行PCR。该法节省了时间,通过初步试验,与单重的结果一致。如果能够进一步检测大量样本,结果与单重方法符合率较高,那么该方法具有广阔的应用前景。
3 荧光定量RT-PCR
近年发展起来的实时荧光定量PCR (realtime fl uorescent quantitative PCR,FQ-PCR) 技术能快速检测极微量的病毒核酸,而且能准确确定样品中病毒的拷贝数,操作方便,耗时短,结果直观,因而迅速在医学、农业等领域得到了广泛应用。
3.1 单重荧光定量
Pérez[18]设计了SYBR法检测猪瘟,其扩增区在猪瘟的NS5B区,该方法对不同样品的敏感度有所不同,如血清、组织样品分别是10,100拷贝/µL。李军[19]根据猪瘟病毒基因组5'UTR基因序列设计引物(5'-GCCCATAGTAGGACTAGCA-3';5'-CGAACTACTGACGACTGTC-3'),建立了一个用于猪瘟病毒快速定量检测的SYBR Green 荧光定量RT-PCR方法,最小检出量为2×102病毒基因组拷贝数。

表 2 以5'UTR端设计的检测猪瘟的单重荧光定量方法
袁雪梅[20]根据猪瘟病毒 (CSFV)5'UTR,设计猪瘟病毒特异性的引物和探针,建立了基于SYBR Green和TaqMan探针的两种荧光定量PCR检测方法。两种方法对猪瘟病毒C株的检测下限均为10TCID50,均高于常规的套式 PCR。用携带该基因片段的重组质粒为模板进行检测,SYBR Green方法的检测下限为 3×100拷贝,比TaqMan探针方法更加灵敏 (3×101拷贝)。进一步应用 SYBR Green方法对不同感染阶段细胞内病毒 RNA 复制水平进行检测,与病毒滴度的结果基本一致。该研究建立的 SYBR Green I荧光定量PCR检测方法能够应用于组织和培养细胞中猪瘟病毒的检测。
陈玉栋针对猪瘟病毒兔化弱毒疫苗株HCLV 序列(AF091507)的 5'UTR设计引物和探针,建立了定量检测猪瘟兔化弱毒疫苗株的荧光定量RT-PCR方法。其灵敏度为102拷贝,线性范围为107~102,对9份疫苗样品进行了检测,与兔体定型热反应方法相比较,有很好的相关性。该法为猪瘟病毒分子生物学研究提供了一种新的、简捷有效的工具。邓力也设计了针对HCLV的5'UTR使用探针的FQ-PCR方法,敏感,其灵敏度为10拷贝/µL。
刘大伟[21]为建立一种快速鉴定猪瘟兔化弱毒疫苗株(HCLV)的方法,在Erns基因序列区内设计引物和TaqMan 探针,即P1:5'-GCGGCAGTTTACTCCAGGAC-3';P2: 5'-CCAACCTCTCTTCCCGCAGTG-3',荧 光 探针 FP:Fam-5'-TGCCTCCCGAGCCAAGATGTCACC-3'–Eclipse)。该方法检测的灵敏度可达 3.84拷贝 /µL;分别用经典的兔检法测定兔体感染量(RID)和新建立的FQ RT-PCR方法进行比较检测,两者有较好的相关性。
王云龙[4]也设计了针对5'UTR的TaqMan探针,建立了检测猪瘟的FQ-PCR方法,该方法检测灵敏度可达 1.0×100拷贝/µL,线性范围为 109~100。还有王荣、李安、马琳、任夫波等根据猪瘟5'UTR设计了荧光定量方法(表2)。
Wen[22]建立了MGB探针一步法检测猪瘟的方法,一般情况下,该方法比病毒分离敏感10倍,与病毒分离符合率76.7%。
总之,这些方法以针对5'UTR设计的方法居多,在选择时,首先可选SYBR方法,因为它的敏感性比较高,成本比探针法低。其次在使用时如果遇到检测结果可疑的情形,最好选用靶序列不同的方法,如针对5'UTR 的方法和针对NS5B的 FQ-PCR方法。
3.2 多重荧光定量
Huang[2]使用Taqman探针建立了同时检测CSFV 3个亚型的方法,与以前的扩增后测序定型相比,节省了大量的时间。
牛伟[23]根据猪瘟病毒E2和猪繁殖与呼吸综合征病毒ORF5的序列设计2对特异性引物,建立了一种快速检测CSFV和PRRSV的SYBR Green 实时荧光定量PCR方法。猪瘟上游引物:5'-CGAGTCCTGTTGTCAA GGG-3',下游引物:5'-AG TTGTTGGGCTCACTGCT-3'。
Cheng[24]使用Taqman探针建立了同时检测美洲型PRRS和CSFV的方法,其引物位置在蓝耳病的ORF7、CSFV的5'UTR。对猪瘟的敏感度为3.2TCID50或13 RNA拷贝,是一种敏感度相当高的方法。
4 各种方法的优缺点
4.1 普通RT-PCR与荧光定量RT-PCR
普通RT-PCR方法具有成本低,仪器设备、耗材便宜等优点,不便之处是需要开管操作还需要电泳、拍照等后续步骤,荧光定量方法省去了后续操作,更加快捷,省力,而且可以定量,但是需要的仪器耗材较贵,成本较高。
4.2 SYBR与探针荧光定量方法的优缺点
使用探针法还比较容易设计多重RT-PCR,同时检测多种病原。探针法对序列的变化非常敏感,因此,赵建军等设计两条只差一个碱基的探针即能同时快速区分猪瘟兔化弱毒苗和猪瘟野毒,具有很高的特异性。但是对于变异大的病原可能产生假阴性,探针的成本也较高。 SYBR法设计简单,可以设计兼并引物,对于有些变异的病原照样可以检测,成本也不高,普通的荧光定量仪器均可满足需要,但是在设计多重FQPCR时有较高难度。
4.3 荧光定量标准品的问题
应用FQ RT-PCR方法检测RNA病毒,通常用体外转录的RNA片段作为标准品,Hoffmann等提出用体外转录的 CSFV RNA 片段作为标准品可消除因RNA 提取和反转录效率带来的实验误差。但体外转录的 RNA 作为标准品易降解,并且每次实验前需重新稀释定量,不能真实代表单链 RNA 病毒感染样品中负链和正链 RNA 的比例。采用已知滴度的CSFV石门株血毒总RNA反转录产物后作为标准品,虽可较精确用于临床样品的定量,但每次实验均需要制备标准品,而且存在病毒扩散的危险性。标准品采用质粒 DNA 可能存在转录效率问题,Hayward 等认为对不同目的片段RNA 的反转录效率相差很大,但对于同一个靶片段而言,其反转录效率稳定 。刘大伟[21]也证实了采用质粒DNA作为标准品具有稳定、易于标准化的优点。
4.4 两步法的优点 针对RNA 病毒的反转录采用随机引物进行扩增,这样对于几种RNA 病毒混合感染的样品来说,一次反转录就可以解决几个病毒反转录的问题,极大地节约了时间。
5 检测部位的选择和其它注意事项
吴鑫[10]发现同一只病猪的不同内脏器官的RTPCR 结果并不相同。淋巴结的检出率要明显高于其他脏器,大致排序为: 淋巴结>脾脏>肾脏>肺脏>肝脏。这可能与不同病程病毒复制的部位及不同脏器提取RNA 的难易程度有关。如肝脏中富含内源性RNase,在提取肝脏RNA 时,就更容易发生RNA降解,从而导致RT-PCR失败。
夏芳用所建立的荧光定量 PCR 方法检测出的样品数据,免疫猪后组织内病毒主要分布在血液、脾脏、淋巴结、扁桃体、腹股沟淋巴结中,其它部位未见有病毒分布。应采集扁桃体、脾、肾、肺和回肠末段。扁桃体是猪瘟病毒(CSFV)感染后最先能检测出病毒抗原的组织,因而扁桃体是急性病例的首选病料。回肠末段则是慢性病例的首选病料。病料应从多个病猪采集。对于活猪而言,血液和扁桃体的刮取物是比较好的CSFV检测样本。在血液中的检出率:强毒株在3~8 dpi、中毒株在5~28 dpi接近100%,弱毒株在5~21 dpi时检出率在27%~70%[25-26]。肌肉和血清中的检出率比较一致,但因为检出率较低,因此绝对不是检测CSFV的首要选择。
采集的病料不加防腐剂、置低温环境(冰盒)中,尽快送到实验室检。Weesendorp[27]的研究表明,不具备低温运输条件时,扁桃体和脾脏比肾脏、肠系膜淋巴结更合适。
精液稍显特殊,其中含有较多的蛋白,因此需要一些前处理:将其与 PBS(0.01 mol/L,pH 7.4)按1:9混合均匀,反复冻融3次破坏其蛋白成分,4 ℃ 12 000 r /min离心10 min,弃蛋白沉淀。取上清 500 µL,加入800 µL Trizol后按常规方法提取RNA,其中氯仿抽提需 2次,尽量将精液中的剩余蛋白去除干净。
随着技术的发展,不断产生了针对CSFV的新的RT-PCR检测方法,在使用不同的检测方法时,不同的反转录酶和反转录随机引物对敏感度可能有一定的影响,需要引起注意。
6 展望
猪瘟作为国家非常重视的一类动物疫病,疫苗的应用非常普遍,一般情况下,肉猪需要免疫两次。据报道,国内使用的猪瘟疫苗免疫一次后在猪血液和扁桃体中的猪瘟病毒核酸检出时间(荧光定量法)分别达28天和42天,因此建立的CSFV通用型RTPCR检测方法对于未免疫生猪猪瘟病的确诊完全没有问题,但是对于免疫后发病猪的检测,需要使用鉴别RT-PCR或者配合发病前后的抗体检测才能进行猪瘟确诊。
猪瘟检测的趋势是自动化和快速并最好同时能够区分野毒和疫苗株,在本文列举的方法中,多重荧光定量方法将是未来研究和应用的主流。
[1] Chen N,Tong C,Li D,et al.Antigenic analysis of classical swine fever virus E2 glycoprotein using pig antibodies identi fi es residues contributing to antigenic variation of the vaccine C-strain and group 2 strains circulating in China[J].Virol J,2010,7(1):378.
[2] Huang Y L,Pang V F,Pan C H,et al.Development of a reverse transcription multiplex real-time PCR for the detection and genotyping of classical swine fever virus[J]. J Virol Methods,2009,160(1/2):111-118.
[3] 乔军,陈创夫,高丰.用RT-PCR 法对猪瘟病毒检测的研究[J].塔里木农垦大学学报,2001,13(4):25-27.
[4] 王云龙,刘建营,韩洁,等.猪瘟病毒荧光定量PCR检测方法的建立[J].动物医学进展,2009,30(5): 36-40.
[5] 任夫波 张志,张丽丽,等.猪瘟病毒荧光定量RT-PCR 检测方法的建立[J].动物医学进展,2011,32(5) : 82-85.
[6] Dong X N,Chen Y H.Mar k er vaccine strategies and candidate CSFV mar k er vaccines[J].Vaccine,2007,25 (2): 205-230.
[7] 董浩,李菲,王鑫,等.猪瘟病毒野毒株与疫苗株酶切检测方法的建立、优化及应用[J].中国畜牧兽医,2011,38(9):187-189.
[8] 俞伏松,车勇良,江斌,等.RT-PCR和免疫荧光抗体试验检测猪瘟病毒的比较研究[J].福建农业学报,2007,22(3) :231-234.
[9] 焦莉,崔玉东,王春明,等.一步法RT-PCR快速检测猪瘟病毒[J].黑龙江八一农垦大学学报,2006(1):57-60.
[10] 吴鑫,王军,张以芳.猪瘟病毒一步法RT-PCR 检测方法的建立[J].中国畜牧兽医,2008 ,35(2):64-66.
[11] 朱小甫,张志,李晓成,等.猪瘟病毒RT-nested PCR 检测方法的优化和应用[J].西北农林科技大学学报(自然科学版) ,2007,35(6):11-35.
[12] 刘辉,熊金凤,邹浩勇,等.猪瘟病毒、猪繁殖与呼吸障碍综合征病毒和乙型脑炎病毒多重RT-PCR 检测方法的建立[J].华中农业大学学报,2008,27(1):12-18.
[13] 薛媛,杨柳絮,张淼涛.猪瘟病毒与猪流行性乙型脑炎病毒复合RT-PCR检测方法的建立[J].西北农业学报,2009,18(3):14-17.
[14] 刘杉杉,赵亚荣,胡峰,等.猪捷申病毒、猪瘟病毒和猪繁殖与呼吸综合征病毒的多重 RT- PCR 检测方法的建立及应用[J].中国预防兽医学报,2011,33 (9): 704-708.
[15] Díaz de A H,Pérez L J,Frías M T,et al.A multiplex RT-PCR assay for the rapid and differential diagnosis of classical swine fever and other pestivirus infections[J].Vet Microbiol,2009,139(3/4):245-252.
[16] Jiang Y,Shang H,Xu H,et al.Simultaneous detection of porcine circovirus type 2,classical swine fever virus,porcine parvovirus and porcine reproductive and respiratory syndrome virus in pigs by multiplex polymerase chain reaction[J].Vet J,2010,183(2):172-175.
[17] Xu X G,Chen G D,Huang Y,et al.Development of multiplex PCR for simultaneous detection of six swine DNA and RNA viruses[J].J Virol Methods,2012,183(1):69-74.
[18] Pérez L J,Díaz de Arce H,Tarradas J,et al.Development and validation of a novel SYBR Green real-time RT-PCR assay for the detection of classical swine fever virus evaluated on different realtime PCR platforms[J].J Virol Methods,2011,174(1/2):53-59.
[19] 李军,潘艳,禤雄标,等.猪瘟病毒实时荧光定量RT-PCR检测方法的建立和初步应用[J].中国畜牧兽医,2011,38(3):116-119.
[20] 袁雪梅,陈宁,陈宇,等.两种荧光定量PCR方法检测猪瘟病毒的比较及应用[J].中国动物传染病学报,2010,18(3): 66-72.
[21] 刘大伟,张小飞,胡来根,等.猪瘟兔化弱毒疫苗株TaqMan荧光定量RT-PCR检测方法的建立及初步应用[J].中国预防兽医学报,2010,32(6):446-450.
[22] Wen G,Yang J,Luo Q,et al.A one-step real-time reverse transcription-polymerase chain reaction detection of classical swine fever virus using a minor groove binding probe[J].Vet Res Commun,2010,34(4):359-369.
[23] 牛伟,丁壮,王晓莉,等.实时荧光定量PCR方法检测猪繁殖与呼吸综合征病毒和猪瘟病毒[J].中国兽医学报,2011,31(2):174-177.
[24] Cheng D,Zhao J J,Li N,et al.Simultaneous detection of classical swine fever virus and North American genotype porcine reproductive and respiratory syndrome virus using a duplex realtime RT-PCR[J].J Virol Methods,2008,151(2):194-199.
[25] Liu J,Fan X Z,Wang Q,et al.Dynamic distribution and tissue tropism of classical swine fever virus in experimentally infected pigs[J].Virol J,2011(8):201.
[26] Donahue B C,Petrowski H M,Melkonian K,et al.Analysis of clinical samples for early detection of classical swine fever during infection with low,moderate,and highly virulent strains in relation to the onset of clinical signs[J].J Virol Methods,2012,179(1):108-115.
[27] Weesendorp E,Loeffen W,Stegeman A,et al.Time-dependent infection probability of classical swine fever via excretions and secretions[J].Prev Vet Med,2011,98(2/3):152-164.

