中国华南、华中、东北和西北地区马动脉炎病毒(EAV)感染马血清流行病学调查
李红梅 ,侯玉杰 ,,时成龙 , ,郭 巍 ,胡 兰 ,赵立平 ,相文华
(1.中国农业科学院 哈尔滨兽医研究所,兽医生物技术国家重点实验室/马病研究中心,黑龙江哈尔滨 150001;2.沈阳农业大学 畜牧兽医学院,辽宁沈阳 110161)
马病毒性动脉炎(equine viral arteritis,EVA)是由马动脉炎病毒(equine arteritis virus,EAV)引起的马属动物呼吸和生殖系统病毒性传染病。该病在马属动物之间通过呼吸道或生殖器官传播。其临床特征是病马发热,步态僵直,躯干及眼周围水肿,出现粘液-脓性鼻炎,外生殖道水肿,妊娠马流产[1]。
目前,在EAV血清抗体检测上,主要有间接免疫荧光(IFA)、免疫过氧化物酶单层试验(IPMA)、中和试验(SN)和多种酶联免疫吸附试验(ELISA),其中 ELISA 是最为常用的方法[1-2,6,9]。
中国未有检测EAV的诊断试剂,在国际贸易上主要采用国外诊断试剂盒进行检验检疫,至于在役用马检测或监测上,我国未见有报道。为此,本试验建立以纯化EAV全病毒为抗原EAV-IgG间接ELISA方法,与西班牙INGEZIM-ARTERITIS试剂盒进行比对试验,以求建立我国的EAV的诊断方法。
1 材料与方法
1.1 样本 383份马血清,其中华中赛马41份,西北役用马106份,华南赛马127份和东北役用马109份。抽检马为临床健康,无EAV疫苗免疫历史的马,其自然状况信息见表3、表4。血清样本制备,采用静脉采血,37 ℃孵育1 h,4 ℃过夜,收集血清。
1.2 检测试剂 EAV-IgG间接ELISA试验(本试验建立)和西班牙INGENASA公司的INGEZIM-ARTERITIS试剂盒,EAV标准阳性、阴性血清均由本实验室保存。
1.3 主要试剂 可拆卸酶标板,购自加拿大JET公司;Anti-horse IgG购自Sigma公司。
1.4 EAV-IgG间接ELISA试验
1.4.1 病毒株 EAV Bucyrus株(云南热带和亚热带动物病毒病实验室张念祖教授惠赠)。
1.4.2 抗原制备 EAV Bucyrus株接种于已长成单层的RK-13细胞,吸附30 min后用含2%血清的MEM维持液于37 ℃,5% CO2条件下培养。48 h后,当出现75%以上细胞病变(CPE)时收获病毒,反复冻融3次后收集细胞液4 000 r/min 粗离 30 min收集上清,至透析袋加入PEG6000浓缩至50~60 mL,130 000 g超离3 h 、弃上清,收集沉淀,蔗糖梯度离心,130 000 g超离 3 h(20%、40%、60%)收集夹层,脱糖130 000 g超离 3 h(所有离心均在4 ℃下)。BCA法测定病毒蛋白含量。
1.4.3 应用自制EAV-IgG间接ELISA方法检测血清样本 操作步骤:将待检血清样品1:100稀释后加入以0.1 ug/孔病毒包被的酶标板内(1 ug/mL,100 uL/孔),37 ℃孵育1 h后,洗板3次(3 min/次),加二抗37 ℃孵育40 min~1 h(100 uL/孔),洗板3次(3 min/次),底物显色液作用15 min后(100 uL/孔),加入2 mL H2SO4终止反应(50 uL/孔)。490 nm条件下读数。判定标准:OD值若大于规定的阴性对照OD值的2倍,且被检血清的OD值在0.2以上者,即为阳性。
1.5 进口西班牙INGENASA公司的INGEZIM-ARTERITIS试剂盒检测2009年中国华南、华中、西北和东北赛马和役用马的血清样本,按试剂盒中说明操作。
2 结果
2.1 自制EAV-IgG间接ELISA试验结果(表1)。
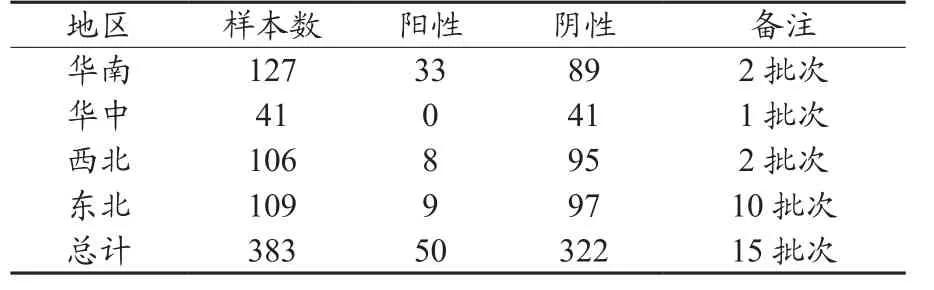
表1 利用自制EAV-IgG间接ELISA试验检测2009年我国部分地区EAV抗体分布
应用自制EAV-IgG间接ELISA试剂盒检测2009年中国华南、华中、西北和东北EAV抗体分布。从华南、华中、东北和西北4个地区共收集马血清样本383份。阳性样本总数为50份。其中华南赛马血清样本数为127份,阳性数为33份;华中赛马血清样本数为41份,阳性数为0;西北役用马血清样本数为106份,阳性数为8;东北役用马血清样本数为109份,阳性数为9(表1)。上述结果证实华南赛马、东北和西北地区役用马感染EAV,华中赛马没有感染EAV,华南赛马阳性数比西北和东北役用马高约3倍。
2.2 西班牙INGEZIM-ARTERITIS试剂盒检测结果(表2 )。

表2 西班牙INGEZIM-ARTERITIS试剂盒检测2009年我国部分地区EAV抗体分布
应用西班牙商品化诊断试剂盒检测2009年我国华南、华中、西北和东北EAV抗体分布。阳性样本总数为40。其中,华南赛马血清样本阳性数为34;华中赛马血清样本阳性数为0;西北役用马阳性数为2;东北役用马阳性数为4(表2)。上述结果证实华南赛马、东北和西北地区役用马感染EAV,华中赛马没有感染EAV。华南赛马阳性数比西北和东北役用马高约17倍和8倍。
2.3 两种试剂盒比对结果
本试验自制EAV-IgG间接ELISA试剂盒与西班牙INGEZIM-ARTERITIS试剂盒对中国华南、华中、西北和东北地区赛马和役用马血清样本检测的比对结果(表3,4)。

表 3 自制试剂盒与西班牙INGEZIM-ARTERITIS试剂盒对华中和华南地区赛马血清样本检测的比对结果

表 4 自制试剂盒与西班牙INGEZIM-ARTERITIS试剂盒对西北和东北地区赛马血清样本检测的比对结果
自制与西班牙商品化试剂盒检测华南和华中地区赛马的比对结果相符合。华南地区赛马EAV抗体阳性率为26%(26.77%),华中地区赛马EAV抗体阳性率为0(0)。说明两者一致证实华南赛马有感染EAV,华中地区赛马没有感染EAV(表3)。自制与商品化试剂盒检测东北和西北地区赛马的比对结果不完全相符。东北地区役用马EAV抗体阳性率为8.26%(3.67%),西北地区役用马阳性率为7.55%(1.89%)。东北和西北地区役用马阳性血清样本结果比进口商品化试剂盒检测结果分别高2.25倍和4倍,可能有假阳性结果存在。上述结果表明,东北和西北地区役用马也有感染EAV(表3),其感染率明显低于华南地区赛马(表3,4)。
两种试剂盒检测结果一致证实我国部分地区赛马和役用马感染EAV。华南地区赛马阳性血清样本数(率)在4个地区中最高,东北和西北地区役用马阳性血清样本数(率)居中,华中地区EAV抗体阳性血清样本数(率)为0(表3,4)。华南地区赛马EAV抗体阳性率明显高于东北和西北地区役用马。华南赛马、东北和西北役用马均不同程度感染了EAV,华中地区赛马没有感染EAV。
3 讨论
本试验结果证实,我国华南地区赛马、东北和西北地区赛马和役用马感染EAV。赛马和役用马对EAV易感性强弱或许与其品种和来源有关[15]。华南地区赛马为欧洲温血纯种马,进口自EAV流行相对普遍的欧洲[3,5,7-8],本品种马较其他品种马对EAV更为易感[12,14]。华中、东北和西北地区役用马为本地品种和杂交品种(本地品种与进口苏联的苏高血马品种杂交)引进自新疆和内蒙古(通辽)。目前,在通辽地区没有监测到EAV阳性抗体。西北和东北地区役用马EAV抗体阳性率相近,明显低于华南赛马,可能与进口自苏联的苏高血马品种有关。而华中地区赛马没有感染EAV,可能与其引进自内蒙古(通辽)有关。地区间引进马品种和来源不同决定不同地区间EAV分布不同。华南地区进口欧洲、我国香港和澳门地区的赛马,华中、西北和东北地区引进我国新疆和内蒙古的马。
两种试剂盒检测EAV的比对结果证实我国部分地区赛马和役用马感染EAV,华南地区赛马EAV感染率最高,东北和西北地区役用马次之,华中地区赛马没有感染EAV。
自制试剂盒适用于EAV血清流行病学调查。
本试验结果显示,自制试剂盒检测结果有一定假阳性,这就要求我们进一步的试验中需要改进方式,保证自制试剂盒检测结果。
[1] Hedges J F,Balasuriya U B R,Ahmad S,et al.Detection of antibodies to equine arteritis virus by enzyme lin k ed immunosorbant assays utilizing GL,M and N proteins expressed from recombinant baculoviruses[J].Journal of Virological Methods,1998(76):127-137.
[2] Ta k ashi Kondo,Yoshio Fu k unaga,Kiichi Se k iguchi,et al.Enzyme-Lin k ed Immunosorbent Assay for Serological Survey of Equine Arteritis Virus in Racehorses[J].Journal of Veterianry Medicine Science,1998,60(9):1043-1045.
[3] Levente Szeredi,Ák os Hornyák,Vilmos Pálfi,et al.Study on the epidemiology of equine arteritis virus infection with different diagnostic techniques by investigating 96 cases of equine abortion in Hungary [J].Veterinary Microbiology,2005,108(3/4):235-242.
[4] World Organization for Animal Health(OIE).Equine Viral Arteritis[M]//Manual of Diagnostic Tests and Vaccines for Terrestrial Animals.6th.Paris,French: World Organization for Animal Health(OIE),2008.
[5] Zhang J,Miszcza k F,Pronost S,et al.Genetic variation and phylogenetic analysis of 22 French isolates of equine arteritis virus[J].Arch Virol,2007,152(11):1977-1994.
[6] 梁成珠.马病毒性动脉炎新型快速分子检测技术研究与应用[D].南京:南京农业大学,2006:54-60.
[7] Hornya´k Á,Ba k onyi T,Te k es G,et al.A Novel Subgroup among Genotypes of Equine Arteritis Virus: Genetic Comparison of 40 Strains [J].J Vet Med B,2005,52(3):112-118.
[8] Magdalena Lars k a,Rola J.Molecular epizootiology of equine arteritis virus isolates from Poland [J].Veterinary Microbiology,2008,127(3/4):392-398.
[9] Chirnside E D,Francis P M,de Vries A A F,et al.Development and evaluation of an ELISA using recombinant fusion protein to detect the presence of host antibody to equine arteritis virus [J].Journal of Virological Methods,1995,54(1):1-13.
[10] Holyoa k G R,Balasuriya U B R,Broaddus C C,et al.Equine viral arteritis:Current status and prevention [J].Theriogenology,2008,70(3):403-414.
[11] 洪健,周雪平.ICTV第八次报告的最新病毒分类系统[J].中国病毒学,2006,21(1):84-96.
[12] Balasuriya U B R,MacLachlan N J.The immune response to equine arteritis virus:Potential lessons for other arterivirve[J].Veterinary Immunology and Immunopathology,2004,102(3):107-129.
[13] 梁成珠.马病毒性动脉炎[J].中国进出境动植检,1996(1):40-42.
[14] Fu k unaga Y,Wada R,Matsumura T,et al.An attempt to protect against persistent infection of equine viral arteritis in the reproductive tract of stallions using formalin inactivated-virus vaccine[C] //Proceedings of the Sixth International Conference on Equine Infectious Diseases.Cambridge,UK,1991:239-244.
[15] Go Y Y,Bailey E,Coo k D G,et al.Genome-wide association study among four horse breeds identifies a common haplotype associated with in vitro CD3+ T cell susceptibility/resistance to equine arteritis virus infection[J]. J Virol,2011,85(24):13174-13184.

