小鼠胃内消化对胰蛋白酶抑制剂活性影响的初步研究
关 萍,于业辉,王 惠,张 梅,张立军*
(1.沈阳农业大学生物科学技术学院,辽宁沈阳110866;2.沈阳农业大学畜牧兽医学院,辽宁沈阳110866)
植物的胰蛋白酶抑制剂(trypsin inhibitor,TI)是对胰蛋白酶(trypsin,TP)具有抑制作用的一类多肽类物质,它对植物本身具有保护作用,可防止植物籽粒自身发生分解代谢,使种子处于休眠状态,能调节植物蛋白质的合成与分解等[1]。近年来,TI成为科学研究的热点,主要原因为前些年受到普遍关注的TI抗虫效应和近些年TI对高等动物和人类的治病与致病的双重效应:①TI的抗虫效应。TI能显著抑制昆虫的生长发育,可诱导中肠TP活力的增高,使正常消化过程蛋白酶间的协调性破坏,导致昆虫生长发育受阻[2],利用TI基因进行抗虫转基因植物育种已被证明是一种行之有效的方法[3-4];②TI的临床应用。利用TI治疗急性胰腺炎[5],应用于外科手术的促凝血作用[6],TI的抗肿瘤作用[7]等;③TI的过量摄入对高等动物和人类的危害。TI可引起胰腺增生,TP过量分泌,导致消化不良、生长停滞,甚至危及生命[8]。这3个研究方面的既独立又相关。转TI抗虫基因必然会造成TI的过量表达,如果这种植物是高等动物或人类的主要食物来源,过量表达的TI摄入动物机体后,能否对机体造成有害影响?Hilder V A等[9]报道,昆虫消化系统的结构和功能均与高等动物有所不同,随食物进入高等动物胃内的TI会在胃蛋白酶和胃酸的作用下被分解而完全失活,因此不会影响动物体的正常生理过程,但该结论缺乏详细的试验研究。Feng G H等[10]报道,TI的适量摄入对机体无害而有益,但这种结论过于笼统,TI对高等动物治病还是致病,与动物的机能状态和摄入剂量密切相关,不能一概而论。可以肯定的是,对于正常高等动物,机体内过量存在的TI会对正常新陈代谢活动产生严重影响,值得探讨的是TI在随食物摄入动物体,通过胃内消化在胃蛋白酶和胃酸作用下分解和活性保持程度如何?本研究的目的在于解决这个问题,详细研究高等动物随食物摄入不同剂量的TI,在胃蛋白酶和胃酸作用下,TI活性的变化及对动物体主要消化道和消化腺TP活性和分泌的影响。分析高等动物消化系统对TI的分解程度,试图建立TI的摄入剂量与TP活性的关系,从而为寻求TI的安全剂量、TI的临床应用、作用机理分析等相关研究提供科学数据。
1 材料与方法
1.1 材料
1.1.1 实验动物 2月龄昆明种SPF级小鼠160只,购自中国医科大学实验动物中心,体重33g左右,性别随机,按雌雄分笼饲养。
1.1.2 试剂 胰蛋白酶抑制剂为沈阳大东银河鑫试剂公司产品;小鼠胰蛋白酶ELISA检测试剂盒为上海沪峰试剂公司产品;氯化钠为市售。
1.1.3 仪器与用具 酶标仪,高速离心机,组织匀浆器,微量取样器,电子天平,小鼠灌胃器等,由沈阳农业大学生物科学技术学院专业实验室和畜牧兽医学院动物医学实验室提供。
1.2 方法
1.2.1 实验动物的常规培养 培养地点为沈阳农业大学实验主楼动物饲养室,昼夜室温14℃~22℃,饲养室保证阳光充足但不曝晒,空气流通性良好,室内湿度保持在50%~70%,每笼小鼠数量不超过4只,每隔24h添加更换一次食物和饮用水,每隔24h更换一次垫料,每隔48h消毒饲养室地面。
1.2.2 试验分组和给药方法 试验开始前将小鼠随机分配为8组,每组20只,对照组(急性试验)~高剂量TI组(急性试验)用于试验1.2.3,以下简称为对照组(AE)~高剂量TI组(AE)。
对照组(AE)(生理盐水组),实验动物进食进水后0.5h左右,每只试验动物通过灌胃途径给予生理盐水0.1mL(以下给药方法同对照组)。低剂量TI组(AE):给予7.5×10-3mg/mL TI 0.1mL;中剂量TI组(AE):给予2.25×10-2mg/mL TI 0.1 mL;高剂量TI组(AE):给予3.75×10-2mg/mL TI 0.1mL。
对照组(慢性试验)~高剂量TI组(慢性试验)用于试验1.2.4,以下简称为对照组(CE)~高剂量TI组(CE):
对照组(CE)(生理盐水组):实验动物每日固定时间进食进水后1h左右,每只试验动物通过灌胃途径给予生理盐水0.1mL(以下给药方法同对照组(CE))。低剂量TI组(CE):给予7.5×10-3mg/mL TI 0.1mL;中剂量 TI组(CE):给予2.25×10-2mg/mL TI 0.1mL;高剂量 TI组(CE):给予3.75×10-2mg/mL TI 0.1mL。
1.2.3 急性试验 通过测定TP活性反映一个胃排空周期胃内消化对TI分解程度,将对照组(AE)~高剂量TI组(AE)实验动物按照1.2.1方法正常培养7d后,试验前1d晚22时后停止供食,试验当天6:00左右恢复供食供水,观察试验动物进食进水情况,正常进食进水后撤去剩余食物和水0.5h后按照1.2.2方法给药,给药4h后将试验小鼠脱臼法处死,迅速取其十二指肠段。组织称重后备用(十二指肠段禁止反复冲洗以保存肠腔内容物)。根据所取组织重量加入适量生理盐水,用匀浆器制成100 g/L组织匀浆,高速离心机9 000r/min离心10 min,取上清液备用。
应用小鼠胰蛋白酶ELISA检测试剂盒,按照说明书步骤操作:配制TP标准品,测量标准品OD值,绘制标准曲线,列出标准曲线的回归方程。测量4组每只小鼠十二指肠TP的OD值,计算酶含量。
1.2.4 慢性试验 未分解TI对胰腺TP活性及分泌影响,将对照组(CE)~高剂量TI组(CE)组实验动物按照1.2.1方法正常培养7d后,开始给药前编号并称量体重,按1.2.2方法给药。培养28d后,停止供食12h,停止供水6h,称量体重后脱臼法处死。迅速取其胰腺,组织匀浆制备和TP测量方法同1.2.3。
1.2.5 统计学处理 试验数据采用SPSS17.0软件进行统计学分析,分析结果以(±sD)表示,组间差异显著性采用单因素方差分析和多重比较(LSD和Games-Howell)。
2 结果
2.1 TI作用下小鼠体重变化
试验开始前为每只小鼠编号、称重,试验后处死前重新称重,计算试验前体重平均值、试验后体重平均值和体重增长平均值,结果见表1。

表1 TI对小鼠体重的影响Table 1 Effects of TI on body weight in mice
2.2 标准酶液OD值的测定和标准曲线的绘制
应用小鼠胰蛋白酶ELISA检测试剂盒,测定标准品OD值,绘制标准曲线,列出标准曲线的回归方程:y=0.001 6x-0.001 4(R2=0.991 5)(表2和图1)。

表2 胰蛋白酶标准品含量和OD值的关系Table 2 The relationship between trypsin standard content and OD value

图1 胰蛋白酶标准曲线Fig.1 trypsin standard curve
2.3 TI作用下小鼠十二指肠内容物及肠壁内TP活性影响
应用小鼠胰蛋白酶ELISA检测试剂盒,测量对照组(AE)~高剂量TI组(AE)每个样品十二指肠TP OD值,根据回归方程计算酶活性(表3)。
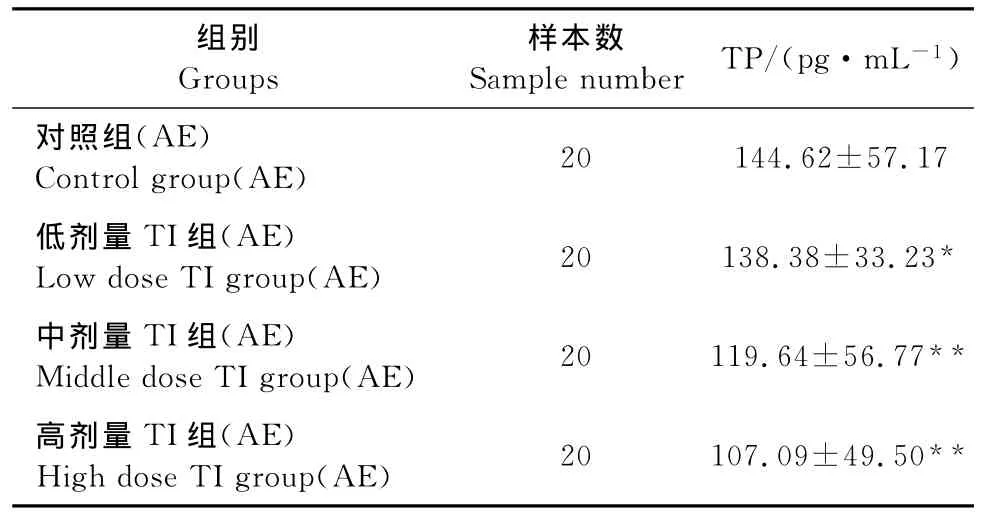
表3 TI对十二指肠内容物和肠腺TP活性的影响Table 3 Effects of TI on duodenal contents and midgut gland TP in mice
2.4 TI作用下胰腺TP活性和分泌变化
应用小鼠胰蛋白酶ELISA检测试剂盒,测定对照组(CE)~高剂量TI组(CE)每个样品胰腺TP OD值,根据回归方程计算酶活性(表4)。

表4 TI对胰腺TP活性的影响Table 4 Effects of TI on pancreas TP in mice
3 讨论
由表1分析可知,对照组(CE)小鼠试验前后体重增加1.6g±0.34g,低剂量TI组(CE)体重下降0.26g±2.24g,中剂量TI组(CE)下降0.69g±2.61g,高剂量TI组(CE)增加0.06g±4.78g。相对于对照组(CE),低、中、高剂量 TI组(CE)3组体重下降值差异显著(P<0.05)。体重可作为动物在一定时期新陈代谢活动是否正常的初步判定指标,因此不同剂量TI的摄入可初步判定均对试验动物的生理活动产生了负面影响导致体重增加下降,这与研究报道是一致的[8]。由表3分析可知,十二指肠内容物及肠腺中TP活性对照组(AE)为144.62 pg/mL±57.17pg/mL,低剂量 TI组 (AE)为138.38pg/mL±33.23pg/mL,中剂量TI组(AE)为119.64pg/mL±56.77pg/mL,高剂量 TI组(AE)为107.09pg/mL±49.50pg/mL。相对于对照组(AE),低剂量 TI组(AE)显著下降(P<0.05),中、高剂量 TI组(AE)极显著下降 (P<0.01),TI剂量与IP活性呈正相关性。可以得出的结论是,在一个胃排空周期内不同剂量的TI均未被胃内消化完全分解并不同程度的抑制了TP活性,这与Hilder V A的研究报道不同[9]。由表4分析可知,由于TI的长期过量作用,胰腺TP活性和分泌量发生了显著或极显著变化,这种变化与给药剂量不呈正相关性。对照组(CE)为342.12pg/mL±35.80pg/mL,低剂量 TI组(CE)为 279.86 pg/mL±10.72pg/mL,中剂量 TI组为 (CE)391.32pg/mL±21.93pg/mL,高剂量 TI组为(CE)360.10pg/mL±22.56pg/mL,低剂量 TI组(CE)TP活性极显著低于对照组(CE)(P<0.01),中剂量TI组(CE)极显著高于对照组(CE)(P<0.01)而高剂量TI组(CE)的IP含量则显著高于对照组(CE)(P<0.05)。这种结果的产生是由于,一方面TI可直接抑制消化系统中的TP活性,另一方面TI可直接作用于胰腺导致TP的过量分泌,表4显示的TP活性为这两种作用的协同效应[11]。中、高剂量TI组(CE)均表现为刺激分泌效应大于抑制作用,而低剂量TI组(CE)则表现为抑制作用占优势。TP作为高等动物消化过程中发挥主要作用的消化酶[12],TP含量发生显著的变化势必会对消化过程产生负面影响,因此仍具有部分活性的TI直接影响了高等动物体的消化过程进而影响到整体新陈代谢是显而易见的。
本研究通过不同剂量TI在一个胃排空周期对消化系统中TP活性的急性作用和一个繁殖周期的慢性作用,总结出通过摄食途径进入高等动物体的TI对TP活性和分泌的影响及动物机体的整体影响,为目前开展关于TI的相关研究(转TI抗虫基因植物对高高动物消化能力的影响、TI的临床治疗使用剂量及给药途径等)提供了理论依据,但本文仅提供了初步研究结果,TI摄入后的降解过程、TI的摄入剂量与动物致病性的关系及TI对机体作用的机理分析等还需深入研究和探讨。
[1] 徐文静,李莉云,史佳楠,等.Bowman-Brik胰蛋白酶抑制剂在水稻叶片生长和种子萌发过程中的表达[J].农业生物技术学报,2012(3):246-253.
[2] Ryan C A.Proteinase inhibitors in plants,genes for improving defenses against insects and pathogens[J].Annu Rev Phytopathol,1990(28):425-449.
[3] Hilder V A,Gatehouse A M R,Sheerman S E,et al.A novel mechanism of insect resistance engineered into tobacco [J].Nature,1987(330):160-163.
[4] Xu D P,Xue Q Z,Mcelroy D,et al.Constitutive expression of a cowpea trypsin inhibitor gene CpTI in transgenic rice plants confers resistance to two major rice insect pests[J].Mol Breeding,1996(2):167-172.
[5] Lanza A,Tava A,Catalano M,et al.Effects of the Medicago scutellatatrypsin inhibitor(MsTI)on cisplatin-induced cytotoxicity in human breast and cervical cancer cells[J].Anticancer Res,2004(1):227-233.
[6] 李 健,王志农,纪广玉,等.尿胰蛋白酶抑制剂对体外循环心脏手术患者血浆内毒素水平及全身炎性反应的影响[J].解放军医学杂志,2009(8):1005-1008.
[7] 杨莉莉,贺巾超,董 文,等.重组牛胰蛋白酶抑制剂对大鼠胰腺炎的治疗作用[J].中国药师,2008(4):375-377.
[8] 丁安林,王 雁,常汝镇.大豆的抗营养因子及其改良[J].大豆科学,1994(1):72-76.
[9] Hilder V A,Gatehoues A M R,Boulter D.Transgenic plants conferring insect tolerance:proteinase inhibitor approach[C].In:Kung S D,Wu R,eds.Transgenic Plants[A ].New York:Academic Press,1993:317-338.
[10] Feng G H,Richardson M,Chen M S,et al.α-Amylase inhibitors from wheat a sequences and patterns of inhibition of insect and human anα-Amylases[J].Insect Biochem Mol Biol,1996(26):419-426.
[11] 陈少夫,山本光勝,大槻眞.蛋白酶抑制剂ONO-3403对胰泌素刺激的大鼠胰腺外分泌的影响[J].世界华人消化杂志,2002(7):792-795.
[12] 张英杰,刘月琴,孙洪新,等.羔羊小肠pH及主要消化酶发育规律的研究[J].畜牧兽医学报,2005(2):149-152.

