动脉灌注化疗治疗32例恶性梗阻性黄疸患者的临床分析*
张 展,张 盛,刘爱民
(1.重庆市医药卫生学校内科教研室 408100;2.重庆市涪陵中心医院消化内科 408000)
恶性梗阻性黄疸常由肝外胆道肿瘤和胰腺肿瘤等引起,发现时多已属于晚期,行外科根治术的可能性小。近年来,经皮经肝穿刺胆道引流术(percutaneous transhepatic cholangial drainage,PTCD)和胆道内支架置入术(percutaneous transhepatic insertion of biliary stent,PTIBS)已成为对该病姑息治疗的一种常用方法[1],此方法只能缓解黄疸及其伴随症状,并无治疗作用[2]。作者在B超引导下经皮经肝穿刺置入胆道支架,约1周后置入化疗泵,定期进行动脉灌注化疗,取得较好的疗效,现报道如下。
1 资料与方法
1.1 一般资料 2004年6月至2009年12月,因恶性梗阻性黄疸在涪陵中心医院置入胆道支架后,埋入化疗泵,定期进行动脉灌注化疗患者32例。其中,男26例,女6例;年龄48~76岁,平均60.7岁;胆管癌13例,胰腺癌19例;术前血清总胆红素(TB)为(436.56±178.17)μmol/L,丙氨酸氨基转移酶(ALT)为(158±54)IU/L,碱性磷酸酶(AKP)为(754.65±343.57)IU/L。以上病例诊断均经彩色超声、CT、磁共振胆管造影(MRCP)和血液生化检查证实。入选条件为:经肝胆外科医师会诊失去手术指针或不愿意行手术者。排除标准:有凝血功能障碍、心肺功能衰竭、一般情况差不能耐受手术者。
1.2 方法
1.2.1 手术材料 南京微创医学科技有限公司生产的MTN型记忆钛镍合金胆道支架,直径6、8、10mm,长度40~100 mm;德国贝朗公司生产的化疗泵;美国Cook公司胆道穿刺套件(21G千叶针、0.018in铂金微导丝、5F三件套扩张管、9F扩张管、0.035in加强导丝、8F内外引流管、外用固定装置),0.035in超滑导丝、Amplaz超硬导丝、5FCobra导管等。
1.2.2 胆道支架置入 在B超引导下用21G千叶针经皮肝穿行PTC,了解胆道梗阻情况。经肝穿刺针引入0.018in铂金微导丝,送入5F三件套扩张管,利用5FCobra导管和导丝配合将0.035in超滑导丝通过狭窄部进入十二指肠,将Amplaz超硬导丝送入肠腔,沿超硬导丝送入球囊导管,扩张狭窄段。撤出球囊,沿导丝送入胆内支架输送器及胆道支架,准确定位释放,并注入造影剂了解胆道通畅情况,最后放置内外引流管。若第1次导丝不能通过狭窄段,就先行外引流,数日后行支架置入。
1.2.3 动脉灌注化疗 在胆道支架置入后引流约1周,患者黄疸基本消退后置入化疗泵。在透视下将化疗泵导管送至胃十二指肠动脉或肠系膜上动脉胰腺分支,化疗泵埋入左胸前壁(经锁骨下动脉)或右下腹壁(经股动脉),术后每2周向化疗泵内注入少量肝素钠,以保持化疗泵通畅。定期用卡铂400mg、5-氟尿嘧啶500mg和丝裂霉素20mg进行灌注化疗。开始21 d为1个周期,6个周期后可以适当延长时间。
1.3 统计学处理 采用SPSS13.0统计软件分析数据,计量资料以表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 胆道支架置入情况 32例患者,单纯内支架置入11例,内外引流管配合内支架置入21例;一步直接置入支架26例,先行外引流3~7d后置入内支架6例;共置入支架34枚,其中2例肝门部胆管癌患者分别置入2枚支架。支架置入成功率100%。1例术后出现右季肋部包块,活检证实为腺癌;1例患者外引流管掉出,行第2次穿刺后成功;其余患者未出现胆道出血、胆汁性胸腹膜炎、肝脏破裂、感染、动脉穿刺血肿等手术相关并发症。
2.2 化疗泵定期化疗情况 1例患者仅接受1个周期化疗,因严重的化疗反应而终止;1例患者进行3个周期化疗后失访;30例患者接受化疗1~15个周期。10例患者化疗出现了不同程度的白细胞降低,所有患者均有与化疗相关的不良反应(如乏力、纳差、恶心、呕吐等),均经对症治疗后得以缓解。绝大多患者都有较好的依从性。
2.3 肝功能检测指标变化 胆道引流前、术后1~2周、术后1个月检测TB、ALT、AKP,见表1。
表1 胆道引流术前后肝功能检测结果比较()
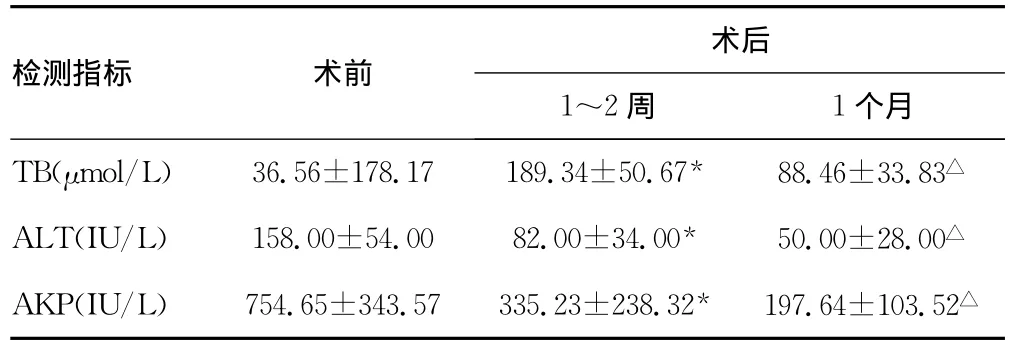
表1 胆道引流术前后肝功能检测结果比较()
*:P<0.05,与术前比较;△:P<0.05,与术后1~2周比较。
检测指标 术前术后1~2周 1个月TB(μmol/L) 36.56±178.17189.34±50.67* 88.46±33.83△ALT(IU/L) 158.00±54.00 82.00±34.00* 50.00±28.00△AKP(IU/L) 754.65±343.57335.23±238.32* 197.64±103.52△
2.4 患者生存时间及支架通畅情况 32例患者生存时间5~28个月,平均16.3个月。其中6、12、24个月生存率分别为96.88%(31/32)、71.88%(23/32)、40.63%(13/32)。随访期胆道支架保持时间1~28个月,平均15.6个月,3、6、12个月支架通畅率分别为96.88%(31/32)、93.75%(30/32)、62.5%(20/32)。
3 讨 论
恶性梗阻性黄疸是由各种恶性肿瘤引起的不同部位胆管狭窄或闭塞,常见原因有胆管癌、胆囊癌、胰腺癌、壶腹癌和肝门部转移癌等[3-4]。这类肿瘤恶性程度高,大部分在确诊时已不能手术切除,其根治性切除率为10%~27%[5]。恶性梗阻性黄疸由于胆汁淤积,可导致特异性和非特异性细胞免疫功能损害;恶性梗阻的胆道高压,使肝细胞肿胀、功能受损;胆汁停止分泌,肝功能损害又会对其他脏器功能产生不利影响,引起一系列并发症[6]。常规剂量全身化疗、放射治疗疗效差,增加剂量后毒副作用加大,患者常不能耐受。在B超引导或数字减影血管造影(digital stub-tractcom angiography,DSA)监测下经皮肝穿刺胆道内支架置入,克服PTCD需长期接引流袋、大量胆汁丢失等不足,减小感染概率。穿刺时,胆道狭窄或闭塞导丝不能通过,不能强行通过,应行先外引流,梗阻黏稠的胆汁引流后,扩张的胆管回缩,胆管壁水肿消退,导丝导管穿越闭塞部位放置支架容易,又能够减小支架阻塞的发生概率[7]。必要时经1~2次动脉灌注化疗,肿瘤缩小,闭塞的通道再通后行支架置入获得成功[8]。
胆道支架置入后,患者TB、ALT水平下降,临床症状改善,及时对原发病灶进行积极治疗是延缓黄疸复发、延长患者生存期的关键[9]。恶性梗阻性黄疸支架置入后,支架堵塞率达20%~86%,堵塞的主要原因是肿瘤生长通过支架网眼或超过支架边缘引起[10-11]。曹广和杨仁杰[12]报道 PTCD 和支架置入术后的普遍生存期较短,术后3、6、9个月的生存率分别为79.1%、51.7%、26.8%。姜卫剑等[13]认为,恶性梗阻性黄疸患者PTCD和支架置入术后死亡的主要原因并不是再次梗阻,而是肿瘤的生长引起全身衰竭、感染、消化道出血、肝功能衰竭、多器官功能衰竭等并发症而死亡。就其原因是PTCD和支架置入对肿瘤本身没有治疗作用。胆管癌、胰腺癌等大多数是高分化腺癌,乏血供,血流慢,对常规全身化疗不敏感。实行区域灌注化疗,既保证肿瘤局部高浓度的有效抗癌药物,又使高浓度的抗癌药物较长时间发挥作用,最大限度提高治疗效果[14]。甑彦利等[15]报道,单纯行 PTCD和PTIBS减黄,1年生存率仅为5.7%,平均生存时间6.7个月。夏进东和王道梅[16]报道恶性梗阻性黄疸单纯全身化疗3、6、12个月生存率分别为58.2%、32.1%和15.0%。本研究行胆道支架置入引流,黄疸消退后,置入化疗泵,用卡铂、5-氟尿嘧啶和丝裂霉素等定期进行灌注化疗。本组32例患者生存时间明显高于文献报道的单纯PTCD/PTIBS减黄或单纯全身化疗。陈颐等[17]报道,PTIBS加动脉灌注化疗及栓塞28例,支架保持通畅时间1~71个月,平均15.3个月,随访期通畅率71.4%;张战利等[14]报道PTIBS加动脉灌注化疗及栓塞35例,随访10~24个月,6个月支架开通率85.71%,12个月支架开通率74.2%。本研究组随访期,胆道支架保持通畅时间1~28个月,平均15.6个月,3、6、12个月支架通畅率分别为96.88%(31/32)、93.75%(30/32)、62.5%(20/32),与文献报道相近。
综上所述,胆道支架置入结合化疗泵置入定期行区域灌注化疗治疗恶性梗阻性黄疸,有以下优点:(1)应用微创的方法解决梗阻性黄疸,手术创伤小,患者痛苦少,操作难度低,安全性大,适应范围广;(2)TB、ALT、AKP下降快,临床症状缓解快,支架保持通畅时间长,再阻塞发生率低,手术相关并发症少,生存质量提高;(3)生存时间延长[18]。作者认为,胆道支架置入联合动脉灌注化疗治疗恶性梗阻性黄疸是一种安全、有效的方法,能明显改善临床症状,延长患者生存时间,提高患者的生活质量。
[1]王建国,张坚,刘福忠,等.胆道支架植入加化疗灌注治疗恶性胆道梗阻[J].当代医学,2009,15(6):314.
[2]Shmizu F,Nakatsuji Y,Arai T,et a1.A case of recurrent gastric cancer with obstructive jaundice successfully treated by docetaxel[J].Gan To Kagaku Ryoho,2007,34(1):97-100.
[3]游洋.经皮肝穿胆道内外引流术治疗黄疸的初步评价[J].实用中医内科杂志,2011,25(3):53-55.
[4]Iizuka T,Hoshihara Y,Hoteya O,et al.A case of gastric cancer presenting with obstructive jaundice and responding to biweekly CPT-11and CDDP combination administration[J].Gan To Kagaku Ryoho,2006,33(5):659-661.
[5]Reed DN Jr,Vitale GC,Martin R,et a1.Bile duct carcinoma:trends in treatment in the nineties[J].Am Surg,2000,66(8):711.
[6]懂家鸿.曾永毅.梗阻性黄疸减黄研究热点与难点[J].中国实用外科杂志,2007,10(27):768-769.
[7]熊翔.B超引导下PTCD在恶性梗阻性黄疸姑息治疗中的应用[J].临床外科杂志,2008,16(12):854-855.
[8]王忠敏,贡桔,伍超贤,等.40例恶性梗阻性黄疸双介入治疗[J].中国肿瘤临床,2004,31(23):1366-1367.
[9]陈颐,颜志平,王建华,等.表阿霉素在恶性梗阻性黄疸治疗中的应用[J].中华肿瘤杂志,2006,28(5):397-399.
[10]Eschelman D J,Shapiro M J,Bonn J,et al.Malignant bilily duct obstruction:long-term experience with Gianturco stents and combined modality radiation therapy[J].Radiology,1996,200(3):717-724.
[11]高健,杜湘珂,金龙,等.自膨胀式支架在梗阻性黄疸治疗中的应用[J].中国医学影像技术,2002,18(5):419-421.
[12]曹广,杨仁杰.金属支架姑息治疗恶性梗阻性黄疸的术后随访及生存分析[J].北京大学学报,2008,40(2):121-124.
[13]姜卫剑,姚力,任安,等.经皮胆道内支架置入术姑息性治疗恶性梗阻性黄疸[J].中华放射学杂志,1997,31(10):729-733.
[14]张战利,张焱,张东超.恶性梗阻性黄疸双介入疗法的临床应用[J].临床肝胆病杂志,2004,20(5):289-290.
[15]甄彦利,马和平,张学军,等.恶性梗阻性黄疸的双介入治疗[J].内蒙古医学杂志,2006,38(3):211-212.
[16]夏进东,王道梅.恶性梗阻性黄疸双介入治疗18例临床分析[J].中国实用内科杂志,2001,21(2):113-114.
[17]陈颐,王小林,王建华,等.胆道支架置放结合动脉化疗栓塞治疗恶性梗阻性黄疸[J].复旦大学学报:医学科学版,2001,28(6):516-518.
[18]Polikarpov AA,Kozlov AV,Tarazov PG,el a1.Role of interventional radiography in the treatment of the hepatopancreato-duodenal area,complicated by obstructive jaundice[J].Vopr Onkol,2002,48(2):238-243.
——导丝概述及导丝通过病变技巧

