脱氢表雄酮对卵巢储备功能降低患者IVF-ET结果的影响
胡 蓉 宋学茹 岳天孚 白晓红 赵晓徽 吕 睿 张慧娟 王艳霞 江昌新
天津医科大学总医院生殖医学中心(300052)
卵巢储备功能降低(DOR)是辅助生殖技术的重大挑战之一,2010年一项包含45个国家196个生殖中心的调查显示 DOR患者正逐年增加[1]。DOR患者卵巢内可募集到的卵泡数目少,尽管临床上采取了一系列应对策略如增大促性腺激素(Gn)剂量、使用不同的降调节方案,却只能获得很少的卵母细胞和可供移植的胚胎,表现为卵巢低反应(POR),临床妊娠率低,周期取消率高。近年来国外研究发现脱氢表雄酮(DHEA)能够改善卵巢储备功能,提高妊娠率,减少染色体非整倍性,降低流产率[1]。本研究通过自身前后对照研究对47例DOR患者DHEA辅助治疗的临床效果进行观察和评价。
1 资料与方法
1.1 研究对象
选取2007年1月~2012年8月在本中心接受体外受精/卵胞浆内单精子注射(IVF/ICSI)治疗的DOR患者47例。入选标准:①有卵巢储备功能降低高危因素,如年龄≥35岁或单卵巢、卵巢手术史、卵巢低反应史(获卵数<5个);②卵巢储备功能检测指标异常,如双侧窦卵泡计数(AFC)<10个或基础卵泡刺激素(FSH)>10U/L[2];③排除其他内分泌疾病。
1.2 方法
1.2.1 研究设计本研究采用自身对照,将患者第1治疗周期作为对照组,第2周期作为研究组,前后周期均采用长方案促排卵。第2周期患者行降调节治疗前接受DHEA(植物提取物胶囊,K-LEX)25mg,每日3次辅助治疗,疗程为3个月。
1.2.2 激素水平测定及B超监测于月经周期第3天检测外周血卵泡刺激素(FSH)、黄体生成激素(LH)、雌二醇(E2)、睾酮(T)水平,并行阴式B超测AFC、平均卵巢直径(MOD)。激素水平的测定采用全自动化学发光免疫分析系统(ADVIA Centaur XP,SIEMENS),测量灵敏度为 FSH 0.3U/L、LH 0.07U/L、E225.62pmol/L、P 0.66nmol/L,T 0.347nmol/L,批内与批间的变异系数分别为 FSH 2.9%、2.7%,LH 2.9%、2.4%,E25.3%、4.6%,P 3.7%、3.9%,T 3.3%、7.5%。
1.2.3 超促排卵方案患者于排卵后1周开始皮下注射曲普瑞林0.1mg/d降调节,于月经周期第3~5天降调节满意后改用曲普瑞林0.05mg/d直至hCG注射日,同时开始使用Gn 300~450U/d超促排卵,监测卵泡发育情况调整用药剂量。当至少1个卵泡直径≥18mm或2个卵泡直径≥17mm或3个卵泡直径≥16mm时,注射重组人绒毛膜促性腺激素(hCG)250μg,34~36h后取卵,取卵后 2~3d行胚胎移植术,术后常规黄体支持。移植后14d测定血hCG水平>10U/L为生化妊娠,移植后4~6周行超声检查,检测到孕囊及胎心搏动为临床妊娠,并继续黄体支持治疗至10孕周。
1.3 检测指标
1.3.1 一般情况及卵巢储备功能参数年龄,不孕年限,身体质量指数(BMI),基础 FSH、LH、E2、T 水平,FSH/LH 值,AFC,MOD。
1.3.2 周期治疗参数及结局Gn启动剂量、总剂量及使用天数,hCG日E2、P水平及内膜厚度,直径>10mm的卵泡数、获卵数,获卵率、受精率、卵裂率、优质胚胎率,胚胎种植率、冷冻胚胎率、临床妊娠率、流产率及周期取消率。
1.4 统计学方法
应用SPSS 18.0软件进行数据分析,计数资料采用χ2检验或Fisher确切概率法,计量资料采用配对t检验。
2 结果
2.1 一般情况及前后周期卵巢储备功能参数比较
47例患者中,原发不孕25例,继发不孕22例;年龄36.9±2.7岁,不孕年限5.8±3.4年,身体质量指数22.4±2.7kg/m2。IVF指征分别为输卵管因素17例,子宫内膜异位症13例,男性因素9例,不明原因8例。患者随年龄增长使不孕年限延长(P<0.01),但基础FSH及FSH/LH并未随年龄的增长而升高。DHEA治疗后基础AFC显著提高(P<0.01),基础E2水平呈降低趋势,T水平呈增高趋势,但差异尚无统计学意义。见表1。
表1 47例DHEA辅助治疗前后激素及周期卵巢储备功能参数比较(±s)
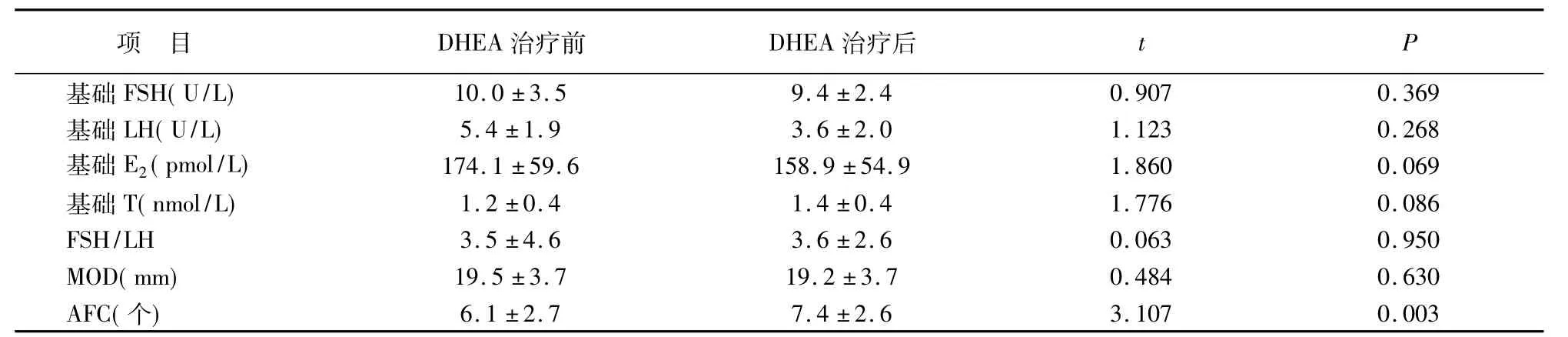
表1 47例DHEA辅助治疗前后激素及周期卵巢储备功能参数比较(±s)
项 目 DHEA治疗前 DHEA治疗后t P 10.0±3.5 9.4±2.4 0.907 0.369基础LH(U/L) 5.4±1.9 3.6±2.0 1.123 0.268基础E2(pmol/L) 174.1±59.6 158.9±54.9 1.860 0.069基础T(nmol/L) 1.2±0.4 1.4±0.4 1.776 0.086 FSH/LH 3.5±4.6 3.6±2.6 0.063 0.950 MOD(mm) 19.5±3.7 19.2±3.7 0.484 0.630 AFC(个)基础FSH(U/L)6.1±2.7 7.4±2.6 3.107 0.003
2.2 前后周期临床参数及治疗结局比较
前后周期Gn启动剂量、总剂量及使用天数均无统计学差异。DHEA辅助治疗后,卵泡数、获卵数增加(P<0.05),获卵率、卵裂率提高(P<0.05),而受精率无显著性变化。hCG日E2水平、hCG日子宫内膜厚度、P水平无显著性改变。DHEA辅助治疗后周期取消率由27.7%降至10.6%,但差异无统计学意义,临床妊娠率显著提高(P<0.01),妊娠的16例中目前有5例活产,3例>28孕周,4例>12孕周,1例8孕周,3例流产。胚胎种植率和冷冻胚胎率也较治疗前显著提高(P<0.05),而流产率无显著性改变。见表2。妊娠的16例中7例为原发不孕,9例为继发不孕,不孕类型患者间的妊娠率差异无统计学意义(28.0%,40.9%;χ2=0.869,P=0.376)。47例患者均能很好耐受DHEA,无因药物副作用退出治疗,一些患者出现轻度皮脂增多及粉刺,但无面部毛发生长及声音低沉现象出现。
表2 47例DHEA辅助治疗前后周期临床参数及治疗结局比较(±s)
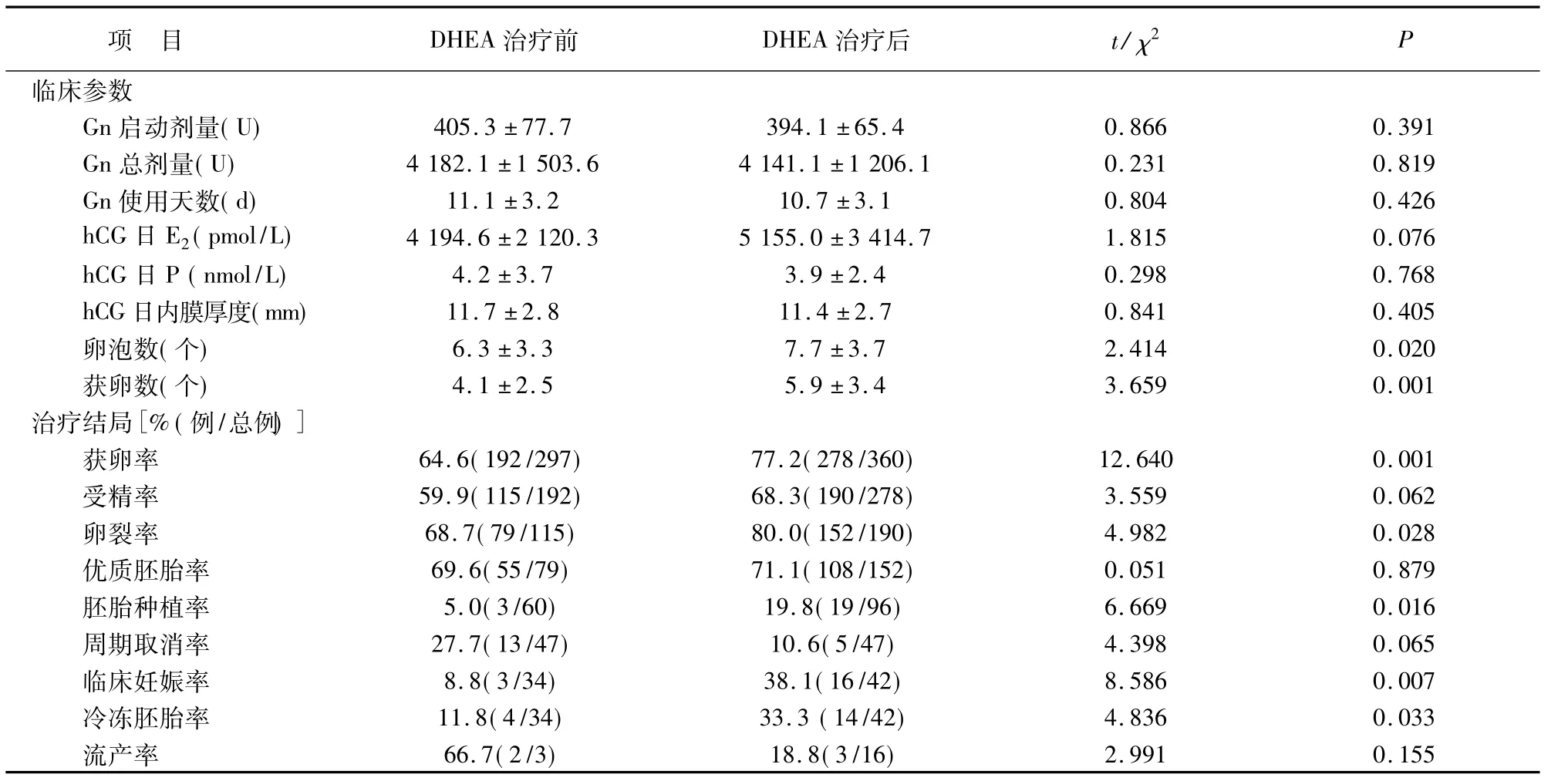
表2 47例DHEA辅助治疗前后周期临床参数及治疗结局比较(±s)
2.991 0.155
3 讨论
随着人群妊娠年龄的推迟及不孕症人口的老龄化,DOR患者逐渐增多,研究者们正积极探索不同的超促排卵方案,增加Gn用量,运用生长激素等药物辅助治疗,尝试未成熟卵母细胞体外成熟培养(IVM)技术。DHEA是一种弱雄激素,是卵巢内类固醇激素合成重要的激素原。20~30岁女性体内DHEA水平处于高峰期,30岁以后以2%的水平逐年下降,到 80岁时约为峰值的 10% ~20%[3]。2000年Casson等[4]根据DHEA能够提高血胰岛素样生长因子-1(IGF-1)水平,首次提出DHEA可以改善DOR患者的促排卵效果。Barad和Gleicher等通过一系列研究表明DHEA可以提高卵母细胞和胚胎数量及质量,提高妊娠率,降低染色体的非整倍性和流产率[5~9]。2010 年 Wiser等[10]完成了一项前瞻性随机对照试验,证实DHEA能够显著提高胚胎质量及活产率。
DHEA的作用机制尚不明确,学者们对此进行了大量研究。研究表明雄激素通过与雄激素受体(AR)结合将信号转导至细胞核,调节基因表达,抑制细胞凋亡[11];并促进颗粒细胞FSH受体的表达及抗苗勒管激素(AMH)和抑制素B(INHB)的分泌[12],提高卵巢对促性腺激素的敏感性,改善卵巢储备功能。Sen等[13]设计的雄激素受体敲除(ARKO)雌鼠模型具有颗粒细胞凋亡、窦卵泡数减少及不孕的特点,验证了雄激素可以通过AR促进卵泡募集与发育。两细胞/两性腺激素学说显示,卵泡液内约48%的睾酮是由DHEA转化而来,进而通过芳香化酶转化为 E2参与卵泡的生长发育[7]。Liu等[14]研究表明DHEA还可以通过非受体结合的非经典途径促进血管生成及内皮细胞NO的合成,舒张血管,改善卵巢血供及营养。Gleicher等[8]通过胚胎植入前遗传学筛查(PGS)指出DHEA可能通过影响减速分裂时染色体的分离,降低年龄相关性染色体非整倍性发生的风险。
最近有学者提出了一种新的假说:随着年龄的增长,卵巢储备功能降低是由卵巢微环境衰老所致,而非卵母细胞的衰老[1]。衰老的卵巢微环境内可能缺乏DHEA,或者其它某种或某些物质。DHEA能够提高卵巢微环境内IGF-1等因子的含量,促进早期卵泡的募集。可见促性腺激素并非卵巢功能的唯一调控因素,卵巢微环境内类固醇激素及旁分泌或自分泌因子共同参与了卵泡的发育过程。
本研究结果显示,DHEA辅助治疗后基础AFC显著提高,AFC是卵巢储备功能准确可靠的指标之一,对卵巢反应性的预测具有高度敏感性和特异性[2],因此推测 DHEA可以改善卵巢储备功能。Qin等[15]研究显示基础T水平高的患者卵巢储备功能和 IVF治疗结局较好,本研究中患者使用DHEA后基础T水平呈增高趋势,但差异尚无统计学意义,可能与样本含量较小有关。
DHEA辅助治疗后卵泡数、获卵数及获卵率显著提高,而前后周期Gn启动剂量、总剂量及使用天数无显著性差异,患者周期取消率也呈现降低趋势,可见DHEA能够改善卵巢反应性。患者用药后卵裂率显著增加,与国际上研究显示的DHEA能够提高卵母细胞和胚胎数量及质量相符。不过治疗前后卵母细胞受精率无显著性变化,可能与男方精子质量有一定相关性。前后周期hCG日子宫内膜厚度及P水平无显著变化,推测DHEA对子宫内膜容受性的负面影响较小。治疗结局显示胚胎种植率、冷冻胚胎率及临床妊娠率显著提高,与国外前瞻性随机对照试验[10]一致。乔杰等[16]研究显示,首次接受IVF-ET治疗的患者临床妊娠率明显高于≥2次治疗者。而本研究中患者接受DHEA辅助治疗后妊娠率较前一周期提高,因此笔者推测DHEA辅助治疗可以改善IVF治疗结局。另外,Wiser等[10]研究指出继发不孕较原发不孕的患者预后良好,而本研究中妊娠患者的不孕类型无显著性差异。国内一项12 491个IVF周期临床结局及影响因素分析的研究也显示不同不孕类型的临床妊娠率无显著性差异[16]。
总之,根据本研究及国外研究结果,笔者推断DHEA可以改善DOR患者卵巢储备功能,提高卵巢反应性,改善IVF治疗结局。然而目前尚缺乏充足的随机对照研究,今后尚需进一步研究扩大样本量,并进行前瞻性随机对照试验,以提供更多更有力的证据,DHEA治疗的临床适应证、有效给药剂量及疗程等还有待进一步研究探索。
1 Gleicher N,Barad DH.Dehydroepiandrosterone(DHEA)supplementation in diminished ovarian reserve(DOR)[J].Reprod Biol Endocrinol,2011,9:67.
2 Gurtcheff SE,Klein NA.Diminished ovarian reserve and infertility[J].Clin Obstet Gynecol,2011,54(4):666-674.
3 Kronenberg HM,Melmed S,Polonsky KS,et al.Williams Textbook of Endocrinology[M].11th ed.Philadelphia:W B Saunders Company,2008:683.
4 Casson PR,Lindsay MS,Pisarka MD,et al.Dehydroepiandrosterone supplementation augments ovarian stimulation in poor responders:a case series[J].Hum Reprod,2000,15:2129-2132.
5 Barad D,Gleicher N.Effect of dehydroepiandrosterone on oocyte and embryo yields,embryo grade and cell number in IVF[J].Hum Reprod,2006,21:2845-2849.
6 Barad D,Brill H,Gleicher N.Update on the use of dehydroepiandrosterone supplementation among women with diminished ovarian function[J].J Assist Reprod Genet,2007,24:629-634.
7 Sönmezer M,Ozmen B,Cil AP,et al.Dehydroepiandrosterone supplementation improves ovarian response and cycle outcome in poor responders[J].Reprod Biomed Online,2009,19:508-513.
8 Gleicher N,Weghofer A,Barad DH.Dehydroepiandrosterone(DHEA)reduces embryo aneuploidy:Direct evidence from preimplantation genetic screening(PGS) [J].Reprod Biol Endocrinol,2010,8:140.
9 Gleicher N,Ryan E,Weghofer A,et al.Miscarriage rates after dehydroepiandrosterone(DHEA)supplementation in women with diminished ovarian reserve:a case control study[J].Reprod Biol Endocrinol,2009,7:108.
10 Wiser A,Gonen O,Ghetler Y,et al.Addition of dehydroepiandrosterone(DHEA)for poor-responder patients before and during IVF treatment improves the pregnancy rate:a randomized prospective study[J].Hum Reprod,2010,25:2496-2500.
11 Lenie S,Smitz J.Functional AR signaling is evident in an in vitro mouse follicle culture bioassay that encompasses most stages of folliculogenesis[J].Biol Reprod,2009,80:685-695.
12 Sunkara SK,Coomarasamy A,Arlt W,et al.Should androgen supplementation be used for poor ovarian response in IVF[J].Hum Reprod,2012,27:637-640.
13 Sen A,Hammes SR.Granulosa cell-specific androgen receptors are critical regulators of development and function[J].Mol Endocrinol,2010,24:1393-1403.
14 Liu D,Iruthayanathan M,Homan LL,et al.Dehydroepiandrosterone stimulates endothelial proliferation and angiogenesis through extracellular signal-regulated kinase 1/2-mediated mechanisms[J].Endocrinology,2008,149:889-898.
15 Qin Y,Zhao Z,Sun M,et al.Association of basal serum testosterone levels with ovarian response and in vitro fertilization outcome[J].Reprod Biol Endocrinol,2011,9:9.
16 李蓉,乔杰,刘平,等.胚胎移植12491个周期的临床效果及影响因素分析[J].中华妇产科杂志,2008,43(8):563-566.

