角蛋白降解菌分离、鉴定及其降解机制研究
齐志国 张铁鹰 董杰丽 杜家菊
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京100193;2.山东理工大学生命科学学院,山东淄博 255049)
羽毛和羊毛是自然界中最主要的角蛋白资源,然而其内部含硫氨基酸丰富,二硫键多,致使结构极稳定。传统物理化学处理角蛋白的方法存在诸多不足,而利用微生物和酶等生物学方法处理角蛋白,条件温和、污染小、氨基酸破坏低,对合理利用角蛋白资源和缓解蛋白资源短缺具有现实意义。细菌、真菌、放线菌等多种微生物可降解角蛋白,其破坏角蛋白二硫键的假说较多,主要包括硫解理论[1]、物理压力理论[2]和酶解理论[3]等。近年来,二硫键还原酶在角蛋白降解中的作用日益受到关注。Yamamura等[4]于嗜麦芽寡养单胞菌发酵液中分离出了二硫键还原酶和蛋白水解酶,并证实二硫键还原酶对角蛋白的降解具有较强促进作用。Prakash 等[5]、Ramnani等[6]和 Ghosh 等[7]亦先后在水解角蛋白的微生物发酵液中检测到了二硫键还原酶,进一步证实了二硫键还原酶在微生物降解角蛋白中的关键作用。本实验通过筛选获得高效羽毛角蛋白降解菌,对其胞内与胞外酶活组成、发酵液中含硫离子、巯基和可溶性蛋白含量测定分析,探讨其降解羽毛角蛋白的机制,为提高其对角蛋白生物降解提供理论指导。
1 材料与方法
1.1 羽毛粉的制备和培养基
分别将鸡羽毛和羊毛用洗涤剂揉搓洗净,121℃高压灭菌1 h,再用清水洗净,然后80℃烘48 h,冷却后粉碎过100目筛,用于培养基制备和微生物发酵。
选择培养基:羽毛粉 10 g、琼脂 20 g、NaCl 0.5 g、K2HPO41 g、KH2PO40.4 g、蒸馏水 1 000 ml,pH 值 7.4~7.6,121℃灭菌 20 min。
种子培养基:牛肉膏5 g、蛋白胨 10 g、NaCl 0.5 g、K2HPO41 g、KH2PO40.4 g、蒸馏水 1 000 ml,pH 值7.4~7.6,121℃灭菌 20 min。
发酵培养基:羽毛粉 10 g、NaCl 0.5 g、K2HPO40.7 g、KH2PO40.35 g、蒸馏水 1 000 ml,pH 值 7.4~7.6,121 ℃灭菌20 min。
1.2 菌株的分离筛选、鉴定
1.2.1 菌株的分离筛选
采集腐烂羽毛及其周围土壤,称取适当样品,将其梯度稀释后涂布于以羽毛粉为唯一碳氮源基础平板上,37℃倒置培养3 d左右,挑取有明显水解圈的菌落进行传代培养和驯化,并保存菌株。将菌株富集培养,取对数期种子液(0.6<OD600<0.8)接种于仅含有完整羽毛的无菌生理盐水中摇瓶发酵,观察羽毛降解情况,筛选降解羽毛速度最快菌株。
1.2.2 筛选菌形态观察与分子鉴定
取分离的菌株于牛肉膏蛋白胨平板上划线培养,37℃恒温培养48 h,观察菌落的形状、颜色、光学特性、表面特性等。之后利用细菌基因组DNA快速提取试剂盒提取基因组,运用16S rDNA通用引物F27:5'-AGAGTTTGATCCTGGCTCAG-3',R1429:5'-GGTTACCTTGTTACGACTT-3'扩增16S rDNA序列。PCR产物经测序后,结果在NCBI中运用Blast进行序列同源性搜索,应用Clustal X1.83进行多序列比对,采用MEGA4中Neighbor-joining方法建树(Bootstrap重复数为 1 000)。
1.3 筛选菌对羽毛角蛋白的降解与机制研究
1.3.1 筛选菌发酵产物分析
取对数期(0.6<OD600<0.8)微生物种子液接种到50 ml/250 ml发酵培养基中,接种量4%,然后37℃、150 r/min 摇床分别培养 6、12、24、48、72、96 h,实验处理均为3个重复。检测上述不同发酵时间发酵液的胞外上清液中角蛋白酶活性、可溶性蛋白与巯基含量,对菌株CP-7发酵过程中的产物进行分析。
1.3.2 发酵上清液中含硫离子检测
取发酵48 h菌株发酵液,离心制备上清液,检测上清液中亚硫酸盐和硫代硫酸盐。硫代硫酸盐采用两种方法进行定性检测。一是将上清液酸化至pH值3.0,若出现浑浊则为有硫代硫酸盐产生;二是观察上清液中加入FeCl3后是否会出现紫色。若有紫色出现表明有硫代硫酸盐产生,反之则无。亚硫酸盐则采用BaCl2检测,若发酵过程产生亚硫酸盐,当加入BaCl2溶液后,上清液则出现白色沉淀,且沉淀可以使KMnO4脱色,反之则无亚硫酸盐产生。
1.3.3 胞内、胞外液酶活性分析
取发酵48 h菌株发酵液,制备胞外、胞内和混合粗酶液。分别以10mg羽毛、羊毛和酪蛋白为底物,检测角蛋白和酪蛋白水解活性。同时检测不同发酵时间胞内、胞外上清液中二硫键还原酶活性,探讨不同酶液组分在角蛋白降解中的作用。
1.4 酶活性及相关生化指标分析方法
1.4.1 粗酶液制备
发酵液于 4 ℃、10 000×g离心 10 min,经 0.22 μm过滤器过滤后即为胞外粗酶液。收集胞体,悬浮于0.05 mol/l pH值10.0甘氨酸-氢氧化钠缓冲液中,用3倍磷酸盐缓冲液洗脱3次,然后用1%的溶菌酶溶解1 h,再用超声波破碎仪冰浴条件下破碎10 min,4℃下10 000×g离心10 min,上清液经过滤后为胞内粗酶液。混合酶液通过1 ml的胞外粗酶液与1 ml胞内粗酶液混合得到。
1.4.2 角蛋白酶活性测定
采用Gradisar[8]所描述的方法为基础,并加以修改。具体操作步骤:10mg羽毛粉与2.0 ml Tris/HCl(pH值 8.0,浓度0.05 mol/l)缓冲液混合,加入1.0 ml上清液,180 r/min、40℃保温处理1 h,每隔10 min取出用力震荡。反应结束时添加2.0 ml的6%三氯乙酸(TCA)终止反应,静止 5 min,10 000×g 离心 15 min,上清液于280 nm下测定其吸光值,采用保温前添加TCA的反应管作为对照。酶活定义:pH值8.0、40℃保温处理1 h后,A280值升高0.01个单位为1 U。
1.4.3 酪蛋白水解活性测定
酪蛋白水解活性参照蛋白酶活性(紫外分光光度法)测定方法。
1.4.4 二硫键还原酶活性测定
二硫键还原酶活性结合Ellman[9]和Brown[10]的方法进行测定。1 ml由粗酶液、0.1 mol/l pH值8.0磷酸缓冲溶液和蒸馏水按3:2:5比例混合组成的酶混合液与1 ml含有5 mmol/l氧化型谷胱甘肽(GSSG)、5 mmol/l苯甲基磺酰氟(PMSF)的磷酸盐缓冲溶液(pH值7.0)混合,在40℃恒温水浴锅中反应1 h。2 000×g离心10 min,取1.5 ml上清液与2.5 ml含有1 mM EDTA的pH值8.0磷酸缓冲液混合,加入100 μl Ellman试剂,静置5 min待颜色稳定时于412 nm下测定吸光度并计算巯基含量。酶对照组为加入1 ml pH值7.0的磷酸缓冲溶液取代氧化型谷胱甘肽的处理组。酶活定义:1 kU二硫键还原酶活性相当于每毫升酶在40℃下每分钟释放出1 μmol巯基。
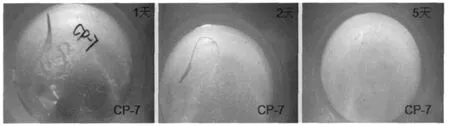
图1 菌株CP-7完整羽毛降解
1.4.5 巯基与可溶性蛋白含量测定
巯基测定参考Ellman的方法并适当修改,可溶性蛋白含量运用Bradford法测定。
2 结果与分析
2.1 菌株的分离、鉴定
2.1.1 菌株的分离筛选
对采集的样品富集稀释并涂布羽毛选择平板培养,共挑取27株平板产水解圈能力较强的菌株。将其于羽毛选择平板上传代驯化,并进行完整羽毛降解实验。最终得到1株能够完全降解羽毛的菌株CP-7,其在5 d内彻底降解完整羽毛(见图1),故对其深入研究。
2.1.2 菌株鉴定
菌株CP-7生长于营养平板培养基,24 h后菌落直径可达4 mm,菌落呈白色扁平状,表面褶皱且多颗粒,粘稠,边缘不整齐并伴有丝状外延(见图2)。
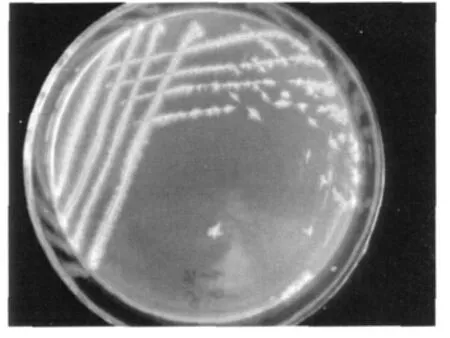
图2 菌株CP-7菌群形态
经PCR手段扩增得到菌株CP-7的部分16S rDNA序列(见图3),测序发现其长度为1 422 bp,序列提交至Genbank数据库,接收号JN628975。将序列进行Blast比对,在GenBank数据库中获得相关菌株16S rDNA序列,应用Clustal X1.83进行多序列比对,采用MEGA4中Neighbor-joining方法建树进行系统发育分析。如图4所示,CP-7与地衣芽孢杆菌位于同一分支,同源性可达99%,初步判定该菌株为地衣芽孢杆菌,命名为Bacillus licheniformis CP-7。
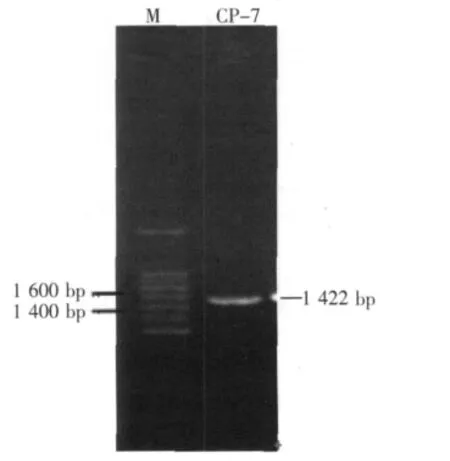
图3 菌株16S rDNA电泳图谱

图4 菌株CP-7系统发育树
2.2 筛选菌对羽毛角蛋白的降解与机制分析
2.2.1 发酵液中可溶性蛋白含量与角蛋白酶活性
发酵液中可溶性蛋白含量和角蛋白酶活性检测发现(见图5、图6),空白对照发酵液中可溶性蛋白产量低、变化小,而CP-7发酵液中可溶性蛋白含量在48 h最高,可达0.26mg/ml,之后随发酵时间呈现逐渐下降趋势。角蛋白酶活性随发酵时间而逐渐增加,96 h酶活达到最高(8.43 U/ml),但72 h酶活性明显近于稳定,可见角蛋白酶是该菌降解羽毛的基础。
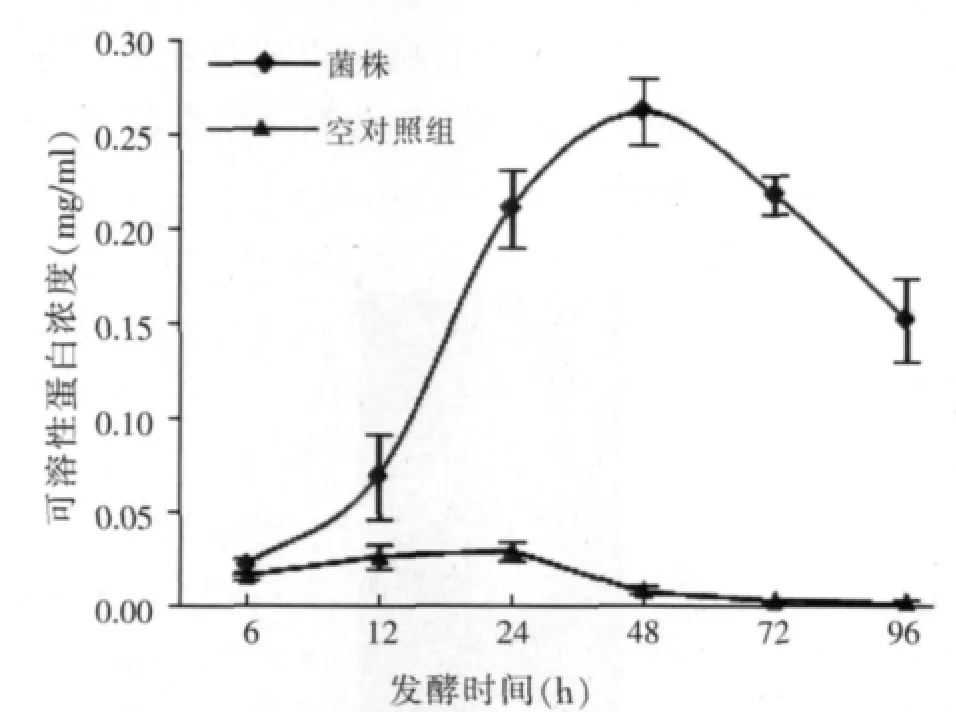
图5 发酵液中可溶性蛋白变化
2.2.2 发酵液中巯基和含硫离子
CP-7发酵液中巯基浓度随发酵时间逐渐升高(见图7),96 h达到119 μM,这与角蛋白酶活力的变化趋势一致,而空白对照发酵液中的巯基浓度几乎无变化,这说明该菌株在降解羽毛角蛋白过程中有大量二硫键被还原。
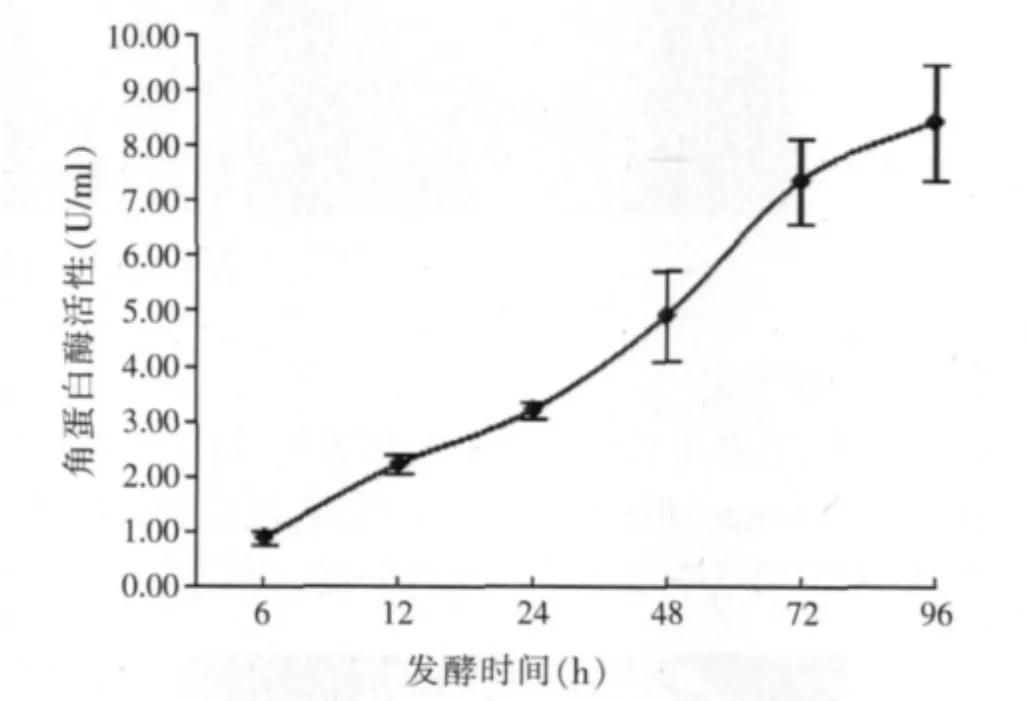
图6 发酵产酶情况

图7 发酵液中巯基浓度变化
对菌株CP-7发酵液中亚硫酸盐和硫代硫酸盐等含硫离子检测发现,上清液添加氯化铁后并不显紫色,酸化至pH值3.0后未出现浑浊,表明硫代硫酸盐检测呈阴性。当加入BaCl2溶液后,上清液出现白色沉淀,并且沉淀可以使KMnO4脱色,表明菌体在代谢过程中有亚硫酸盐产生。这说明发酵液中的巯基可能被进一步转化为了亚硫酸盐。
2.2.3 胞内、胞外液中酶活组成
分别以羽毛、羊毛和酪蛋白为底物检测胞内酶液、胞外酶液和胞内胞外混合酶液中蛋白酶活性。结果表明,以羽毛粉为底物时混合酶液角蛋白酶活性(7.13 U/ml)约为胞外酶液角蛋白酶活性(2.9 U/ml)2.5倍(P<0.01),以羊毛为底物时两者差异亦极显著(P<0.01),但酪蛋白水解活性差异不显著(P>0.05)(见图8、图9)。胞内酶液仅在以羊毛为底物时检测到微弱角蛋白酶活性(0.25 U/ml),以羽毛和酪蛋白为底物时均未检测到蛋白酶活性。
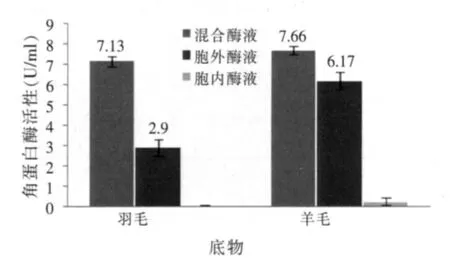
图8 胞内、胞外、混合酶液角蛋白水解活性
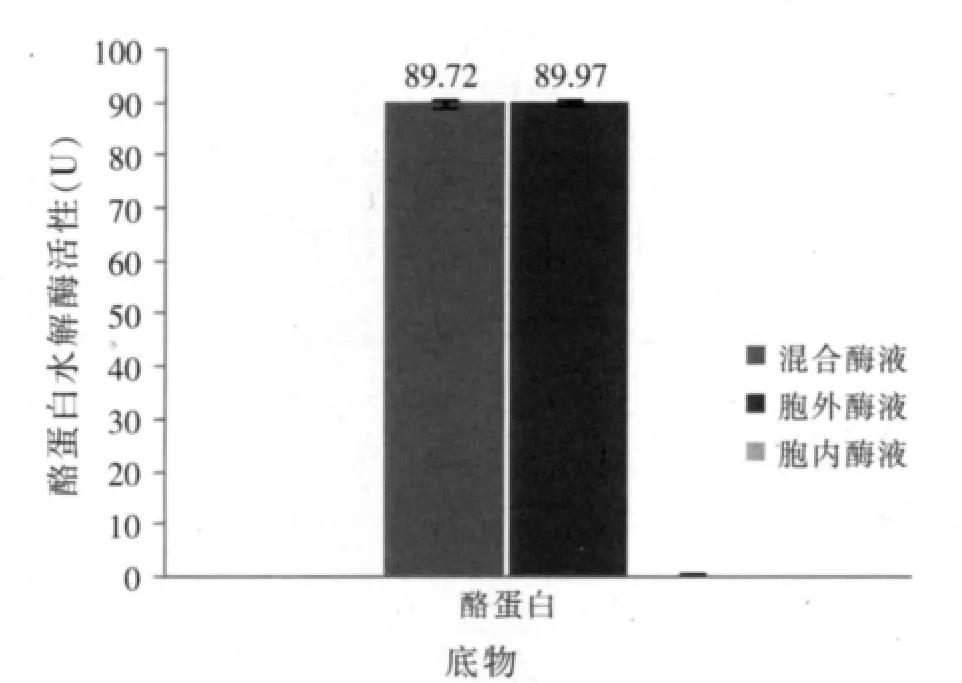
图9 胞内、胞外、混合酶液酪蛋白水解酶活性
该菌胞内、胞外酶液二硫键还原酶活性随发酵时间的变化情况见图10。胞外酶液各时间点均未检测到二硫键还原酶活性,而胞内酶液均检测到二硫键还原酶活性,表明胞内二硫键还原酶可能是胞外角蛋白酶活性提高的主要原因。其在发酵初始就达到较高水平,并在36 h达到最大,随后迅速降低,这与胞外角蛋白酶产生规律不同。

图10 胞内、胞外液二硫键还原酶活性
3 讨论
角蛋白降解菌的筛选通常以产透明圈大小和酶活性高低为筛选标准,本实验则以透明圈和完整羽毛降解法,获得了1株可高效降解角蛋白菌株,经鉴定命名为Bacillus licheniformis CP-7。该菌可在5 d内将完整羽毛彻底降解,较之多数已知菌株降解角蛋白的能力强。地衣芽孢杆菌PWD-1为研究最为深入的降解菌,但其彻底降解羽毛需6 d[11]。吴小伦[12]和Suntornsuk[13]用透明圈法分别分离到短黄杆菌ZDM(Flavobacterium breve ZDM)和Bacillus sp.FK46,两者摇瓶发酵5 d后羽毛被强烈降解,但均无法完全利用羽轴。由此可见,利用透明圈和完整羽毛降解相结合的方法筛选角蛋白降解菌更为有效。
当前关于角蛋白降解假说较多,但其核心均为二硫键的裂解。菌株CP-7发酵过程中还原得到大量巯基,同时伴有可溶性蛋白、角蛋白酶的产生。进一步研究发现,CP-7胞内液具有二硫键还原酶活性,并对胞外角蛋白酶活性具有显著地促进作用,这表明其胞内的二硫键还原酶参与了角蛋白降解过程。Yamamura等[4]在嗜麦芽窄食单胞菌D-1中分离到了蛋白水解酶和二硫键还原酶。研究表明,两种酶并不独立起作用,而同时用于羽毛降解时,其蛋白酶水解活性比单独使用提高约50多倍。另外,在蜡样芽孢杆菌[5]、B.licheniformis RG1[6]和Bacillus halodurans PPKS-2[7]发酵液中也检测到了二硫键还原酶活性,且对角蛋白酶具有激活作用。此外,二硫键还原酶可明显提高枯草芽孢杆菌蛋白酶、胰蛋白酶以及蛋白酶K水解角蛋白的活性[4]。本研究还发现,二硫键还原酶活性在角蛋白降解初期较高,这或许与二硫键的早期断裂相关。因此,二硫键还原酶在CP-7羽毛角蛋白降解中具有重要作用,促进了二硫键的裂解。
角蛋白二硫键的还原不仅与二硫键还原酶有关,其它化学因素也可能是破坏二硫键的重要原因。Onifade[14]发现几种角蛋白降解真菌产生的亚硫酸盐可以对角蛋白进行硫解。Kunert[1]也认为代谢产生的亚硫酸盐和硫代硫酸盐可能加速了二硫键裂解。王玲[15]发现在羽毛发酵过程中加入适当浓度的亚硫酸盐和硫代硫酸盐可以促进角蛋白降解。本研究在CP-7发酵液中也检测到了亚硫酸盐,但未检测到硫代硫酸盐。因此,CP-7裂解角蛋白二硫键与硫解作用可能具有密切关系。
4 结语
基于上述研究可知,运用透明圈和完整羽毛降解相结合的方法筛选角蛋白降解菌更为有效。筛选菌CP-7胞内二硫键还原酶显著促进胞外角蛋白水解活性,这可能与二硫键还原酶裂解二硫键有关。此外,代谢产生的亚硫酸盐与角蛋白降解亦可能密切相关。
[1]Kunert J,Stransky Z.Thiosulfate production from cysteine by the keratinolytic prokaryote Streptomyces fradiae[J].Arch Microbiol,1988,82:600-601.
[2]Figueras M J,Guarro J.X-ray microanalysis of black piedra[J].Antonie van Leeuwenhoek.1997(4).
[3]Nickerson W J,Noval J J,Robison R S.Keratinase:I.Properties of the enzyme conjugateelaborated by Streptomycesfradiae.Biochimica et Biophysica Acta,1963,77:73-86.
[4]Yamamura S,Morita Y,Hasan Q,et al.Keratin degradation:a cooperative action of two enzymes from Stenotrophomonas sp.[J].Biochemical and Biophysical Research Communications,2002,294:1138-1143.
[5]Prakash P,Senigala K,Jayalakshmi,et al.Purification and characterization of extreme alkaline,thermostable keratinase,and keratin disulfide reductase produced by Bacillus halodurans PPKS-2[J].Applied Microbiology and Biotechnology,2010,87:625-633.
[6]Ramnani P,Singh R,Gupta R.Keratinolytic potential of Bacillus licheniformis RG1:structural and biochemical mechanism of feather degradation[J].Canadian Journal of Microbiology,2005,51(3):191-196.
[7]Ghosh A,Chakrabarti K,Chattopadhyay D.Degradation of raw feather by a novel high molecular weight extracellular protease from newly isolated Bacillus cereus DCUW[J].J Ind Microbiol Biotechnol,2008,35:825-834.
[8]GradisÏar H,Kern S,Friedrich J.Keratinase of Doratomyces microspores.Appl Microbiol Biotechnol,2000,53:196-200.
[9]Ellman G L.Tissue sulfhydryl groups.Arch Biochem Biophys,1959,82:70-77.
[10]Brown D M,Upcroft J A,Upcroft P.A thioredoxin reductaseclass of disulphide reductase in the protozoan parasite Giardia duodenalis.Mol Biochem Parasitol,1996,83:211-220.
[11]Williams C M,Richter C S,Mackenzie J M,et al.Isolation,I-dentification,and Characterization of a Feather-Degrading Bacteriumt.Applied and environmental microbiology,1990,7:1509-1515.
[12]吴小伦.羽毛角蛋白降解菌(Flavobacterium breve ZDM)的分离、鉴定及其发酵产酶条件和酶学特性的研究[D].杭州:浙江大学,2001.
[13]Suntornsuk W,Suntornsuk L.Feather degradation by Bacillus sp.FK46 in submerged cultivation[J].Bioresource Technology,2003,86:239-243.
[14]Onifade A A,Al-Sane N A,Al-Musallam A A,et al.A Review:Potentials for biotechnological applications of keratin-degrading microorganisms and their enzymes for nutritional improvement of feathers and other keratins as livestock feed resources[J].Bioresour Technol,1998,66:1-11.
[15]王玲.Bacillus Licheniformis NJU-1411-1固体发酵羽毛角蛋白生化机制研究——含硫化合物的转化及作用[D].南京:南京大学,2011.

