3种天然药物治疗幽门螺杆菌感染小鼠的体内研究
罗 萍,周曾芬
(1.湖南省怀化市第一人民医院,湖南 怀化 418000;2.昆明医学院第一附属医院,云南 昆明 650032)
幽门螺杆菌(H.Pylori,Hp)感染是胃十二指肠溃疡的常见原因,包括中国人在内的亚洲人群具有高的幽门螺杆菌感染率。很大一部分患者接受Hp 根除治疗后出现消化系溃疡的好转甚至痊愈,进一步提示了该治疗的作用。天然药物由于不良反应小、较易制备、价廉等优点,尤其适合我国患者。云南天然药物资源丰富,我们在前期研究的基础上,根据不用药物的特点,选取新鲜大蒜汁、鱼腥草水煎剂、吴茱萸水煎剂3种天然药物在Hp 感染小鼠模型中进行体内实验,以明确其抗Hp 作用及不良反应,为将云南天然药物应用于Hp 根除治疗奠定基础。
1 材料和方法
1.1 Hp 感染小鼠模型制备
1.1.1 实验动物 BALB/c 小鼠190 只,6~8 周龄,重17~20 g,雌雄各半,购自昆明医学院动物中心。在本院实验楼动物科清洁级饲养,室温(23±2)℃,相对湿度为(55±5)%,每天光照黑暗交替各12 h。自由进食、饮水。
1.1.2 H.Pylori 菌株及培养分别选用昆明医学院第一附属医院保种的十二指肠溃疡(DU)患者胃内分离的H.Pylori(CagA+、VacA+)3-21 菌株,在空肠弯曲菌琼脂平板上复苏,转种于脑心浸液培养基中,应用液体培养法增菌:微氧条件37℃培养72 h,取少量培养液涂片,革兰染色后观察细菌形态并检测尿素酶、过氧化氢酶和氧化酶水平。确认为阳性后,将细菌浓度调整到1×109CFU/mL,立即接种BALB/c 小鼠。
1.1.3 模型建立方案 同龄BALB/c 小鼠在昆明医学院附属第一医院动物科适应饲养1 周,自由进食,饮水。根据性别分层后随机分为2组,雌雄均各半,各组间小鼠体重经检验无统计学差异。
1.1.3.1 正常对照组(35 只)口服0.2 mol/L 碳酸氢钠0.25 mL,15 min 后用胃管灌喂脑心浸液0.4 mL/次,每日灌喂1次,连续5 d。灌喂前先禁食禁水12 h,灌喂后禁食禁水2 h,然后自由进食、饮水。
1.1.3.2 病理模型组(155 只)口服0.2 mol/L 碳酸氢钠0.25 mL,15 min 后用胃管灌喂浓度为1×109CFU/mL H.Pylori 3-21 菌株0.4 mL/次,每日灌喂1次,连续5 d。灌喂前先禁食禁水12 h,灌喂后禁食禁水2 h,然后自由进食、饮水。
1.1.3.3 最后1次灌喂H.Pylori 菌株后继续饲养4周,后随机抽取对照组及实验组小鼠各5 只处死。证实造模成功后进行下一步的治疗。
1.2 治疗方案
1.2.1 治疗药物分为4组,分别是新鲜大蒜汁(浓度为0.78 mg/mL)、鱼腥草水煎剂(浓度为0.25 g/mL)、吴茱萸水煎剂(浓度为0.5 g/mL)、三联药物(新鲜大蒜汁0.39 g/mL、鱼腥草水煎剂0.125 g/mL、吴茱萸水煎剂0.25 g/mL 按1∶1∶1 混匀)。
1.2.2 治疗方案 将病理模型组小鼠随机分为6组。A组(30 只):经口灌胃新鲜大蒜汁0.5 mL/只,1次/d,共1 周;B组(30 只):经口灌胃鱼腥草水煎剂0.5 mL/只,1次/d,共1 周;C组(30 只):经口灌胃吴茱萸水煎剂0.5 mL/只,1次/d,共1 周;D组(30只):经口灌胃三联药物0.5 mL/只,1次/d,共1 周,E组(30 只):病理模型对照组,经口灌胃脑心浸液0.5 mL/只,1次/d,共1 周。F组(30 只):正常对照组,经口灌胃脑心浸液0.5 mL/只,1次/d,共1 周。
1.2.3 疗效评价 治疗结束后1 周、1个月各处死小鼠15 只,联合应用快速尿素酶试验、细菌培养和组织病理学方法检测H.Pylori 治疗后的感染情况。
1.3 小鼠治疗前后H.Pylori的检测和鉴定
1.3.1 动物处死和组织标本处理 小鼠处死前禁食、禁水12 h,脱颈处死后,打开腹腔取出全胃,沿大弯剖开,肉眼观察胃黏膜改变,取3 小块幽门腺黏膜组织分别进行H.Pylori 检测:1 块做快速尿素酶鉴定,2 块置于H.Pylori 保存液中以做培养用。余下胃黏膜组织置于10%甲醛中固定,石蜡包埋,切片后做HE 染色和改良Gimasa 染色。
1.3.2 细菌学培养 H.Pylori 培养以空肠弯曲菌选择性琼脂为基础,加入10%的冻融羊血和选择性抗生素(盐酸万古霉素0.25 mg/mL,TMP 0.15 mg/mL,多粘霉素B 0.25 mg/mL,两性霉素B 0.25 mg/mL)制成培养皿,置4℃冰箱保存。取小鼠胃黏膜匀浆0.2 mL 于血平板上,用研磨器涂匀,微需氧培养72 h 后观察。
1.3.3 病理检查 10%甲醛固定的胃组织,石蜡包埋,连续垂直切片。HE 染色,观察小鼠胃黏膜的炎症程度;改良Gimasa 染色,观察组织切片中的H.Pylori。H.Pylori的定植密度均根据2000年5月中华医学会消化病学分会制定标准。由两名不知菌株背景的病理科高级职称医师盲法读片。
1.3.4 限制性酶切片段多态性PCR(PCR-RFLP)以比较定植前所用菌株与定植后小鼠感染菌株为同一菌株。
1.3.5 胃黏膜病变的观察 肉眼观察胃内病变,记录是否有黏膜的糜烂、出血和溃疡。
1.3.6 H.Pylori 感染的判定 采用快速尿素酶、细菌培养、组织学观察(改良Gimasa 染色)和PCRRFLP 2项或2项以上阳性或组织学阳性判定为H.Pylori 感染。
1.4 统计学处理 数据应用SPSS 11.0 软件进行统计学处理。分别采用双尾Fisher′s 精确概率检验、t检验和方差分析进行统计学处理。
2 结 果
2.1 模型的建立 快速尿素酶试验、细菌学培养、病理学检查、大体标本观察实验组、对照组及PCRRFLP 结果见表1、图1、图2。结果证实Hp 感染小鼠模型成功建立,且感染效率达到100%。

表1 H.Pylori 感染BALB/c 小鼠情况
病理模型组与正常对照组比较:χ2(连续校正χ2值)=6.400,P=0.011。
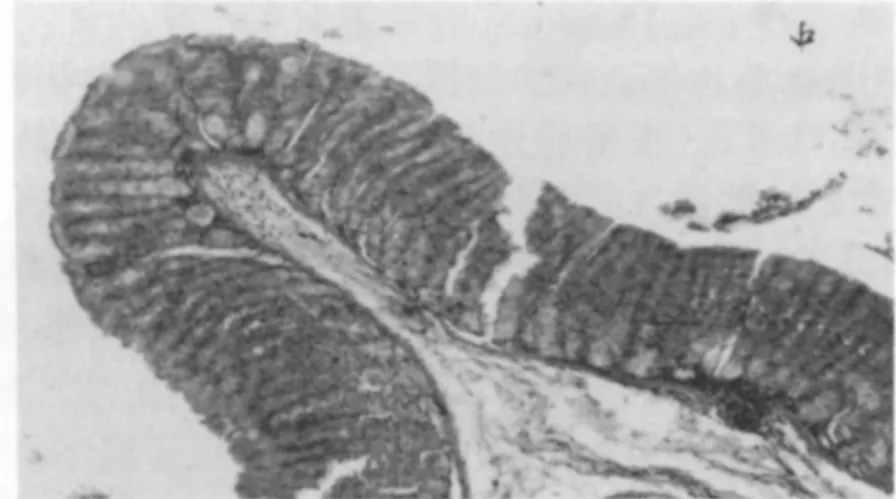
图1 H.Pylori 感染BALB/c 小鼠胃黏膜组织切片HE 染色(中度炎症反应)
实验组改良Gimasa 染色可清楚显示H.Pylori,H.Pylori 呈多杆状,“S”型,海鸥状较少见。多位于胃小凹上半部及胃腺腔内,以胃窦为主。对照组动物均未找见H.Pylori。
2.2 不同方案药物治疗后Hp 根除率 治疗结果见表2、表3。三药联合治疗的有效率达到86.67%,明显优于单药治疗组,这部分实验同时还证实了三药联合治疗的优势在治疗后就很快显示出来。

图2 H.Pylori 感染BALB/c 小鼠胃黏膜组织切片Geimsa 染色
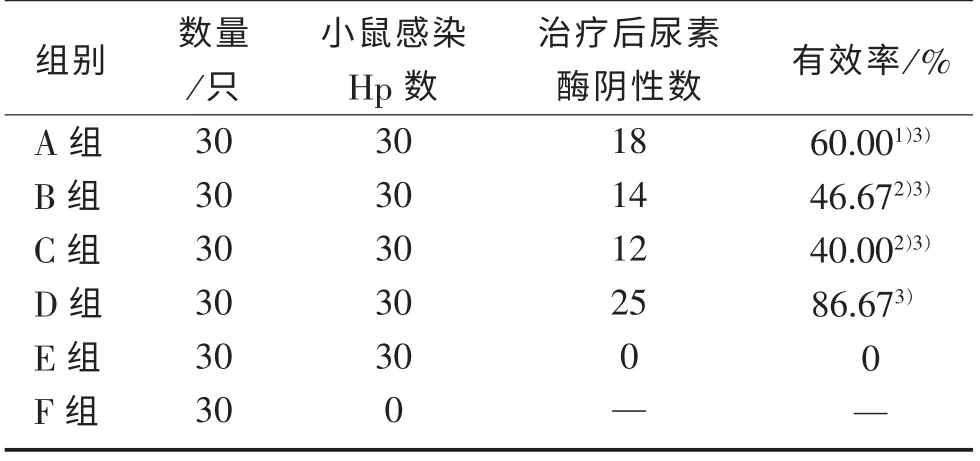
表2 治疗后小鼠总体H.Pylori 感染及治疗效果
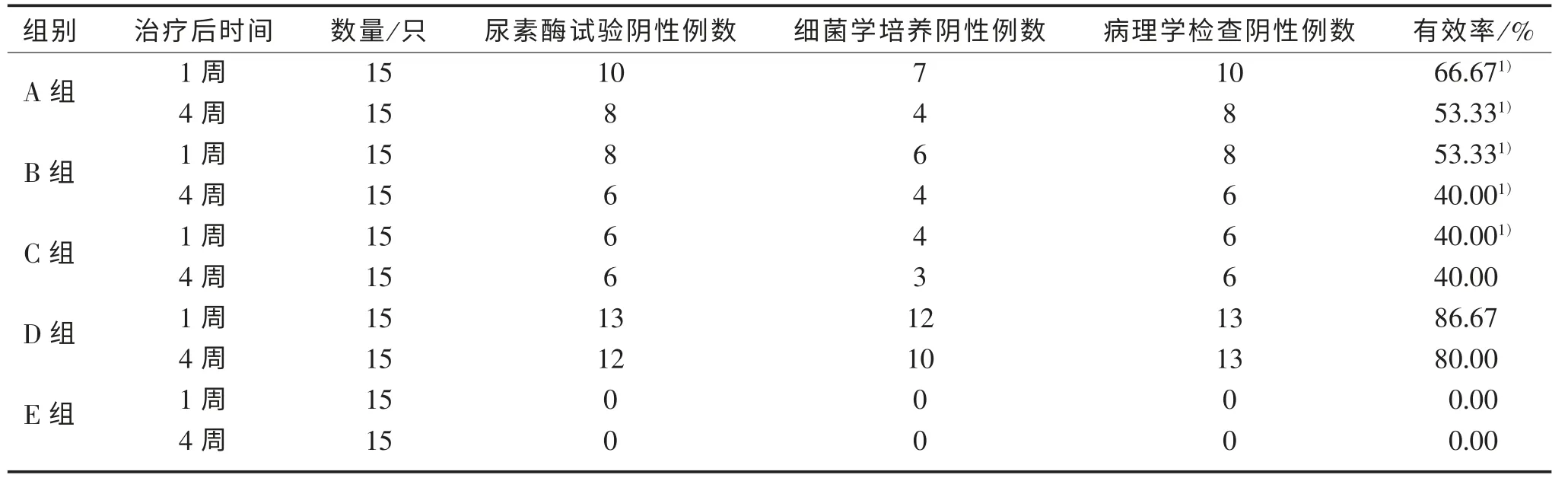
表3 治疗后1 周及4 周H.Pylori 感染BALB/c 小鼠及天然药物治疗效果
治疗相关不良反应:仅在新鲜大蒜汁治疗组中有一只小鼠出现食欲差,在治疗结束后饮食恢复正常。其余小鼠未出现异常。
细菌学培养、病理学检查(改良Giemsa 染色)、快速尿素酶检测。上述细菌学培养阴性或后2项及以上阴性判定为HP 清除。
3 讨论
大量的体外实验和我们的研究证实、新鲜大蒜汁、鱼腥草、吴茱萸等有抑制幽门螺杆菌作用,然而由于建立稳定、经济而且能真实模拟人胃感染H.Pylori 动物模型的困难,对天然药物的体内抑菌实验报道在国内外尚少。
良好的动物感染模型的建立是该研究的前提基础。尽管恒河猴、平顶猴、蒙古沙鼠及雪貂等是H.Pylori的天然宿主,但由于价格高、数量少、饲养条件高等因素限制,不适于做理想的动物模型研究[1-3]。国内常用的有狗、大鼠、沙鼠等感染率不是很理想,并且感染的稳定性和重复性尚存在不同程度的问题[4-5]。小鼠体型小、易繁殖、来源便利、属系多样,是作为动物模型的较好材料[6-8]。近几年出现的H.Pylori BALB/c 小鼠[9]模型由于其可产生与人相似的病理变化,且高定植量有利于评价药物根除H.Pylori的疗效,对H.Pylori 疫苗的抗原筛选及治疗性免疫的研究具有重要的应用价值,因此本实验利用BALB/c 小鼠作为我们的动物模型小鼠。
本实验采用经筛选的云南本地区临床分离培养毒株H.Pylori(CagA+、VacA+)3-21 菌株,预先灌胃碳酸氢钠中和部分胃酸,PH 值升高,改善H.Pylori定植的生理环境,从而使H.Pylori 成功的定植在BALB/c 小鼠胃黏膜上并引起与人感染相似症状。这可能是H.Pylori 定植后致胃壁细胞等胃腺细胞坏死破裂,使胃酸分泌下降,PH 值升高,更易于PH 定植[10]。我们采用的H.Pylori 菌株是经过多次传代(>10次)菌株,均能定植于BALB/c 小鼠,否定了传代菌株不易在小鼠胃内定植的推论[11]。并且通过PCRRFLP 检测定植前所用菌株与定植后小鼠感染菌株为同一菌株,即H.Pylori 3-21 菌株,从而避免了胃内可能存在的其他弯曲菌的感染而影响实验结果的可靠性。
有关大蒜各种剂型对幽门螺杆菌的体外抑菌作用报道较多,然而体内的实验疗效并不一致。周曾芬等[12]运用鲜大蒜对云南地区379 名农村人群H.Pylori 感染进行前瞻性研究,结果表明:食用鲜大蒜能有效的降低H.Pylori的感染率,其疗效与经典含铋三联疗法相当;而且有成本花费最小、无耐药性、无不良反应等 优点。Graham DY 等[13]让10 位 无症状H.Pylori 感染阳性的受试者服用鲜大蒜,同时另外11 位受试者服用铋剂,研究结果却不表明鲜大蒜有抗H.Pylori 作用。Gail B 等[14]却对Graham D的临床实验提出异议,指出Graham D的临床实验所用大蒜是鲜大蒜,而不是加工过的有一定浓度的鲜大蒜汁,同时指出天然植物的治疗效果取决于在体内的累积效应,可能要8~12 周以后才能观察到明显的治疗效果。Iimuro 等[15]用大蒜提取液治疗蒙古沙土鼠H.Pylori 感染性胃炎,治疗后观察到H.Pylori 感染数量无明显减轻,但胃部出血点及炎症范围明显减轻,提示大蒜提取液在治疗H.Pylori 感染引起的胃炎有一定疗效,而对H.Pylori 无根除作用。
有关吴茱萸对幽门螺杆菌的体内抑菌作用报道较少,但其体内的实验疗效较一致。Norio Hamasaki等[16]证实吴茱萸提取物中的两种生物碱对H.Pylori都具有高度敏感性,而且对肠道中的其他细菌没有抑制作用。Higuchi K 等[17]用吴茱萸、奥美拉唑和阿莫西林治疗H.Pylori 感染的患者,同时用奥美拉唑和阿莫西林治疗的效果作为对照,结果发现:加用吴茱萸后的治疗效果好于对照组(P<0.05),用吴茱萸治疗H.Pylori 感染效果是明显的,值得进一步研究。
本课题在国内外首次研究了新鲜大蒜汁、鱼腥草水煎剂及3种天然药物联合对H.Pylori 感染小鼠进行治疗,得到了较满意的结果。不同天然药物单独治疗H.Pylori 抗溃疡及复发疗效报道不一,但其根除率介于13.3%~70.0%,治疗疗效尚难满意[18]。天然药物联合应用可起协同效应,提高治疗疗效[19]。在我们的研究中,把具有中等抑菌效果的新鲜大蒜汁、鱼腥草、吴茱萸联合进行体内抑菌,其根除率可达85%。与单味鱼腥草、吴茱萸水煎剂疗效有显著性差异,即联合用药效果优于单剂治疗的效果,这将为我们以后天然药物的开发及临床应用奠定了坚实的理论基础。
[1]KONTUREK P C,BROZOWSKI T,KONTUREK S J,et al.Functional and morphological aspects of Helicobacter pylori-induced gastric cancer in Mongolian gerbils[J].Eur J Gastroenterology Hepatol,2003,15(7):745-754.
[2]RADIN M J,EATON K A,KRAKOWKA S,et al.Helicobacter pylori gastric infection in gnotobiotic beagle dogs[J].Infect Immun,1990,58(8):2606.
[3]KAGAWA J,HONDA S,KODAMA M,et al.Enterocromaffinlike cell tumor induced by Helicobacter pylori infection in Mongolian gerbils[J].Helicobacter,2002,7(6):390-397.
[4]FUJIWARA Y,HIGUCHI K,TOMINAGA K,et al.Effect of Helicobacter pylori culture supernatant on acute efflux esophagitis in a rat model[J].Hepatogastroenterology,2001,48(42):1611-1615.
[5]YANG J,HU AP,LI Q.Establishment of Helicobacter pylori infection model in Mongolian gerbils[J].Zhejiang Daxue Xuebao Yixueban,2003,32(1):21-23.
[6]HARRIS A G,WILLEN J E,DANON S J,et al.Catalase(Kat A)and Kat A-associated protein (KapA)are essential to persistent colonization in the Helicobacter pylori SS1 mouse model[J].Microbiology,2003,149(3):665-672.
[7]KIM D H,KIM S W,SONG Y J,et al.Long-term evaluation of mice model infected with Helicobacter pylori:focus on gastric pathology including gastric cancer.Aliment[J].Pharmacol Ther,2003,18(Suppl 1):14-23.
[8]HAN S U,KIM Y B,JOO H J,et al.Helicobacter pylori infection promotes gastric carcinogenesis in a mice model[J].J Gastroenterol Hepatol,2002,17(3):253-261.
[9]曾志荣,胡品津,陈湖,等.幽门螺杆菌长期感染鼠腺胃模型的研究[J].中华医学杂志,1998,78(7):494.
[10]GRAHAM D Y,YAMAOKA Y.H.pylori and cagA:relationships with gastric cancer,duodenal ulcer,and reflux esophagitis and its complications[J].Helicobacter,1998,3(3):145-151.
[11]LEE A,FOX J G,HEXELL S.Pathogenicity of Helicobacter pylori:a perspective[J].Infect immune,1993,61(5):1601-1610.
[12]周曾芬,马岚青,王健,等.通过健康教育和食用鲜大蒜降低云南玉溪地区小石桥乡响水村农村人群幽门螺杆菌感染率的研究[J].肠病学,2001,6(21):220-230.
[13]GRAHAM D Y,ANDERSON S Y,LANG T.Garlic or jalapeno peppers for treatment of Helicobacter pylori infection[J].Am J Gastroenterol,1999,94(5):1200-1202.
[14]GAIL B.Garlic and Helicobacter pylori[J].Am J Gastroenterol,2000,95(1):127-128.
[15]LIMURO M,SHIBATA H,KAWAMORI T,et al.Suppressive effects of garlic extract on Hlicobacter pylori—induced gastritis in Mongolian gerbils[J].Cancer Lett,2002,187(1/2):61.
[16]NORIO H,E ISHI,K TOMINAGA,et al.Highly selective antibacterial of novel alkyl quinolone alkaloids from a Chinese herbal medicine,gosyuyu (Wu-Chu-Yu),against Helicobacter pylori in vitro[J].Microbiol Immunol,2000,44(1):9-15.
[17]HIGUCHI K,T ARAKAWA,K ANDO,et al.Eradication of Helicobacter pylori with a Chinese herbal medicine without emergence of resistant colonies[J].Am J Gastroenterol,1999,94(5):1419-1420.
[18]卜平,陈齐鸣.中药根除幽门螺杆菌的抗溃疡复发临床观察[J].浙江中医杂志,1996,31(9):400-401.
[19]王绪霖,缴稳玲,吕宗舜,等.抑制幽门螺杆菌中药的初步筛选[J].中西医结合杂志,1994,14(9):534-536.

