大白菜褐腐病(茎基腐病)的病原菌鉴定
周慧敏 谢学文 石延霞 郭英兰 李宝聚*
(1中国农业科学院蔬菜花卉研究所,北京 100081;2中国科学院微生物研究所,北京 100101)
大白菜〔Brassica campestrisL. ssp.pekinensis(Lour)Olsson〕,属十字花科(Cruciferae)芸薹属(Brassica)。主要分布于中国北方各地,供秋冬及春季食用,其中以华北地区栽培面积最大,其栽培面积和产量居各种蔬菜之首。但是随着连作年限增加,大白菜生产中的病害在我国各大白菜种植区普遍发生,并呈现逐年加重的趋势。
2011年1月对北京、河北、江苏等地多个大白菜种植基地进行病害调查,发现大白菜上普遍出现不同程度的茎基腐烂症状,当地俗称“茎基腐病”。病菌常自靠近地面的叶柄处侵入,严重发生时,60%~70%的大白菜茎基部有此症状,严重影响了大白菜的商品价值,给生产者造成了一定的经济影响。调查分析发现,造成该病害严重发生的主要原因是管理者对大白菜“茎基腐病”的发生规律和病原菌不了解,针对这一现状,本试验对这些地区大白菜“茎基腐病”在病原菌分离的基础上,进行形态学、分子生物学鉴定和致病性测定试验,旨在为大白菜“茎基腐病”的防治提供理论依据。
1 材料与方法
1.1 病样采集及症状观察
2011年1月在北京、河北、江苏等地进行大白菜病害发生情况调查,发现当地俗称的大白菜“茎基腐病”普遍发生,采集病样标本12份,并进行病样症状描述和照片采集。
1.2 病原菌的分离及形态学鉴定
用常规根腐病菌的分离方法(方中达,1998)进行病原菌分离培养:在病样茎基部病健交界处剪取10 mm2的组织块,75%的酒精消毒30 s,无菌水漂洗3次,无菌吸水纸吸干,接种在PDA培养基上,25 ℃条件下培养2 d后,纯化培养,菌种4 ℃下甘油中冷冻保存。分离到的菌株转接到PDA培养基上,25 ℃黑暗条件下培养4 d,观察菌落形态特征,并在显微镜下进行观察,拍照记录。
1.3 分子生物学鉴定
1.3.1 DNA提取 形态学研究表明,分离得到的12个菌株培养特征和显微特征均一致。随机选取3个菌株转接到PD液体培养基中,28 ℃震荡培养7 d,无菌纱布过滤培养液,收集菌丝体,高压抽滤后冻干,基因组DNA采用郭新梅等(2005)的改良CTAB法提取。
1.3.2 rDNA-ITS序列扩增及测序 采用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTA TTGATATGC-3′)对分离物进行 PCR扩增。扩增反应在 S1000 Thermal Cycler PCR仪(BIO-RAD)上进行。反应体系为 20 μL:4 μL10×PCR Buffer反应缓冲液,2 μL 0.2 mmo1·L-1dNTPs,2 μL 10 μmo1·L-1的 1对引物,1 μL 250 ng模板 DNA,0.5 μL 5 UTaqDNA聚合酶和10.5 μL ddH2O。反应条件:94 ℃预变性4 min;每个循环94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸1 min,35个循环;72 ℃延伸10 min,最后在4 ℃停止反应。产物经1.0%琼脂糖凝胶电泳,goldview染色,经凝胶成像系统检测拍照。将扩增的 PCR产物进行测序(测序单位:中国农业科学院作物研究所),将获得的序列在GenBank的核酸序列库中进行同源性比对。
1.4 致病性测定
根据柯赫氏法则,采用贴菌片接种法对分离得到的菌株进行致病性测定,致病性试验选择在中国农业科学院蔬菜花卉研究所温室中进行。病原菌在PDA培养基上培养4 d后,用打孔器打取直径为0.5 cm的菌丝块,贴到大白菜幼苗茎基部。每个菌株接种9株大白菜幼苗,设贴不含病原菌的PDA培养基块的植株为空白对照。接种后植株保湿48 h,之后转入26~32 ℃温室中进行培养,接种3 d后进行病害发生情况调查,并自发病部位重新采集病样进行病原菌的分离和鉴定。
2 结果与分析
2.1 病害症状及病原菌分离结果
2011年1月,北京、河北、江苏等地大白菜种植区出现不同程度大白菜茎基腐烂症状,植株发病后,靠近地面的叶柄首先表现病症,发病初期在叶柄上形成浅黄褐色或浅紫灰色小斑,病斑逐渐扩大,呈黄褐色、紫灰色至暗褐色,椭圆形至不规则形,病斑表面凹陷,内部组织腐败软化(图1)。从发病植株上共分离纯化得到12个菌株。

图1 立枯丝核菌引起的大白菜“茎基腐病”田间自然发病症状
2.2 病原菌的形态学鉴定
通过平板培养与显微观察表明,分离得到的12个菌株特征一致。25 ℃条件下,在PDA培养基上培养4 d,菌落浅黄色,平均直径为 (80.0±3.0)mm,菌丝稀疏,蛛丝状,边缘规则,初期菌落无色,后期逐渐变为浅黄褐色至褐色,菌落表面产生深褐色的小菌核,菌核直径1.5~5.0 mm。菌丝粗3.0~7.0 μm,分枝处缢缩,离分枝不远处形成一隔膜(图2)。参考植物病原真菌学(陆家云,2000)和真菌鉴定手册(魏景超,2004),病原菌形态学鉴定分离到的病原菌为立枯丝核菌(Mccabe et al.,1999)。
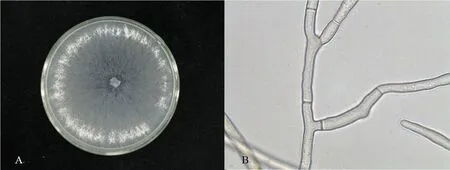
图2 病原菌培养和显微特征
2.3 ITS序列分析
用rDNA-ITS通用引物ITS1/ITS4对菌株R1、R7、R9基因组DNA进行PCR扩增,均得到大小为500~600 bp的单一片段(图3)。将扩增产物进行测序。然后将获得的3个菌株序列在NCBI上进行 BLAST分析,与立枯丝核菌Rhizoctonia solani菌株的相似性为 99%~100%。结果表明,供试 3个菌株均为立枯丝核菌Rhizoctonia solani,以分离物R7序列为代表序列提交到 GenBank,获得登录号为JX137115。
2.4 致病性测定结果
3个菌株分别接种大白菜幼苗,7 d后植株表现出明显的发病症状,发病初期产生水浸状浅褐色略凹陷的小斑,进一步扩展形成椭圆形至不规则形凹陷坏死病斑,病斑浅褐色,坏死腐烂状。接种症状与田间自然发病症状一致,对照植株生长正常,无病害症状(图4)。剪取病健交界处的发病组织进行病原菌的重新分离鉴定,所有发病植株均能分离到接种病原菌,进一步证明在北京、河北、江苏地区发生的大白菜“茎基腐病”的病原菌为立枯丝核菌Rhizoctonia solani。
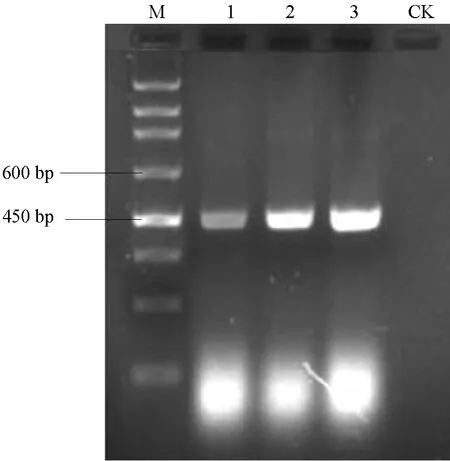
图3 引物ITS1/ITS4扩增菌株总DNA凝胶电泳图

图4 人工接种大白菜幼苗7 d后植株发病情况
3 结论与讨论
大白菜在我国的栽培历史悠久,北方各地广泛种植,是我国广大消费者喜食的重要蔬菜。2011年,在北京、河北、江苏等地的部分大白菜种植区,当地俗称的大白菜“茎基腐病”普遍且严重发生,引起大白菜茎基部腐烂,严重影响了大白菜的产量和品质。在生产中由于对该病害的发生规律及病原情况不了解,导致无法进行及时有效的防治。本试验通过形态学、分子生物学和致病性鉴定等手段对大白菜“茎基腐病”病原菌进行鉴定,以期为该病害的防治和抗病育种奠定理论基础。
对采集到的不同地区的病样标本经病原菌分离鉴定和致病性检测,并将传统真菌形态学鉴定方法与现代分子生物学方法相结合,确定了在我国北京、河北、江苏等地大白菜“茎基腐病”的病原菌为立枯丝核菌Rhizoctonia solani,该病害与大白菜褐腐病病原菌相同,属同病异名。由立枯丝核菌引起的大白菜病害发生流行和造成的损失都较小,国内外研究也相对较少(da Silveira et al.,2000;Zhang et al.,2009)。因此,命名存在较大差异,给病害的鉴定和有效防治造成了较大困难。李明远等(1986)将由立枯丝核菌Rhizoctonia solani引起的大白菜病害命名为大白菜立枯病,吕佩珂等(1992)将由立枯丝核菌Rhizoctonia solani引起的大白菜病害命名为大白菜褐腐病,张丽(2008)将由立枯丝核菌Rhizoctonia solani引起的甘蓝病害命名为球腐病。立枯丝核菌Rhizoctonia solani是一类寄主范围广泛的土传病原菌(Liu et al.,2011)。目前,国内外已经报道的寄主包括:水稻、棉花、高粱、茄子、马铃薯、甜菜、瓜类、甘蓝等(Camporota &Perrin,1998;Botha et al.,2003;Atkinson et al.,2011)。
2011年,在北京、河北、江苏的部分地区由立枯丝核菌引起的大白菜“茎基腐病”普遍严重发生,田间发病严重时,病株率高达90%以上,对生产造成了较大影响。本试验通过相关研究最终确定在北京、河北、江苏等地俗称大白菜“茎基腐病”的病原菌为立枯丝核菌Rhizoctonia solani,大白菜“茎基腐病”与大白菜立枯病、褐腐病均属同病异名。
方中达.1998.植病研究方法.3版.北京:中国农业出版社.
郭新梅,康冀川,张杰.2005.CTAB法在金黄色葡萄球菌DNA提取中的应用.山地农业生物学报,24(6):558-560.
李明远,李固本,裘季燕.1986.北京蔬菜病情志.北京:北京科学技术出版社.
陆家云.2000.植物病原真菌学.北京:中国农业出版社.
吕佩珂,李明远,吴钜文,易齐,张宝棣,姜克英,文奇,李明周,王润初.1992.中国蔬菜病虫原色图谱.北京:中国农业出版社.
魏景超.2004.真菌鉴定手册.上海:上海科学技术出版社.
张丽.2008.包菜立枯丝核菌球腐病的病原学研究〔硕士论文〕.武汉:华中农业大学.
Atkinson D,Thornton M K,Miller J S.2011.Development ofRhizoctonia solanion stems,stolons and tubers of potatoⅡ.Efficacy of chemical applications.American Journal of Potato Research,88:96-103.
Botha A,Denman S,Lamprecht S C,Mazzola M,Crous P W.2003.Characterization and pathogenicity ofRhizoctoniaisolates associated with black rot of strawberries in the Western Cape Province,South Africa.Australasian Plant Pathology,32:195-201.
Camporota P,Perrin R.1998.Characterization ofRhizoctoniaspecies involved in tree seedling damping-off in French forest nurseries.Applied Soil Ecology,10:65-71.
da Silveira S F,Alfenas A C,Ferreira F A,Sutton J C.2000.Characterization ofRhizoctoniaspecies associated with foliar necrosis and leaf scorch of clonally-propagated Eucalyptus in Brazil.European Journal of Plant Pathology,106:27-36.
Liu T H,Lin M J,Ko W H.2011.Development of artificial conidia for ecological studies ofRhizoctonia solaniin soil.New Biotechnology,28(1):86-91.
Mccabe P M,Gallagher M P,Deacon J W.1999.Microscopic observation of perfect hyphal fusion inRhizoctonia solani.Mycological Research,103(4):487-490.
Zhang C Q,Liu Y H,Ma X Y,Feng Z,Ma Z H.2009.Characterization of sensitivity ofRhizoctonia solani,causing rice sheath blight to mepronil and boscalid.Crop Protection,28:381-386.

