RP-HPLC法测定人全血中环孢素的浓度
宋和梅(连云港市第一人民医院药学部,江苏连云港 222002)
环孢素A(Cyclosporine A,CsA)具有强大的免疫抑制作用,主要用于器官移植术后的抗排异治疗和预防,由于其治疗窗狭窄、药动学个体差异大,临床应用需要对其实施治疗药物监测,优化给药方案,减少其毒副反应的发生,提高移植的成功率。当前,监测CsA血药浓度的分析方法主要是免疫分析(IA)法和高效液相色谱(HPLC)法。IA法主要包括荧光偏振免疫(FPIA)法、酶放大免疫分析(EMIT)法和放射免疫分析(RIA)法。RIA法因放射性污染、特异性较差已少用;FPIA法由于操作简便、快捷被临床广泛使用,近期因试剂供应问题国内已停止使用;与此同时,EMIT法得到了快速推广,但EMIT法试验条件苛刻,试剂的稳定性和重复性不及FPIA法。本试验建立了快速、灵敏、准确、实用的全血CsA浓度HPLC分析方法,以满足CsA治疗药物监测的需要。
1 材料
1.1 仪器
Waters高效液相色谱仪,包括600E四元梯度泵、在线脱气机、柱温箱、996二极管阵列检测器、Empower色谱工作站、Empower System Suitability软件(美国Waters公司);Milli-Q超纯水器(美国密里博公司);AE240电子分析天平(瑞士Mettler公司);MS2振荡器(德国IKA公司);干热式样品浓缩器(美国Pierce公司);TDL80-2B台式离心机(上海安亭科学仪器厂);溶剂过滤器(天津市威仪科技发展有限公司);HP-01无油真空泵(天津市鑫洲科技有限公司)。
1.2 试药
CsA(纯度:99%)、环孢素D(CsD)(内标,纯度:95%)均为福建微生物研究所提供;甲醇、乙腈为色谱纯,乙醚(使用前重蒸)、氢氧化钠、盐酸、正己烷为分析纯,水为超纯水。
2 方法与结果
2.1 色谱条件
色谱柱:Nova-pak C1(8150 mm×3.9 mm,4 μm);流动相:乙腈-甲醇-水(30.8∶51.2∶18);流速:1 mL·min-1;柱温:55℃;检测波长:210 nm;进样量:20 μL;内标:CsD。在该色谱条件下,CsA、CsD保留时间分别约为4.5、5.6 min,CsA理论板数>1028,对称因子为1.032,容量因子为3.538,与CsD分离良好,分离度(Rs)为1.507,无杂峰干扰。高效液相色谱见图1。
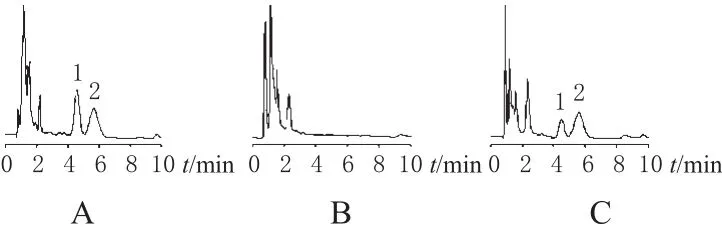
图1 高效液相色谱图A.标准血样;B.空白血样;C.患者血样;1.CsA;2.CsDFig 1 HPLC chromatogramA.standard blood sample;B.blank blood sample;C.blood sample of patients;1.CsA;2.CsD
2.2 溶液的配制
2.2.1 流动相的配制:按30.8∶51.2∶18体积比例分别量取乙腈、甲醇、超纯水适量,混匀,用0.45 μm孔径的滤膜真空抽滤,得上述比例的乙腈-甲醇-水流动相,使用前超声脱气10 min备用。
2.2.2 工作溶液:快速称取氢氧化钠1.0 g置于1 000 mL容量瓶中,加超纯水溶解并稀释至刻度,摇匀,配成浓度为0.025 mo1·L-1的氢氧化钠溶液备用。另精密量取36.5%的浓盐酸2.5 mL置于1 000 mL容量瓶中,加超纯水至刻度,摇匀,配成浓度为0.025 mo1·L-1的盐酸溶液备用。
2.2.3 标准溶液:准确称取CsA1.94 mg置于25 mL容量瓶中,加甲醇适量溶解并稀释至刻度,摇匀;精密吸取2 mL于50 mL容量瓶,加甲醇至刻度,摇匀,配成浓度为3.1 μg·mL-1的标准溶液使用,冰箱保存备用。
2.2.4 内标溶液:准确称取CsD 10.54 mg置于50 mL容量瓶中,加甲醇适量溶解并稀释至刻度,摇匀;精密吸取5 mL于50 mL容量瓶中,加甲醇至刻度,摇匀,配成浓度为21 μg·mL-1的内标溶液,冰箱保存备用。
2.2.5 标准含药全血:分别精密吸取CsA标准溶液50、100、200、400、800、1 500 μL,吹干,加空白全血3.0 mL,配成浓度为51.67、103.33、206.67、413.33、826.67、1 550.00 ng·mL-1的含药全血。
2.3 血样采集
79例移植患者,行CsA谷浓度(c0)或峰浓度(c2)常规监测。c0于清晨服药前半小时内、c2于清晨服药后(120±15)min内采静脉血4 mL于肝素抗凝试管中,供CsA血药浓度测定使用。
2.4 样品处理
取含药全血3.0 mL,加CsD内标溶液100 μL、0.025 mol·L-1氢氧化钠溶液3.0 mL,混匀,用乙醚萃取3次(4、3、3 mL),每次离心(3 500 r·min-1)4 min,合并乙醚萃取液,吹干;残渣加甲醇、0.025 mol·L-1盐酸溶液各1.0 mL,复溶;复溶液用正己烷萃取2次(3、3 mL),每次离心(3 500 r·min-1)3 min,弃上层正己烷,水层加0.025 mol·L-1氢氧化钠溶液2.0 mL,混匀;再用乙醚萃取水层2次(3、3 mL),每次离心(3 500 r·min-1)3 min,合并乙醚萃取液,吹干;用流动相100 μL复溶,20 μL进样。
2.5 标准曲线的制备
分别精密吸取标准含药全血3.0 mL,按“2.4”项下方法操作,记录色谱。以CsA浓度(c)对CsA与CsD峰面积比值(y)作线性回归,得回归方程:c=411.71y+6.30(r=0.999 9)。结果表明,CsA浓度在50~1 550 ng·mL-1范围内线性关系良好。
2.6 回收率及精密度试验
分别精密吸取标准含药全血3.0 mL,按“2.4”项下方法操作,分别于当日和连续6 d内测定CsA浓度,计算回收率及日内、日间RSD。另取上述含药全血3.0 mL,同法测定,计算CsA与内标CsD的峰面积比值Y1;取3.0 mL空白全血6份,按”2.4”项下方法操作,止于“用流动相100 μL复溶”前,在6支尖底试管中分别加CsA标准溶液50、100、200、400、800、1 500 μ L,吹干,用流动相100 μL复溶进样,计算CsA与内标CsD的峰面积比值Y2;计算CsA提取回收率(Y1/Y2×100%)。回收率及精密度试验结果见表1。
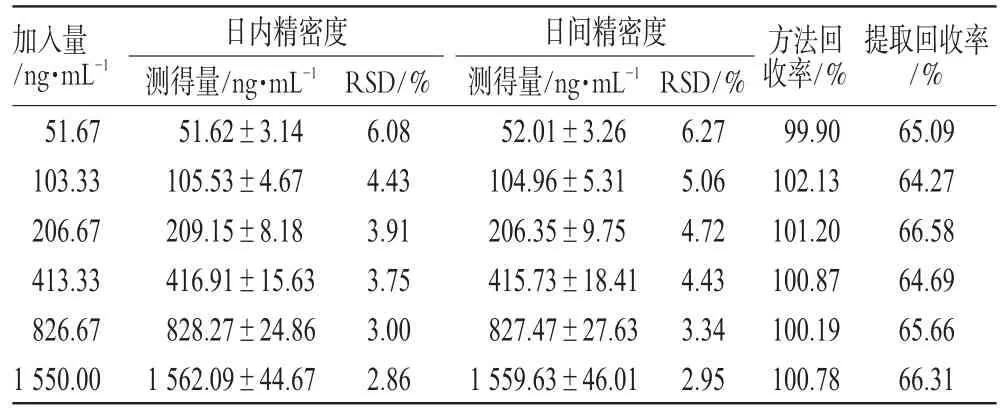
表1 回收率及精密度试验结果Tab 1 Results of recovery and precision tests
2.7 稳定性考察
取标准含药全血分别于室温存放0、6、24、72 h后测定CsA浓度,结果RSD<6%(1.95%~5.98%,n=6),表明样本室温存放72 h对CsA测定结果没有影响(P>0.05),即样本在室温存放72 h是稳定的。
2.8 干扰试验
将移植患者常用的药物,如泼尼松、泼尼松龙、甲泼尼龙、氢化可的松、硫唑嘌呤、霉酚酸酯(骁悉)、地尔硫、硝苯地平、酮康唑、头孢唑林、阿莫西林等加入空白全血中,使成适当浓度,按“2.4”项下方法操作,结果上述药物均不干扰全血中CsA的分离与测定。
2.9 CsA全血浓度监测
对79例移植患者413次全血浓度监测,其中肾移植36例,肝移植26例,骨髓移植17例,年龄33~62岁。测得c2(858.17±410.98)ng·mL-1(n=144),范围为269.13~2 365.80 ng·mL-1,c0测得254.77±134.98 ng·mL-1(n=269),范围为38.13~785.60 ng·mL-1。
3 讨论
乙醚对CsA萃取效率最高[1],但分析纯乙醚含有较多的过氧化物等杂质,直接使用对色谱图产生严重干扰,以致于使测定无法进行,且不同厂家和不同批次间存在差异,重蒸后杂峰消失,使色谱图得以净化,减少对色谱柱的污染[1,2]。因此,使用重蒸乙醚非常关键。
李海菊等[1]认为样品中水的含量是影响CsA萃取回收率的主要因素,水含量越高,萃取回收率越低,故样品处理时尽量少加含水的试液。如果对“2.4”项下含水试剂氢氧化钠溶液和盐酸溶液的浓度进行优化,减少使用体积,CsA提取回收率可能会更高。CsA不溶于正己烷,在酸性条件下用正己烷洗涤乙醚提取物,能够去除乙醚提取物中脂溶性干扰物,纯化样品[3]。冯惠平等[4]发现随盐酸浓度的增大,正己烷的脱脂去除杂质能力增强,色谱图杂峰更少。
分析CsA血药浓度的HPLC法绝大多数使用反相高效液相色谱法,常用色谱柱有C18、C8和氰基柱,氰基柱所需柱温较低(55 ℃)[1],C8柱次之(60 ℃),C18柱较高(60~72 ℃)[2~4],方能获得较好的柱效,但柱温太高可加速色谱柱硅胶键合相的断裂,使柱效下降,缩短色谱柱的寿命。笔者观察了温度对CsA和CsD色谱行为的影响,发现升高柱温保留时间稍有减少,但峰形和分辨率改善有显著意义,在55℃时就能获得满意的峰形和分辨率,且有利于色谱柱的保护,降低分析成本。然而,样品上柱运行时间不能<10 min,因为在8.4、9.6、12.3 min时各有一个内源性杂质峰,测定时应避开。
本法经临床79例移植患者413次全血CsA浓度监测验证,本法具有稳定性好、线性范围宽、柱温低、灵敏准确、简便快速的特点,非常适合临床CsA治疗药物监测和药动学研究。
[1]李海菊,杨 娟,王 峰,等.RP-HPLC测定全血中环抱素A[J].中国药学杂志,2005,40(11):857.
[2]李碧峰,冯惠平,贾晋蓉,等.反相高效液相色谱法测定全血中环抱素的浓度[J].中国药师,2007,10(7):649.
[3]李 航,胡正波,魏志奇.反相高效液相色谱法测定环孢素A的血药浓度[J].中国药业,2009,18(15):9.
[4]冯惠平,李碧峰,陈宜锋,等.改良RP-HPLC测定全血中环孢素A的浓度[J].中国现代应用药学,2010,27(5):433.

