姜黄素对非酒精性脂肪肝家兔血脂及肝组织PPAR-γ水平的影响
周玲玲 林琼琼 周伶俐 祁旦巳 赵志光 温州医学院附属第二医院病理科 温州 325000
非酒精性脂肪肝病(nonalcoholicfattyliver disease,NAFLD)包括单纯性脂肪肝、脂肪性肝炎(nonalcoholic steatohepatitis,NASH)和脂肪性肝硬化,在肥胖者中的患病率为50%,NALFD是导致临床“隐源性肝酶升高”的最常见原因之一,并且和临床至少20%原因不明的肝硬化病例密切相关[1]。脂质代谢紊乱、胰岛素抵抗(insulin resistance,IR)、线粒体功能紊乱、氧化应激/脂质过氧化损伤、细胞因子和炎症介质增生、内毒素损伤以及肝脏金属离子沉积是引起NAFLD发生的主要危险因素[2]。近年研究证实,姜黄素具有抗炎、抗氧化、抗凝血、降血脂、抗动脉粥样硬化和抗肿瘤等作用[3]。本研究建立NAFLD家兔模型,观察姜黄素对NAFLD家兔血脂、胰岛素抵抗指数及肝组织PPAR-γ水平的影响。
1 实验材料
1.1 动 物 日本大耳白家兔50只,雄性,2~3月龄,体质量1.8~2.2kg,由温州医学院动物实验中心提供,并在该动物实验中心饲养。动物合格证号:浙医动字2200300002。
1.2 药 物 姜黄素(纯度100%)由神威药业有限公司提供,用1%羧甲基纤维素钠配成100mg总姜黄素/mL的液体备用。
1.3 试 剂 即用型PPAR-γ多抗及SABC试剂盒(批号KIT7710)购自福州迈新生物技术有限公司。
2 实验方法
2.1 NAFLD模型复制 50只日本大耳白家兔,给予基础颗粒饲料适应性喂养1周。随机选取10只家兔作为正常对照组继续给予基础饲料喂养,其余40只给予高脂饲料(高脂饲料组成:84%基础饲料、10%猪油、5%红糖、1%胆固醇,由第二军医大学免疫学研究所提供),单笼喂养,每天每兔进食量为150g,饮水不限。造模过程中兔子死亡2只,2个月后随机抽取4只家兔处死,NAFLD模型组与正常对照组比较,TG、TC和LDL-C都显著升高,说明已经出现脂肪代谢紊乱;取肝组织病理检查,4只家兔均表现出中重度的脂肪变性,说明NAFLD模型成功建立。余34只NAFLD模型家兔随机分成NAFLD组和姜黄素组,各17只。
2.2 给 药 NAFLD组和姜黄素组家兔继续给予基础颗粒饲料喂养,每天150g。姜黄素组每天按200mg/kg[4-6]体质量给予姜黄素混悬液灌胃;NAFLD组和正常对照组每天给予同容积的生理盐水灌胃;每周称体质量1次,根据体质量调整给药量,持续治疗1个月。实验周期共3个月。实验结束时颈动脉放血处死动物,采血分离血清,部分肝组织于液氮中速冻后保存于-80℃冰箱,以备常规病理检查及免疫组化测定。
2.3 检测指标及方法
2.3.1 血脂、胰岛素抵抗指数(HOMA-IR)测定 第2个月末 (即姜黄素治疗前)禁食12h后,取家兔耳缘静脉采血2mL;第3个月末(即姜黄素治疗1个月后)禁食12h,采心脏血2mL。全自动生化检测仪测定血清 TG、TC、HDL-C、LDL-C、HOMA-IR。
2.3.2 肝组织PPAR-γ表达 采用免疫组织化学SABC法,操作步骤参照说明书,用已知阳性片作为阳性对照,用PBS缓冲液液取代一抗作为阴性对照。PPAR-γ阳性表达主要以细胞质呈棕黄色或棕褐色者为准,分析采用IPP软件计算平均吸光密度值[Density(mean)]。
3 实验结果
3.1 一般情况 在姜黄素药物治疗期间,因灌胃导致姜黄素组1只家兔死亡,NAFLD组1只家兔因肢体偏瘫最终死亡。实验开始前、第2个月末和第3个月末,两组家兔体质量差异无统计学意义(P>0.05)。
3.2 血脂比较 治疗前两组家兔血浆TG、TC、LDLC、HDL-C 比较,差异无统计学意义(P>0.05),与正常对照组比较差异均有统计学意义(P<0.01);治疗后姜黄素组各项血脂指标均有不同程度改善,TG、TC、LDL-C 降低(P<0.01),HDL-C 升高(P<0.05);NAFLD改喂基础颗粒饲料后血脂指标亦有不同程度改善,TG 降低(P<0.05),TC、LDL-C 降低(P<0.01)。与NAFLD组比较,姜黄素组治疗后TC、LDL-C、TG明显降低(P<0.05),HDL-C 升高(P<0.05),见表1。
3.3 HOMA-IR、肝组织PPAR-γ蛋白表达比较 治疗前两组HOMA-IR、PPAR-γ蛋白表达比较,差异无统计学意义(P>0.05),与正常对照组比较有统计学意义(P<0.01);治疗后,姜黄素组 HOMA-IR 显著降低,PPAR-γ蛋白表达显著增高,与NAFLD组比较,差异有统计学意义(P<0.05),见表2。
表1 血脂水平比较(±s) mmol/L
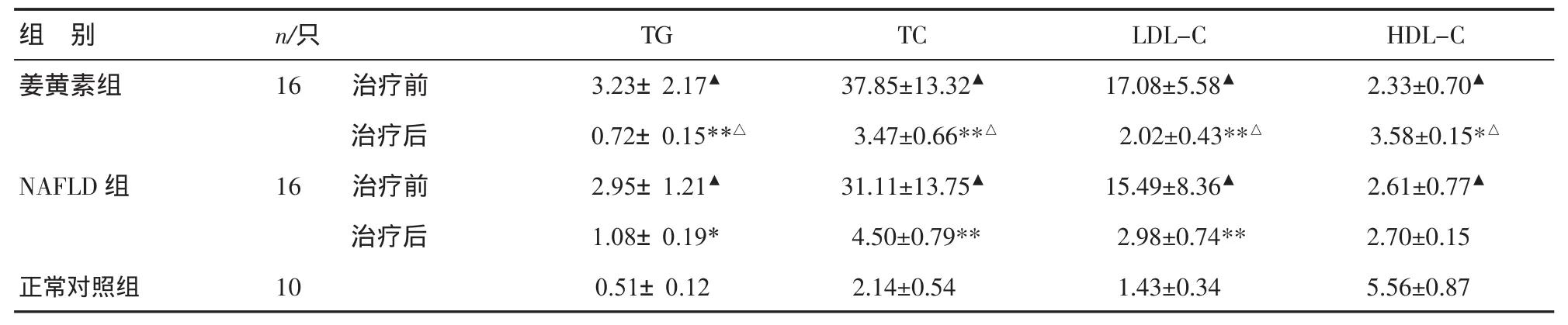
表1 血脂水平比较(±s) mmol/L
注:与正常对照组比较,▲P<0.01;与治疗前比较,*P<0.05,**P<0.01;与 NAFLD组比较,△P<0.05
组 别姜黄素组n/只16 治疗前治疗后NAFLD组 16 治疗前治疗后正常对照组 10 TG 3.23±2.17▲0.72±0.15**△2.95±1.21▲1.08±0.19*0.51±0.12 TC LDL-C HDL-C 37.85±13.32▲ 17.08±5.58▲ 2.33±0.70▲3.47±0.66**△ 2.02±0.43**△ 3.58±0.15*△31.11±13.75▲ 15.49±8.36▲ 2.61±0.77▲4.50±0.79** 2.98±0.74** 2.70±0.15 2.14±0.54 1.43±0.34 5.56±0.87
表2 各组胰岛素抵抗指数和PPAR-γ蛋白比较(±s)
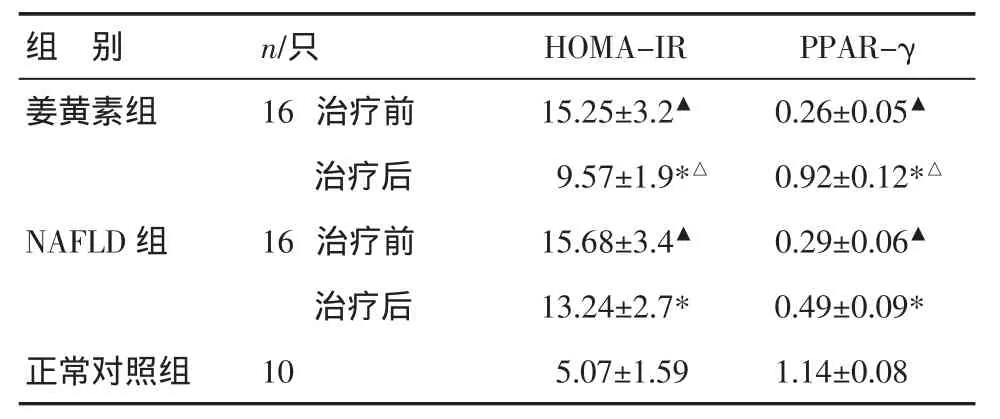
表2 各组胰岛素抵抗指数和PPAR-γ蛋白比较(±s)
注:与正常对照组比较,▲P<0.01;与治疗前比较,*P<0.05;与 NAFLD组比较,△P<0.05
组 别 n/只姜黄素组 16治疗前治疗后PPAR-γ 0.26±0.05▲0.92±0.12*△NAFLD组 16 治疗前 15.68±3.4▲ 0.29±0.06▲治疗后 13.24±2.7* 0.49±0.09*正常对照组 10 5.07±1.59 1.14±0.08 HOMA-IR 15.25±3.2▲9.57±1.9*△
3.4 肝脏病理学 造模2个月后,正常对照组家兔肝色鲜红,边缘锐利,质软,HE染色显示肝组织无明显脂肪沉积,肝小叶结构正常。造模2个月后姜黄素组、NAFLD组以及治疗后NAFLD组家兔均呈中-重度脂肪肝,肉眼见肝脏体积增大、色黄、边缘变钝、质脆、切面带油腻感。为全小叶内肝细胞脂肪变,肝细胞索排列紊乱。与NAFLD组比较,治疗后姜黄素组家兔脂肪变明显减轻,仅见轻度脂肪变性,差异有统计学意义(P<0.05),见表3。
表3 各组家兔肝脏脂肪变结果比较(±s)
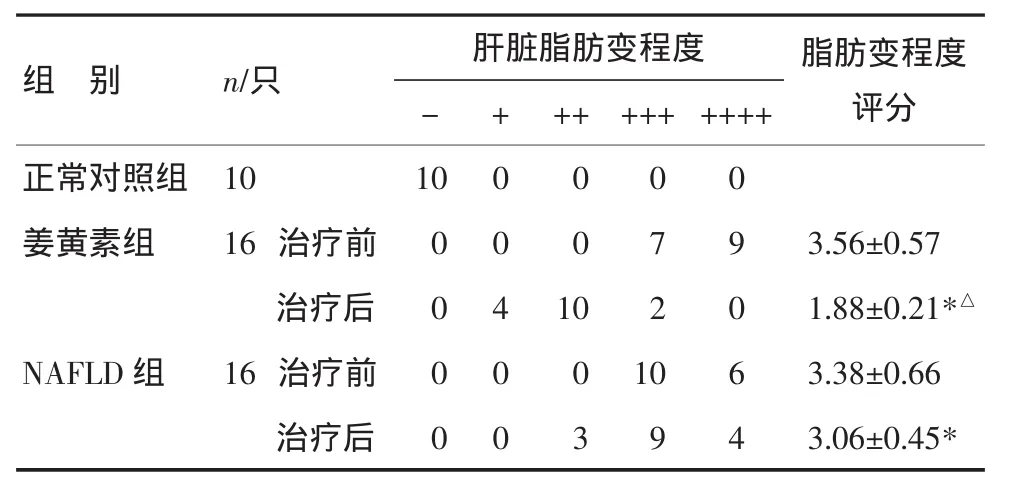
表3 各组家兔肝脏脂肪变结果比较(±s)
注:与治疗前比较,*P<0.05;与 NAFLD组比较,△P<0.05
组 别 n/只++ +++++++0 0 0 0 7 9 3.56±0.57 10 2 0 1.88±0.21*△0 10 6 3.38±0.66 3 9 4 3.06±0.45*肝脏脂肪变程度-10+ 0 0 0脂肪变程度评分正常对照组 10姜黄素组 16治疗前 0治疗后 0 0 4 NAFLD组 16治疗前 0治疗后 0
4 讨论
NALFD的发病机制至今尚未明确,有关发病学说较多,其中最为成熟的是“二次打击”学说[7],第一次打击为各种原因如肥胖、胰岛素抵抗、脂质代谢紊乱导致的胰岛素抵抗、游离脂酸增加、肝脏脂肪代谢障碍,从而使肝细胞合成甘油三酯增加而输出减少,肝细胞脂肪变性。第二次打击是在第一次打击的基础上,出现氧化应激和脂质过氧化,线粒体功能失调,呼吸链复合物活性降低,活性氧(reactive oxygen species,ROS)生成增加,呼吸链中传递电子的能力降低,ATP生成受阻。同时,大量的ROS使呼吸链中的抗氧化剂被耗竭,体内氧自由基增多,形成恶性循环,形成进展性肝纤维化甚至肝硬化。
过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptor,PPAR)是一类由配体激活的核转录因子,属于核受体超家族成员,存在3种亚型:PPAR-α、PPAR-β、PPAR-γ。PPAR-γ 参与调节机体能量稳态和脂质稳态,在脂细胞的分化中PPAR-γ具有不可缺少的作用[8],其作为催化脂肪酸氧化的关键酶可调节脂肪酸代谢的各个环节,增加脂肪酸转运蛋白和脂肪酸转运酶的表达,刺激细胞对脂肪酸的摄入和向脂酰CoA转化[9],同时,PPAR-γ参与肝内甘油三酯的平衡代谢,并抑制体内其他脏器甘油三酯的沉积,被认为是脂肪细胞系统调节的总开关。IR是NAFLD发生及发展的中心环节。He等[10]研究报道,脂肪组织 PPAR-γ基因敲除可导致脂肪细胞减少和肥大、血 FFA和 TG升高、肝脏IR和脂肪肝的发生增加。有学者应用PPAR-γ激动剂治疗NASH患者后观察到肝组织病理中大泡性脂变及Mallory小体的数量明显减少,细胞内含晶线粒体数量则明显增加,PPAR-γ可能改善肝细胞线粒体的功能[11]。
本实验结果证实,NAFLD模型家兔经过姜黄素治疗后,肝脏脂肪变性逆转,血浆TC、TG、LDL-C显著降低;血浆HDL-C升高,与国内外研究相似[12-13]。姜黄素治疗后,NAFLD模型家兔HOMA-IR明显减低,PPAR-γ蛋白表达明显增强,说明姜黄素对NAFLD有治疗作用。姜黄素可能通过改善IR,纠正脂代谢紊乱等,逆转NAFLD模型家兔的肝脂肪变性和肝功能异常。姜黄素可能通过上调PPAR-γ的表达,催化脂肪酸氧化减少游离脂肪酸(free fatty ascid,FFA)含量,从而减少超氧阴离子和活性氧(reactive oxygen species,ROS)的生成,抑制 β-氧化,纠正体内氧化和抗氧化失衡状态,改善线粒体功能,促进ATP合成,减轻二次打击,减轻脂肪变性程度。
[1]Neuschwander-Tetri BA,Caldwell SH.Nonalcoholic steatohepatitis:summary of an AASLD Single Topic Conference[J].Hepatology,2003,37(5):1202-1219.
[2]Adams LA,Angulo P,Lindor KD.Nonalcoholic fatty liver disease[J].CMAJ,2005,172(7):899-905.
[3]王春彬,高大中.姜黄素的研究进展以及在心血管疾病中的应用[J].心血管病学进展,2005,26(6):614-616.
[4]林梅瑟,杨德业,赵志光,等,姜黄素对动脉粥样硬化兔血脂和血管内皮功能的影响[J].心脑血管病防治,2007,7(2):89-91.
[5]沃兴德,洪行球,高承贤.姜黄素最大耐受量试验[J].浙江中医学院学报,2000,24(2):55.
[6]沃兴德,洪行球,高承贤,等,姜黄素长期毒性试验[J].浙江中医学院学报,2000,24(1):61.
[7]Day CP,James OF.Steatohepatitis:a tale of two"hits"[J].Gastroenterology,1998,114(4):842-845.
[8]Tzameli I,Fang H,Ollero M,et al.Regulated production of a peroxisome proliferator-activated receptor-γ ligand during an early phase of adipocyte differentiation in 3T3-L1 adipocytes[J].Journal of Biological Chemistry,2004,279(34):36093-36102.
[9]Khan SA,Vanden Heuvel JP.Role of nuclear receptors in the regulation ofgene expression by dietary fatty acids[J].J Nurti Biochem,2003,14(10):554-567.
[10]He W,Barak Y,Hevener A,et al.Adipose-specifid peroxisomeproliferator-activate receptor γ knockout causes insulin resistance in fat and liber but not in muscle[J].Proc Natl Acad Sci USA,2003,100(26):15712-15717.
[11]Caldwell SH,Patrie JT,Brunt EM,et al.The effects of 48 weeks ofrosiglitazone on hepatocyte mitochondria in human nonalcoholicsteatohepatitis[J].Hepatology,2007,46(4):1101-1107.
[12]Arafa HM.Curcumin attenuates diet-induced hypercholesterolemiain rats[J].Med Sci Monit,2005,11(7):BR228-234.
[13]沃兴德,洪行球,赵革平,等.姜黄素对低密度脂蛋白和脂蛋白代谢的影响[J].中国动脉粥样硬化杂志,1999,7(4):339-341.

