均匀设计法优选柿叶总黄酮的提取工艺Δ
陈丽,韦敏(1.柳州医学高等专科学校药学教研室,广西柳州545005;.柳州市人民医院药剂科,广西柳州 545005)
柿叶为柿树科柿树属植物柿的新鲜或干燥叶,主要有效成分是黄酮类化合物。柿叶黄酮具有显著的降血压作用,已用于冠心病、心绞痛的治疗,是很有前途的天然降血压药[1]。柿叶中的黄酮类化合物主要以苷类形式存在,传统提取时多采用水、甲醇、乙醇作溶剂,乙酸乙酯作萃取剂,但得率较低。本文用均匀设计法对柿叶黄酮乙醇提取工艺进行改进,为进一步研究和开发柿叶医药保健品提供工艺参考。
1 仪器与试药
722可见分光光度计(上海精密科学仪器有限公司);JA1003电子天平(上海天平仪器厂);RE-52旋转蒸发仪(上海安亭实验仪器有限公司);WBZ-2微波真空干燥机(贵阳新奇微波工业有限责任公司);离心沉淀机(上海医用分析仪器厂);KQ-100DB数控超声波清洗器(昆山超声仪器有限公司)。
柿叶(购自广西柳州城站药材综合市场,经中国科学院广西植物研究所韦发南研究员鉴定为真品);芦丁标准品(南京替斯艾么中药研究所,批号:TCM027-071128,含量:99%);其他试剂均为分析纯。
2 方法与结果
2.1 柿叶总黄酮的含量测定[2]
2.1.1 标准品溶液的制备 精密称量105℃下干燥至恒重的芦丁标准品10 mg,置于50 mL容量瓶中,加50%乙醇溶解并稀释至刻度,摇匀,即得浓度为0.2 mg·mL-1的标准品溶液。
2.1.2 供试品溶液的制备 精密称取各种工艺制备的样品干燥粉末50 mg,加入50%乙醇定容至100 mL,超声(功率:100 W,频率:40 kHz)溶解30 min,摇匀,静置,冷却至室温,吸取上清液,即得浓度为0.5 mg·mL-1的供试品溶液。
2.1.3 标准曲线的制备 分别精密吸取0、1.0、2.0、3.0、4.0、5.0 mL标准品溶液,置于10 mL容量瓶中,加50%乙醇至10 mL,分别加5%NaNO2溶液0.3 mL,摇匀,放置6 min,加10%Al(NO3)3溶液0.3 mL,摇匀,放置6 min,加1%NaOH溶液4 mL,加50%乙醇稀释至刻度,摇匀,放置15 min,在510 nm波长处测定吸光度。以吸光度(A)对检测浓度(c)进行线性回归,得回归方程为c=0.179 4A-0.002 0(r=0.998 8)。结果表明,芦丁检测浓度在0.020~0.100 mg·mL-1范围内与吸光度呈良好的线性关系。
2.1.4 样品含量测定 精密吸取供试品溶液5.0 mL,共5份,分别置于50 mL容量瓶中,按“2.1.2”项下方法操作,得供试品待测液(浓度为0.05 mg·mL-1),分别测定吸光度,根据回归方程计算柿叶总黄酮的含量。
2.2 水提取法提取柿叶总黄酮[3,4]
干燥柿叶粗粉5 g→100 mL蒸馏水浸泡30 min→90℃提取2 h(2次)→合并滤液→离心(3 000 r·min-1)15 min→抽滤→滤液用微波真空干燥浓缩→石油醚萃取2次→水相用乙酸乙酯萃取2次→乙酸乙酯相减压浓缩→干燥,即得。
2.3 乙醇提取法提取柿叶总黄酮[4,5]
干燥柿叶粗粉5 g→100 mL70%乙醇浸泡30 min→80℃回流提取2 h(2次)→合并滤液并减压回收乙醇→离心(3 000 r·min-1)15 min→抽滤→滤液用石油醚萃取2次→水相用乙酸乙酯萃取2次→乙酸乙酯相减压浓缩→干燥,即得。
2.4 均匀设计法优选工艺
2.4.1 柿叶粉碎度的选择 取不同粒度干燥柿叶,在乙醇浓度为50%,提取温度为30℃,超声时间为30 min的条件下考察粒度(10~40、40~80、80~100目)对柿叶总黄酮含量的影响。结果,3种粒度范围下的柿叶总黄酮含量分别为43.66%、51.32%、47.48%,故本研究所取药材为过40~80目的干燥柿叶。
2.4.2 提取方法[6,7]采用碱溶酸沉与超声波相结合的方法。取过40~80目筛的干燥柿叶5 g,根据表1中各水平加入相应浓度和体积的乙醇,用超声设备在相应的时间和温度下提取,滤液用旋转蒸发仪减压回收乙醇,浓缩液加20%NaOH调至相应pH值,搅匀,静置1 h,抽滤,滤液用半倍量的石油醚萃取2次,水相加15%HCl调至相应pH值,搅匀,沉淀0.5 h,离心(3 000 r·min-1)15 min,抽滤,滤液用等体积的乙酸乙酯萃取3次,合并3次乙酸乙酯相,减压回收乙酸乙酯,最后干燥得总黄酮。
2.4.3 均匀设计及结果分析 根据预试验选取20%NaOH调pH值(X1)、15%HCl调pH值(X2)、乙醇浓度(X3)、超声温度(X4)、超声时间(X5)、液料比(X6)为考察因素,进行U10×(108)均匀试验,以柿叶总黄酮含量为评价指标,优选柿叶总黄酮提取工艺。因素水平见表1;均匀试验结果见表2。

表1 因素水平Tab 1 Factors and levels

表2 均匀试验结果Tab 2 Arrangement and results of uniform design
将表2结果输入均匀分析软件,进行多元二次多项逐步回归,得回归方程为Y=9.10E+3-727X1+2.81X2-1.39E-2X3+1.21 E-2X4+8.52 E-3X5-161X6,r=0.989 9,样本容量n=10,显著性水平α=0.05,检验值Ft=24.44,临界值F0.05(6,3)=8.941,Ft>F0.05(6,3),回归方程显著。剩余标准差s=1.08。各影响因素的标准回归系数见表3。
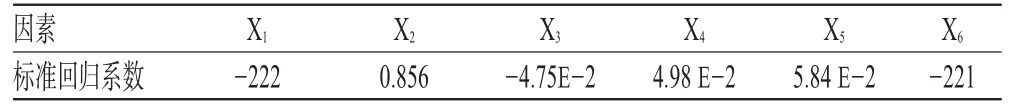
表3 各影响因素的标准回归系数Tab 3 Standardized regression coefficient of each influencing factors
多元回归中,标准回归系数显示,对柿叶总黄酮提取的影响效应依次为HCl调pH值>NaOH调pH值>液料比>超声时间>超声温度>乙醇浓度。对各因素进行显著性检验后得知,乙醇浓度、超声温度、超声时间对柿叶总黄酮的提取无显著性影响。依据实际经验,药材超声时间通常在24~40 min能获得最佳提取率,提取温度为40~60℃能保护有效成分,故将乙醇浓度定为70%,超声温度定为30℃,超声时间定为32 min。均匀试验结果显示,用15%HCl调pH值为6,用20%NaOH调pH值为9.78时总黄酮含量最高,这与预试验结果相符。但由于实际操作很难将pH值准确调至9.78,故定NaOH调pH值为10。液料比太小,溶液很快达到溶解饱和而不利于收率的提高;液料比过大,对收率没有较大影响,但溶剂量会大大增加[8],所以根据回归方程和实际经验,将液料比定为11∶1。综上所述,回归方程各项取值分别为 X1=10,X2=6,X3=70%,X4=32 min,X5=30 ℃,X6=11∶1。
2.4.4 验证试验 按上述优化的工艺制备3批样品,计算得柿叶总黄酮平均含量为68.77%,与回归方程预报值(64.1±2.09)%相近,且RSD=1.64%(n=3),说明重复性良好,所选工艺可行。
2.5 不同提取方法比较
按“2.2”、“2.3”、“2.4”项下方法分别提取柿叶总黄酮,计算各种方法下总黄酮含量,对3种方法进行比较,结果见表4。

表4 不同提取方法提取柿叶总黄酮效果比较(n=3)Tab 4 Comparison of the efficacy of different extraction methods in extracting total flavonoids from persimmon leaf(n=3)
3 讨论
柿叶黄酮类化合物在碱性环境中易溶,用20%NaOH调pH值为10是让尽可能多的黄酮溶解,防止在回收乙醇时黄酮类化合物随杂质析出而被滤除;用15%HCl调pH值为6的作用是除去杂质的同时让黄酮类化合物游离出来,以利于乙酸乙酯萃取。结果表明,超声波与碱溶酸沉相结合的提取方法优于其他传统方法,得到的总黄酮含量最高。
有资料表明,黄酮类化合物与金属离子形成的络合物的稳定性受温度、光照、pH值等多种因素的影响[9~12],本研究在试验过程中亦发现,显色后放置较长时间吸光度会下降,引起测定结果有偏差。所以,柿叶总黄酮含量测定应在与Al(NO3)3反应后的2 h内进行。
[1]林娇芬,林河通,谢联辉.柿叶的化学成分、药理作用、临床应用及开发利用[J].食品与发酵工业,2005,31(7):90.
[2]罗昱澜.柿叶中总黄酮的含量测定[J].华夏医学,2008,21(3):433.
[3]马桂荣,孙 静,段普凡.柿叶有效成分提取分离方法研究[J].河北省科学院学报,1991,8(2):23.
[4]晏亦林,杨桂兴,李云秋.柿叶总黄酮提取方法研究[J].中药材,2003,26(11):56.
[5]高梦祥,赵喜红.柿叶黄酮类物质的提取工艺研究[J].陕西农业科学,2005,5(5):41.
[6]谷 建,刘 宇,梁剑平,等.均匀设计法优化超声提取黄花补血草中总黄酮[J].中药材,2009,32(12):1 910.
[7]祝冬青,孔庆新.均匀设计法优选葛根总黄酮提取工艺[J].中国药房,2009,20(3):190.
[8]刘 琨,杨再雍.均匀设计法优化珍珠草中总多酚超声波提取工艺研究[J].时珍国医国药,2010,21(3):754.
[9]孟志芬,郭雪峰,蒋 莹.毛泡桐花黄酮类化合物的稳定性研究[J].光谱实验室,2008,25(4):655.
[10]杜海珍.食品添加剂对柿叶黄酮稳定性的影响[J].食品研究与开发,2010,31(6):45.
[11]马 莉.冬枣黄酮的提取及其抗氧化作用的研究[D].青岛:青岛大学,2009.
[12]陶永元,高顺玉,舒康云,等.蕨菜中黄酮类化合物的提取及稳定性研究[J].安徽农业科学,2011,38(7):4 217.

