miR-451在胃癌组织中的表达及临床意义
汪 伟,刘晓峰,李文波,孙自勤,刘长江,李 晓
(1辽宁医学院济南军区总医院研究生培养基地,济南250031;2济南军区总医院)
胃癌是危害人类健康最常见的恶性肿瘤之一,居全球恶性肿瘤发病及病死率的第二位。然而病因及发病机制的不明确成为胃癌早期诊断困难、预后不佳的主要原因。MicroRNA(miRNA)是一类长约20~25个核苷酸的非编码的单链RNA分子。它通过与靶mRNA完全或不完全的互补配对,促进目标mRNA降解或抑制蛋白翻译,在细胞增殖、分化、凋亡、基因调控、免疫应答及肿瘤的发生中扮演重要的角色[1]。目前,miRNAs与肿瘤之间的关系已经成为肿瘤研究领域最受关注的分子之一,但其与胃癌的关系尚不明确。本研究使用RT-PCR技术检测胃癌组织及胃癌旁组织中miR-451的相对表达量,并分析其与胃癌相关临床因素的关系。
1 资料与方法
1.1 临床资料 标本均取自2010年11月~2011年6月济南军区总医院普通外科18例胃癌患者的新鲜手术标本及消化内科内镜下活检取样标本,其中胃癌、癌旁手术标本8份,内镜下活检取样标本10份。男11例、女7例,年龄45~78岁、平均64.2岁,淋巴结转移6例、无淋巴结转移12例,远处转移2例、无转移16例。患者术前未做化疗或放射等抗肿瘤治疗。肿瘤配对标本癌组织经HE染色证实均为腺癌,所取正常组织距癌缘>5 cm,HE染色证实为非癌组织,均无肠上皮化生或上皮内瘤变。
1.2 方法
1.2.1 RT-PCR检测miR-451的表达 取50~100 mg组织液氮研磨至粉末状,采用invitrogen公司TRIzol试剂说明书方法提取总RNA,并检测 OD260值。A260/A280比值范围在1.8~2.1之间为高纯度RNA,并用3%琼脂糖凝胶电泳法检测RNA的完整性,提取的总RNA于-70℃保存。采用invitrogen公司 SuperScript.Ⅲ First-Strand Synthesis System试剂说明书方法合成cDNA第一链,反转录合成的 cDNA于 -20℃保存。采用美国ABI公司SybrGreen PCR Master Mix(2X)试剂,并按照说明书进行实时定量 PCR,以 U6为内参。使用 ABI Stepone plus型荧光定量PCR仪,先以95℃ 10 min热启动,然后按95℃ 15 s,60℃ 1 min共40个循环,最后通过熔解曲线分析扩增产物的特异性。miR-451的相对表达量用2-ΔΔCt方法来表示。
1.2.2 统计学方法 采用SPSS17.0统计软件,计量资料以¯x±s表示,胃癌组织与胃癌旁组织之间的表达差异使用配对样本t检验,并用独立样本t检测法、单因素方差分析法检测胃癌中miR-451的相对表达量与胃癌临床因素之间的关系。P≤0.05为差异有统计学意义。
2 结果
2.1 胃癌组织和胃癌旁组织miR-451的相对表达量 分析miR-451的扩增曲线图及溶解曲线图可得到单一的PCR扩增产物。胃癌组织和胃癌旁组织miR-451 的相对表达量分别为0.344 ±0.266、0.506±0.307。其中上调6例,下调12例,下调比率为66.67%(12/18)。胃癌组织与癌旁组织之间miR-451 差异存在统计学意义(t= -2.534,P=0.021)。2.2 miR-451在癌组织中的相对表达与临床病理因素相关性 见表1。
3 讨论
miRNA起源于内源性表达转录本,是长约20~25 nt的双链RNA分子,其典型特征是具有发卡结构。它们通过依赖于miRNA和靶基因的互补性两种不同的机制反向调控靶基因的表达。mRNA转录本在miRNA关联的多蛋白RNA介导的沉默复合体(miRISC)中被核酸酶剪切,导致靶mRNA的降解。miRNAs通过不完全的碱基配对和mRNA的3'非翻译区,在一个类似于或者可能是等同于RNA干扰途径中使用的RISC复合物中,在转录后水平上抑制基因翻译[2]。它们虽不编码蛋白质,但是却参与了细胞增殖、分化、凋亡、基因调控、免疫应答、肿瘤的发生、发展及预后等过程并扮演了重要的角色[1]。近年来随着miRNAs研究的深入,miRNA在肿瘤中充当着促癌基因和抑癌基因的双重角色。若miRNA在肿瘤中表达水平向上调节,则为促癌基因;若为向下调节则为抑癌基因。目前,围绕胃癌的miRNAs研究已经展开,研究较多的包括miR-21[3]、miR-27a[4]、miR-146a[5]等。众多的研究者通过使用基因芯片、RT-PCR、原位杂交等技术探讨了这些miRNAs在胃癌组织中的表达状况、作用机制及作用靶点,为揭示miRNA与肿瘤之间的关系提供了理论和方法学基础。
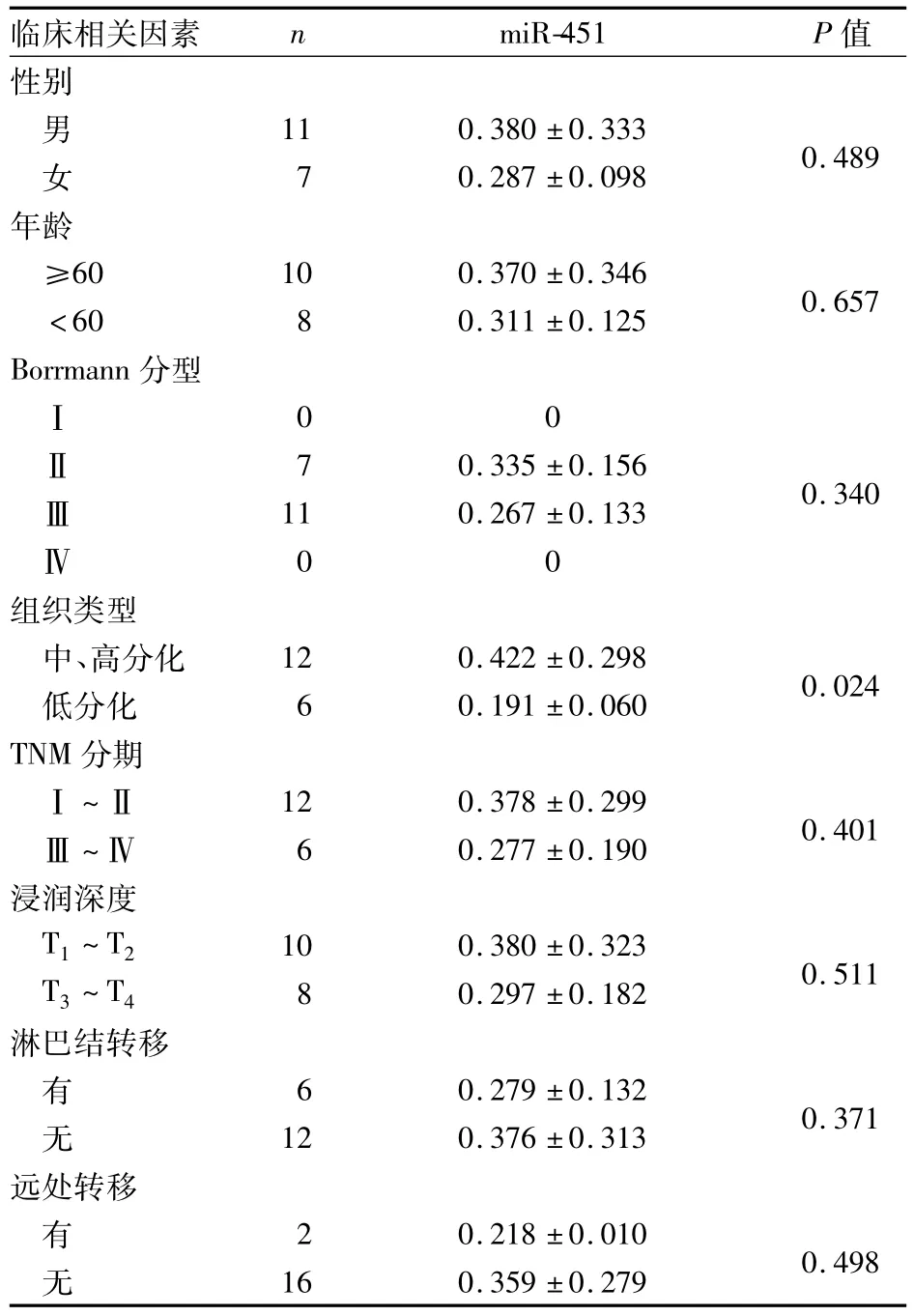
表1 胃癌组织中miR-451的表达与胃癌各因素之间的关系(¯x ± s)
近年国内外研究显示,miR-451与血细胞分化[6]、血液系统疾病[7]、心血管疾病[8]及肿瘤的发生等过程都有着密切联系。Hui等[9]发现miR-451在头颈鳞状细胞癌复发者中高表达;Gal等[10]研究提示,其在角质母细胞瘤干细胞(CD133+)中高表达;而 Kovalchuk 等[11,12]分别发现了 miR-451 参与调控多药耐药基因1在乳腺癌、卵巢癌中的表达。但miR-451与消化系统疾病的关系研究极少。Ban-dres等[13]通过RT-PCR技术探讨了石蜡包埋肿瘤组织中miR-451的表达情况,结果提示miR-451在胃癌组织和大肠癌组织中的表达均明显下调,并且其表达情况与细胞增殖、疾病预后及放化疗敏感性均有密切关系。国内学者吴春蓉等[14]通过RT-PCR及Western blotting技术验证了大肠癌细胞株中miR-451及巨噬细胞游走抑制因子(MIF)的表达情况。
目前,国内外文献中鲜有miR-451与胃癌的相关报道,并且未见在胃癌新鲜组织标本中的实验。PCR不仅是一种高敏感、高特异的检测核酸分子的定性方法,也是一个能对核酸分子进行精确定量的有力工具。RT-PCR技术是一种具有革命性意义的定量PCR技术,将之用于新鲜胃癌组织中miR-451的研究,比用于石蜡包埋组织和细胞株具有更高的敏感性和特异性。本研究通过RT-PCR技术对新鲜胃癌组织与癌旁组织中miR-451进行表达量验证,结果证实了miR-451在胃癌组织与癌旁组织中存在统计学差异。miR-451在胃癌组织中明显低表达,提示其可能负向调控了肿瘤的发生。通过与临床相关因素关系的分析,也证实miR-451与胃癌的分化程度相关。
Bandres等[13]在体外实验中提出miR-451通过抑制致癌基因MIF调节细胞的增殖。MIF可能是miR-451的作用靶点之一。MIF可刺激肿瘤细胞的增殖、分化、浸润、转移以及抑制肿瘤细胞凋亡,因此在肿瘤的发生和进展过程中均起着十分重要的作用。关于MIF促进恶性肿瘤细胞浸润和转移的作用已屡有报道[15],本试验结果显示,miR-451的低表达与肿瘤的浸润程度、转移作用无明显相关性,或许与样本例数较少有关。今后我们将扩大样本的例数来验证miR-451的作用靶点,并分析其与临床因素的相关性,以进一步确定miR-451在胃癌发生发展中的作用,为胃癌的预防和治疗提供一条新的思路。
[1]Calin GA,Croce CM.MicroRNA signatures in human cancers[J].Nat Rev Cancer,2006,6(11):857-866.
[2]Lee RC,Feinbaum RL,Ambros V.The c.elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J].Cell,1993,75(5):843-854.
[3]Zhang Z,Li Z,Gao C,et al.miR-21 plays a pivotal role in gastric cancer pathogenesis and progression[J].Lab Invest,2008,88(12):1358-1366.
[4]Liu T,Tang H,Lang Y,et al.MicroRNA-27a functions as an onco gene in gastric adenocarcinoma by targeting prohibitin[J].Cancer Lett,2008,273(2):233-242.
[5]Liu Z,Xiao B,Tang B,et al.Up-regulated microRNA-146a negatively modulate Helicobacter pylori-induced inflammatory response in human gastric epithelial cells[J].Microbes Infect,2010,12(11):854-863.
[6]Papapetrou EP,Korkola JE,Sadelain M,et al.A genetic strategy for single and combinatorial analysis of miRNA function in mammalian hematopoietic stem cells[J].Stem Cells,2010,28(2):287-296.
[7]Bruchova-Votavova H,Yoon D,Prchal JT.MiR-451 enhances erythroid differentiation in K562 cells[J].Leuk Lymphoma,2010,51(4):686-693.
[8]Bost Jancic E,Zidar N.Glavac D1 MicroRNA microarray expression profiling in human myocardial infarction[J].Dis Markers,2009,27(6):255-268.
[9]Hui AB,Lenarduzzi M,Krushel T,et al.Comprehensive MicroRNA profiling for head and neck squamous cell carcinomas[J].Clin Cancer Res,2010,16(4):1129-1139.
[10]Gal H,Pandi G,Kanner AA,et al.MIR-451 and imatinibmesylate inhibit tumor growth of Glioblastomastem cells[J].Biochem Biophys Res Commun,2008,376(1):86-90.
[11]Kovalchuk O,Filkowski J,Meservy J,et al.Involvement of micro-RNA-451 in resistance of the MCF-7 breast cancer cells to chemotherapeutic drug doxorubicin[J].Mol Cancer Ther,2008,7(7):2152-2159.
[12]Zhu H,Wu H,Liu X,et al.Roleof MicroRNA miR-27a andmiR-451 in the regulat ion of MDR1/P-glycoprotein expression in human cancer cells[J].Biochem Pharmacol,2008,76(5):582-588.
[13]Bandres E,Bitarte N,Arias F,et al.microRNA-451 regulates macrophage migration inhibitory factor production and proliferation of gastrointestinal cancer cells[J].Clin Cancer Res,2009,15(7):2281-2290.
[14]吴春荣,罗治彬,陈伟,等.miR-451对结肠癌细胞系SW620生物学行为的影响[J].解放军医学杂志,2011,36(5):478-482.
[15]He XX,Chen K,Yang J,et al.Macrophage migration inhibitory factor promotes colorectal cancer[J].Mol Med,2009,15(1-2):1-10.