非酒精性脂肪性肝病兔血浆丙二醛、超氧化物歧化酶与硫化氢、一氧化氮的关系
李儒贵 雷飞飞 李云静 谢杏榕 任永生 谭华炳
(湖北医药学院附属人民医院感染性疾病科,湖北 十堰 442000)
高脂血症是非酒精性脂肪性肝病(NAFLD)的主要原因。硫化氢(H2S)是机体心血管功能调节的新型气体信号分子〔1〕,一氧化氮(NO)也是气体信号分子,参与脂肪肝的发病。活性氧(ROS)是发生脂质过氧化损伤的基础。超氧化物歧化酶(SOD)是体内一种重要的自由基清除剂,能够平衡机体的ROS,避免超氧阴离子自由基浓度过高时引起的不良反应。脂质过氧化终产物丙二醛(MDA)可形成蛋白加合物,刺激机体产生抗体介导的免疫损伤。既往研究发现,SOD、MDA与肝脏脂质沉积量的相关〔2〕,脂肪肝模型兔SOD明显下降,MDA明显增加〔3〕。SOD、MDA与H2S、NO浓度的关系国内外未见报道。本文通过高脂饲料饲养建立不同程度兔NAFLD,观察NAFLD兔血浆 SOD、MDA、H2S、NO关系。
1 材料与方法
1.1 一般材料 40只日本大耳白兔(月龄相似,雌雄各半),体质量(2.2±0.2)kg,湖北医药学院医学动物实验中心提供(合格证号:No.00006546)。实验地点:湖北医药学院临床医学研究所,湖北省十堰市实验动物中心(设施使用证明号:No.00008391)。普通饲料由湖北医药学院动物实验中心提供。高脂饲料由湖北医药学院医学动物实验中心按实验配方配制成成品使用(配方:86%普通饲料+2%胆固醇+6%蛋黄+6%猪油)。胆固醇购自北京双旋生物培养基制品厂(批号:2009.07.15)。猪油由市售板油自行炼制而成。蛋黄粉市售鸡蛋自行制作。SOD、MDA、NO检测试剂盒均购自南京建成科技有限公司。
1.2 造模及分组 兔购入普通饲料饲养观察1 w,无不良反应后,随机数字法将40只兔分为3组。重度NAFLD组(重度组,n=14):每兔每天高脂饲料160 g。轻度NAFLD组(轻度组,n=13):每兔每天高脂饲料80 g+普通饲料80 g。对照组(n=13):每兔每天普通饲料160 g。上午9时、下午5时各组分别投入一半饲料。全部动物单笼、单兔喂养,自由饮水。建立重度、轻度NAFLD模型、对照模型。实验周期为13 w。重度高脂血症组饲养至9 w时死亡1只,由于无相关血液标本,统计时将重度组死亡动物的实验前资料剔除,各组实有动物13只。
1.3 标本采集与检测 试验结束,10%的水合氯醛耳缘静脉麻醉,腹主动脉采集血液5 ml于肝素管,离心取血浆,血浆保存于-20℃的冰柜中待检。检测血浆SOD(黄嘌呤氧化酶法)、MDA(TBA法)、NO(硝酸还原法)。血浆H2S(去蛋白法)检测标本送北京大学生理学系检测。
1.4 统计学方法 所有数据采用SPSS9.0统计学软件处理,数据以±s表示,治疗前后组内及组间比较用t检验。
2 结果
2.1 血浆H2S水平 重、轻度组血浆H2S较对照组明显下降(P<0.01);重度组低于轻度组但无差异(P>0.05)。见表1。
表1 三组兔饲养后MDA、SOD、H2S、NO变化( ± s,n=13)
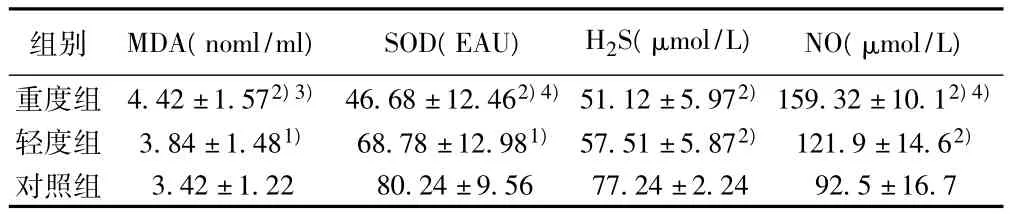
表1 三组兔饲养后MDA、SOD、H2S、NO变化( ± s,n=13)
与对照组比较:1)P<0.05,2)P<0.01;与轻度组比较:3)P<0.05,4)P<0.01
组别 MDA(noml/ml) SOD(EAU) H2S(μmol/L) NO(μmol/L)重度组 4.42±1.572)3) 46.68±12.462)4)51.12±5.972)159.32±10.12)4)3.42±1.22 80.24±9.56 77.24±2.24 92.5±16.7轻度组 3.84±1.481) 68.78±12.981) 57.51±5.872) 121.9±14.62)对照组
2.2 血浆MDA、SOD变化 重、轻度组MDA较对照组明显增高(P<0.01,P<0.05),且重度组明显高于轻度组(P<0.05)。重、轻度组SOD活力较对照组明显减低,重度组明显低于轻度组 (均P<0.01),见表1。
2.3 血浆NO浓度 重、轻度组NO较对照组明显升高(P<0.01),重度组高于轻度组 (P<0.01)。表1。
3 讨论
脂质过氧化在高脂血症导致以上病变的发生、发展过程中发挥重要作用。H2S广泛参与机体多种生理和病理过程,且在许多器官和系统中发挥清除氧自由基、减少脂质过氧化物和保护组织的作用〔4〕。本研究试图血浆脂质过氧化与H2S、NO的关系,为高脂血症相关并发症的防治提供理论依据。
内源性H2S是体内含硫氨基酸如蛋氨酸、半胱氨酸、同型半胱氨酸等在 5′-磷酸吡哆醛依赖酶〔包括胱硫醚-β-合酶(CBS)、胱硫醚-γ-裂解酶(CSE)〕作用下产生的代谢产物〔5〕。肝脏是体内H2S生成的主要部位,对维持循环血液中H2S的浓度起到重要作用。本研究发现重度、轻度NAFLD兔血浆H2S水平下降,提示肝脏H2S释放入血下降。至于重度组和轻度组比较无差异可能与其他组织分泌的H2S干扰有关,或者有其他机制有待研究。
高脂喂养脂肪肝大鼠肝脏中诱导性一氧化氮合成酶(iNOS)活性增强,以及诱导生成的NO水平也增高,iNOS、NO在脂肪肝肝损害中发挥重要作用〔6〕。NO过低,导致机体生理功能紊乱,过高则作为一种自由基对机体产生毒害〔7〕。本研究的缺陷是没有研究内皮型一氧化氮合酶和诱导型一氧化氮合酶的表达。
SOD、MDA改变提示随NAFLD进展,过氧化反应上升,抗氧化能力下降。本研究提示,与SOD/MDA抗氧化/过氧化平衡相同,H2S/NO是抗氧化/过氧化平衡气体信号分子,在高脂血症相关性疾病发生、发展中发挥作用,值得深入关注。
1 耿 彬,闫 辉,钟光珍,等.硫化氢——心血管功能调节的新型气体信号分子〔J〕.北京大学学报:医学版,2004;36(1):106.
2 王一平,谭华炳,贺 琴,等.SOD、MDA与肝脏脂质沉积量的相关性研究〔J〕. 西南国防医药,2009;19(4):365-7.
3 王 威,江海涛,史 红,等.疏肝导浊方对脂肪肝家兔的 AST、ALT、ALP、NO、SOD 和 MDA 的影响〔J〕.天津中医药杂志,2010;27(1):9-11.
4 王洪瑾,李 毅.硫化氢与氧化应激〔J〕.医学研究生学报,2011;24(4):433-6.
5 Truong DH,Mihajlovic A,Gunness P,et al.Prevention of hydrogen sulfide(H2S) -induced mouse lethality and cytotoxicity by hydroxocobalamin(vitamin B(12a)〔J〕.Toxicology,2007;242(1):16-22.
6 吕天英,卢震亚.非酒精性脂肪性肝病大鼠肝组织NO和iNOS的变化〔J〕. 浙江预防医学,2009;21(4):9-11.
7 Cary SP,Winger JA,Derbyshire ER,et al.Nitric oxide signaling:no longer simply on or off〔J〕.Trends Biochem Sci,2006;31(4):231-9.

