松花粉对衰老成纤维细胞线粒体DNA缺失突变的影响
喻 陆 史春夏(解放军305医院,北京 0007)
线粒体DNA(mtDNA)损伤学说认为衰老是因为机体组织线粒体缺乏DNA损伤修复机制,从而导致mtDNA氧化损伤累积所致,主要是mtDNA缺失突变引起线粒体氧化磷酸化功能受损,导致能量产出缺陷、衰老、死亡〔1〕。国内外研究表明,哺乳动物mtDNA损伤随增龄积累,且与生物衰老之间存在高度的相关性〔2〕。松花粉药名松黄,是一种营养价值高、药理作用广的中药,我实验室前期的研究显示松花粉具有较好的抗成纤维细胞衰老的作用〔3〕,因此本次实验研究松花粉对衰老成纤维细胞mtDNA缺失突变的影响,以期进一步阐释松花粉延缓细胞衰老的作用机制。
1 材料与方法
1.1 细胞培养、分组与处理 人胚肺2BS细胞由北京生物制品研究所建株,28代引入。培养于15%胎牛血清的DMEM培养基中,37℃,5%CO2,饱和湿度培养箱中生长。体外培养最多可分裂60~70代。一般认为30代以下为年轻细胞,55代以上为衰老细胞。至30代时随机取8瓶作为年青对照组,至56代时随机取16瓶分成衰老组、松花粉组,每组 8瓶。参照文献〔4〕配制松花粉血清液,使其终浓为240 mg/dl(松花粉处理组);对照组分为青年组、衰老组。松花粉组从28代起使用松花粉血清液连续培养2BS细胞;对照组从28代起连续培养,采用对照培养基(同体积DMEM培养基)培养。当细胞融合度约90%时,按1∶2或1∶4传代,细胞传代后如3周内不能融合,则停止传代。
1.2 仪器与试剂 松花粉由中国林业学院亚热带林业研究所提供,为天然破壁松花粉。PCR仪(美国Perkin-Elmer公司,9600型);凝胶成像仪(Bio-Rad)。类标准胎牛血清(FBS)购自民海生物,DMEM培养基(含非必需氨基酸、谷胺酰胺)为Invitrogen产品。细胞衰老相关β-半乳糖苷酶(β-gal)染色试剂盒(上海杰美)。mtDNA试剂盒,购于上海生物工程研究中心。超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒购自南京建成生物医学工程研究所。
1.3 方法
1.3.1 细胞形态观察及单细胞面积测定 各组细胞相差显微镜下观察形态改变(×400)。
1.3.2 β-gal染色 将成纤维细胞接种于盖玻片上。在松花粉作用于不同时间后,PBS洗一次,用40 g/L多聚甲醛固定细胞45 min,用X-半乳糖苷酶(X-gal)染液,37℃保温4~8 h。染液含 20 mmol/L X-gal、40 mmol/L 醋酸-磷酸钠(pH6.0)、5 mmol/L铁氰化钾、5 mmol/L亚铁氰化钾、150 mmol/L氯化钠、2 mmol/L氯化镁。室温显色过夜。衰老细胞呈深蓝色,显微镜下计数。
1.3.3 RT-PCR法检测mtDNA4977的表达 mtDNA4977基因的引物由上海生工合成,基因序列参照文献〔5,6〕设计,检测mtDNA4977缺失后线粒体DNA-loop区引物序列为上游引物:5'-CCC TTA AAT AAG ACA TCA CGA TG-3';下游引物:5'-GTT AGTTGG GGG GTG ACT GT-3',跨越468 bp的片段。参考文献〔4,5〕本研究同时采用总mtDNA一段保守序列扩增作为内参,上游引物5'-AGGACTTAACCAGACCCAAACACG-3',下游引物为 3'-CCTTTTTCTGATAGGCGGG-5',长度 700 bp,用于代表mtDNA的总量,由上海生工合成。mtDNA提取与测定:采用mtDNA抽提试剂盒提取细胞总mtDNA。紫外分光光度计测定其吸光度值并计算mtDNA浓度。1%琼脂糖凝胶电泳检测其片段完整性。PCR扩增:反应体系为50 μl,mtDNA量约2 μl(50 ng),引物各0.5 μl(内参和目的基因引物各25 pmol),dNTPS 5.0 μl(200 μmol/L),10 × Buffer 5.0 μl,加 ddH2O 至总体积49 μl,将除Taq酶以外所有反应成分加入0.5 ml小离心管中,覆盖石蜡40 μl,短暂离心,94℃预变性2 min,加入Taq酶1 μl(2.5 U),进入如下循环:94℃ 30 s→ 56℃ 30 s→72℃30 s,共30个循环,72℃延伸7 min。PCR产物鉴定及分析:取PCR产物8 μl,在含EB终浓度为0.5 μg/ml的1.5%琼脂糖凝胶中电泳,紫外灯下观察电泳结果,用凝胶分析系统对PCR产物进行扫描定量分析。PCR产物分析软件对各电泳条带得出各PCR产物的平均灰度值。用DNA4977片段缺失后扩增的468 bp灰度值与内参片段灰度值的比值代表缺失突变线粒体DNA 在总线粒体 DNA 中的相对比例〔5,6〕。
1.3.4 细胞SOD活性、MDA含量测定 分别收集各组细胞,反复冻融细胞,使细胞胀破,离心取上清液,按试剂盒说明书中的方法测定血清中的SOD活性、MDA含量。
2 结果
2.1 各组细胞形态学变化 观察发现年青细胞平均两天呈致密单层,细胞长梭形,排列成束状,界限清晰,细胞饱满,折光度好,立体感强;衰老细胞形成单层时间延长,边缘不整齐,排列紊乱,折光度下降,可呈棱形、三角形,表面有微小泡状突起,胞质内有颗粒样物聚集;用松花粉老年细胞,细胞长梭形,边缘整齐,排列成束状,折光度好,立体感强。见图1。
2.2 衰老相关β-gal检测 细胞固定后用X-gal染色测其βgal活性,细胞呈深蓝色的为衰老细胞(图2)。实验发现,β-gal染色阳性细胞百分比在青年组为(8.42±3.58)%,衰老组为(89.42±5.28)%,240 mg/dl松花粉组为(18.22±8.28)%。衰老组较青年组显著增高(P<0.001),松花粉组均较衰老组显著降低(P<0.001)。结果表明,松花粉可以抑制组织细胞衰老,延长细胞寿命。

图1 各组细胞形态图(×400)
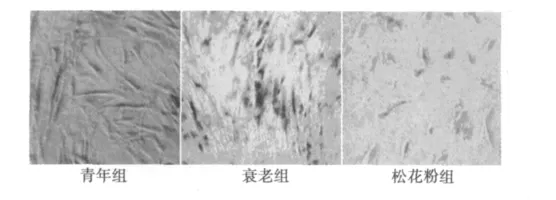
图2 细胞衰老相关β-gal染色图(×100)
2.3 各组细胞SOD、MDA含量测定结果 衰老组细胞SOD明显低于青年组(P<0.05),而MDA含量明显高于青年组(P<0.05);松花粉组细胞SOD活性明显高于衰老组(P<0.05),而MDA含量明显低于衰老组(P<0.05)。见表1。
表1 各组细胞SOD活性、MDA含量(±s,n=8)

表1 各组细胞SOD活性、MDA含量(±s,n=8)
与青年组比较:1)P<0.05,与衰老组比较:2)P<0.05
组别 SOD活性(U/ml) MDA含量(nmol/ml)39.68±4.87 19.36±3.4衰老组 15.27±3.111) 44.71±3.71)松花粉组 37.69±4.212) 21.34±4.72)青年组
2.4 PCR结果
2.4.1 线粒体总DNA完整性分析 各组DNA的提取后的线粒体DNA,产物在紫外灯下OD260进行比色分析计算含量,OD260/OD280在1.8~2.0之间说明纯度较好。线粒体DNA的全长16 kb,通过琼脂糖电泳可以看见抽提的线粒体总DNA,片段完整,无蛋白质污染,可用于RT-PCR反应。见图3。
2.4.2 mtDNA4977的电泳表达结果 各组均呈现2条清晰的条带,700 bp为内参片段,468 bp为mtDNA D-loop区片段。通过软件分析mtDNA4977/内参作为半定量结果,衰老细胞组缺失突变(28.689 4)在mtDNA中的比例均显著高于另外两组(均P<0.05),是青年细胞组的6.21倍(4.615 2),而衰老细胞组缺失突变(28.689 4)在mtDNA中的比例是松花粉处理组的2.55倍(11.263 5)。见图4。
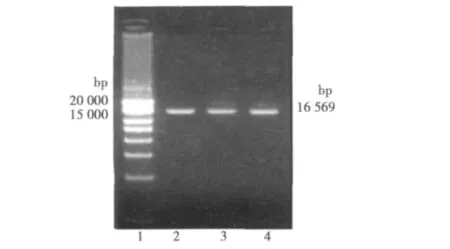
图3 总DNA完整性分析
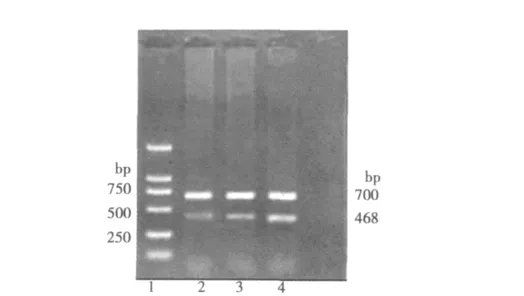
图4 mtDNA4977基因RT-PCR电泳图
3 讨论
自1989年Limrane等提出线粒体衰老假说以来,人们越来越关注线粒体与衰老的关系。随着衰老的进程,有丝分裂后组织中mtDNA缺失和点突变随之出现〔7〕,而且在老年个体中达到高水平,尤其在负责mtDNA复制和转录的区域突变尤为明显,mtDNA突变的增加加速了衰老进程〔8〕。Jou等〔9〕的研究结果也证实mtDNA的缺失突变与衰老的相关性。
目前认为mtDNA突变随增龄积累是导致衰老的重要因素之一,而活性氧(ROS)损伤是衰老时mtDNA突变的主要原因。衰老时常见的mtDNA突变有三种:①缺失突变;②点突变;③重排。其中mtDNA缺失突变研究最多,发生频率也最高,与衰老及疾病的关系较为密切。较常见的与衰老相关的缺失突变则是4 977 bp~5 kb片段的缺失,在心、骨骼肌和肾等各脏器中均可找到该突变,称之为“共有缺失”。mtDNA是位于线粒体基质内的一种环状双链DNA分子,线粒体mtDNA基因排列紧凑,无内含子,部分区域出现基因的重叠,几乎每个碱基都用于基因组建。因此任何突变都会累及到基因组中的一个重要功能区域,最终导致氧化磷酸化功能受损导致能量产出缺陷、衰老和细胞死亡。
缺失mtDNA损伤类型以片段缺失最普通,mtDNA突变随年龄的增长而增多,使mtDNA基因组高突变率常作为衰老过程的潜力生物学标记〔10〕。目前认为mtDNA缺失随增龄的积累是衰老的重要因素之一,已有大量研究证实人类或动物的各种组织细胞中mtDNA缺失均随增龄而增加,其中4 977 bp缺失在人体中研究最多。Gerhard等〔11〕用PCR方法在胎儿、青年、老年三个年龄组的皮肤成纤维 细胞都检测到4 977 bp缺失,其中老年组最高,大于0.3%。Barron等〔12〕同样用 PCR方法在14~94岁人的黄斑中检测到4 977 bp缺失渐进性积累,其中60~94岁缺失增加显著,从0.25%~5.39%。
mtDNA由于其损伤修复系统有限,本身的拓扑结构又位于线粒体内膜附近,裸露于内膜氧化呼吸链产生的大量自由基环境中,易遭受氧化损伤。因此mtDNA突变率是核基因的10~20倍,可使mtDNA发生大片段的缺失突变。因长期遭受自由基的攻击,导致哺乳动物mtDNA具有极高的突变率。机体的正常代谢产物中活性氧(ROS)及氧自由基是mtDNA损害的主要原因。ROS能攻击许多不同的细胞大分子,包括蛋白质,脂质和DNA。其中对衰老而言,ROS对DNA的伤害是最重要的,mtDNA在位置上非常接近线粒体ROS产生部位,随着衰老的进程,有丝分裂后组织中mtDNA缺失和点突变随之出现,而且在老年个体中达到高水平,尤其在负责mtDNA复制和转录的区域尤为明显,mtDNA突变的增加,加速了衰老进程。另一方面ROS可激活线粒体透性转变通道(mtPTP),造成能量缺损和氧化性损伤,引起细胞凋亡〔2〕。氧自由基能攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,并因此形成脂质过氧化物,如MDA,一方面它可能引起细胞代谢及功能障碍甚至死亡,其含量与细胞损伤的程度呈正相关,可间接反映出机体受自由基攻击的严重程度。另一方面它可以通过链式或链式支链反应,放大ROS的作用。抗氧化物质SOD是机体清除过多ROS及氧自由基的主要物质,能够降低其对机体的氧化损伤。
本实验首先从总mtDNA中进行PCR反应,检测mtDNA4977,并设计总mtDNA中总长度为700 bp的片段作为内参,通过mtDNA4977/内参比例结果反应缺失突变mtDNA4977在总mtDNA中的比例,这一数据也可以较好的反应各自间的倍数关系。本文结果表明mtDNA4977缺失突变与细胞的衰老有关,同时松花粉抗衰老的作用可能与降低mtDNA4977缺失突变有着密切的关系。同时进行松花粉对细胞体内氧化环境的影响结果看,松花粉能明显增加细胞体内的SOD活性,降低其中MDA的含量。因此,推测松花粉降低抑制衰老成纤维细胞mtDNA缺失突变的作用可能通过降低细胞内的内的氧化损伤有着密切的关系。
本研究结果初步揭示了松花粉可以降低线粒体DNA的缺失突变,其抗衰老作用可能与这一生理作用有关。这一研究结果为中医延缓衰老开辟了新的研究途径,对了解线粒体DNA在细胞衰老中的作用和细胞凋亡与衰老关系的研究,以及揭示细胞衰老的机制都将具有重要意义。
1 de Grey AD.Three detailed hypotheses implicating oxidative damage to mitochondria as a major driving force in homeotherm aging〔J〕.Eur J Biochem,2002;269(8):1995.
2 Trifunovic A,Wredenberg A,Falkenberg M,et al.Premature ageing in mice expressing defective mitochondrial DNA polymerase〔J〕.Nature,2004;429(6990):417-23.
3 钟 馨,喻 陆.松花粉抗成纤维细胞复制性衰老的机制〔J〕.中国老年学杂志,2009;29(15):1904-7.
4 赵立新,喻 陆.松花粉延缓细胞衰老及对细胞端粒酶活性的影响〔J〕.四川中医,2004;22(4):11-3.
5 王学美,富 宏,刘庚信.增龄对大鼠心肌线粒体DNA氧化损伤的影响〔J〕.中国老年学杂志,2003;23(5):592-3.
6 韩维举,韩东一,杨伟炎,等.大鼠不同组织器官线粒体DNA缺失定量分析及与老化的关系〔J〕.军医进修学院学报,2002;23(4):305-7.
7 Nekhaeva E,Bodyak ND,Kraytsberg Y,et al.Clonally expanded mtDNA point mutations are abundant in individual cells of human tissues〔J〕.Proc Natl Acad Sci USA,2002;99(8):5521-6.
8 Genova ML,Pich MM,Bernacchia A,et al.The mitochondrial production of reactive oxygen species in relation to aging and pathology〔J〕.Ann N Y Acad Sci,2004;1011(4):86-100.
9 Jou MJ,Peng TI,Reiter RJ,et al.Visualization of the antioxidative effects of melatonin at the mitochondrial level during oxidative stress-induced apoptosis of rat brain astrocytes〔J〕.J Pineal Res,2004;37(1):55-70.
10 Ross OA,Hyland P,Curran MD,et al.Mitochondrial DNA damage in lymphocytes:a role in immunosenescence〔J〕.Exp Gerontol,2002;37(23):329-40.
11 Gerhard GS,Benko FA,Allen RG,et al.Mitochondrial DNA mutation analysis in human skin fibroblasts from fetal,young,and old donors〔J〕.Mech Ageing Dev,2002;123(23):155-66.
12 Barron MJ,Johnson MA,Andrews RM.Mitochondrial abnormalities in ageing macular photoreceptors〔J〕.Invest Ophthalmol Vis Sci,2001;42(12):3016-22.

