HBV特异性CTLs表面CD244和PD-1共表达与慢性乙型肝炎严重程度的相关性*
王 姣, 邓 洪△, 谢冬英, 朱建芸, 胡朝霞, 梅明珠, 高志良
(中山大学附属第三医院1感染性疾病科,2疫苗研究所,广东 广州 510630)
乙型肝病病毒(hepatitis B virus,HBV)是一种嗜肝性、非细胞毒性的DNA病毒,在婴幼儿时期感染者极易演变为慢性乙型肝炎(chronic hepatitis B,CHB)[1]。HBV感染的临床转归与机体免疫密切相关,其中细胞免疫尤其是HBV特异性细胞毒性T淋巴细胞(cytotoxic T-lymphocytes,CTLs)在病毒清除过程中起着重要的作用[2]。但是研究发现HBV慢性感染者体内HBV特异性CTLs存在数量和质量上的缺陷,不能有效地清除病毒,且其机制并不十分明确[3]。程序性死亡蛋白1(programmed death 1 protein,PD-1)是近年来研究发现的最具代表的负性共刺激信号分子,其高表达与T细胞免疫缺陷密切相关,是导致 T淋巴细胞功能耗竭的重要机制之一[4-5]。近年来研究者们认为,机体内还存在其它的负性共刺激信号分子,协同PD-1调控T淋巴细胞的免疫功能[6]。CD244,也称 2B4,研究者发现其在 HBV[7]和 丙 型 肝 炎 病 毒 (hepatitis C virus,HCV)[8]感染者体内高表达,并发挥免疫抑制的作用。由于PD-1和CD244共表达与HBV感染慢性化后疾病进程的相关性尚不清楚,本研究的目的在于通过检测不同临床类型的慢性HBV感染者外周血总T细胞及HBV特异性CTLs上CD244和PD-1共表达差异,探讨PD-1和CD244共表达与CHB不同疾病进程的关系。
材料和方法
1 研究对象
81例HLA-A2阳性CHB患者均来自2010年7月至2012年5月在中山大学附属第三医院感染科病房或者门诊,年龄在16~63岁之间,平均年龄(38.2±11.0)岁;男性 75例,女性6例;其中包括免疫耐受期(immune tolerant,IT)7例,轻、中度CHB(mild and moderate CHB,m -CHB)34例,重度 CHB(severe CHB,s-CHB)20例,慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)20 例,见表 1。诊断符合2010年《慢性乙型肝炎防治指南》[1]及2005年《肝衰竭诊疗指南》[9],同时排除合并其它类型肝炎病毒感染、人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染、酒精性肝病、自身免疫性肝炎、自身免疫性疾病、肿瘤、孕妇及严重基础病等患者。健康对照(healthy controls,HC)14例,均为健康献血人员,见表1。本研究已通过中山大学附属第三医院伦理委员会的批准,并获得了研究对象的知情同意。
表1 研究对象的基本情况Table1.Characteristics of the study population()

表1 研究对象的基本情况Table1.Characteristics of the study population()
ALT:alanine aminotransferase;TBIL:total bilirubin;PT:prothrombin time;HBsAg:hepatitis B surface antigen;HBeAg:hepatitis B e-antigen;HBeAb:hepatitis B e-antibody;HBV DNA:hepatitis B virus deoxyribonucleic acid.
P a r a m e t e r H C I T m-C H B s-C H B A C L F P n 14 7 34 20 20 -A g e(y e a r) 29.21±4.87 25.43±6.85 33.14±8.80 39.06±99.42 46.53±10.80 <0.01 S e x(f e m a l e/m a l e) 2/12 1/6 3/31 2/18 1/19 >0.05 A L T(U/L) - 33.20±14.45 807.40±538.90 799.20±584.80 694.20±570.20 <0.01 T B I L(μ m o l/L) - 13.12±5.28 50.15±32.13 244.40±147.60 388.70±169.60 <0.01 P T(s) - - 14.79±2.34 15.40±2.06 27.56±6.41 <0.01 H B s A g(10 3 U/L) - + 5582.70±8320.00 6236.10±3145.20 5996.60±2142.60 >0.05 H B e A g(p o s t i v e/n e g a t i v e) - 7/0 18/16 12/8 5/15 >0.05 H B e A b(p o s t i v e/n e g a t i v e) - 0/7 19/15 12/8 15/5 >0.05 H B V D N A[l o g 10(10 3 U/L)]- 6.92±2.19 6.96±1.19 6.94±1.21 5.88±1.38 <0.05
2 主要试剂和仪器
BD FACS LSRII型流式细胞仪。荧光标记小鼠抗人单克隆抗体HLA-A2-PE、CD3-FITC、CD8-APC-Cy7、PD-1- PE-Cy7(Clone:MIH1)和 IgG1(K isotype)-PE-Cy7购于BD Bioscience。CD244-APC(Clone:eBioPP35)和 IgG1(K isotype)-APC购于eBioscience。IFN-γ- Brilliant Violet 421购于Biolegend。R-PE标记的Pro5 MHC pentamer HLA-A*02:01/FLPSDFFPSV(HBV Tc18-27)购于Proimmune。LymphoprepTM淋巴细胞分离液购于AXISSHIELD,胎牛血清和RPMI-1640培养基+HEPES购于Gibco。佛波酯(phorbol 12-myristate 13-acetate,PMA)和离子霉素钙盐(ionomycin calcium salt)购于Sigma,莫能星(monensin)购于BioLeged。
3 方法
3.1 分离外周血单个核细胞及HLA-A2流式分型采集EDTA抗凝新鲜外周血10 mL,利用Ficoll密度梯度离心法分离外周血单个核细胞(peripheral blood mononuclear cell,PBMC),细胞计数后悬于 PBS中,调整浓度1×1010cells/L。分别取1×105PBMC加入含100 μL PBS的检测管和对照管中,加入anti-HLA-A2-PE及同型对照10 μL,室温避光孵育15 min,PBS洗涤后,上流式细胞仪检测。
3.2 流式细胞仪检测HBV特异性 CTLs频率及CD244、PD-1分子的表达 取5×106个PBMC重悬于100 μL PBS中,加入10 μL R -PE 标记的 Pro5 MHC pentamer HLA-A*02:01/FLPSDFFPSV(HBV Tc18-27),室温孵育15 min,PBS洗涤后,350×g离心去上清,加入 anti-CD3-FITC、anti-CD8-anti-APC-Cy7、anti-PD-1-PE-Cy7和anti-CD244-APC,4℃孵育30 min。PBS洗涤后,350×g离心去上清,加4%多聚甲醛200 μL重悬后,流式细胞仪检测。每份标本均设同型对照。以淋巴细胞为门,计数2×106个 T细胞,设 CD3+、CD8+、HLA-肽五聚体三阳性细胞为特异性CD8+细胞,并以占总计数CD8+细胞的百分比表示。HBV特异性CTLs阳性细胞定义为HBV特异性CTLs占总CD8+T细胞比率大于0.02%。
3.3 细胞刺激剂细胞内因子染色 新鲜分离的PBMC铺于48孔板中,每孔1 mL,细胞浓度3×109cells/L,加入 PMA 25 μg/L、ionomycin 1 mg/L 及monensin 2 mmol/L,置37℃培养箱中培养5 h,收集细胞先行细胞表面 anti-CD3-FITC、anti-CD8-APC-Cy7、anti-PD -1- PE -Cy7、anti-CD244-APC及同型染色,洗涤后固定,破膜后加入anti-IFN-γ-Brilliant Violet 421及同型抗体,室温避光孵育20 min,破膜液洗涤1次后,PBS再次洗涤后重悬,备上机检测。
4 统计学处理
流式数据采用FlowJo 7.6.2流式分析软件分析,用GraphPad Prism 5 Demo统计软件进行数据分析。计量资料采用均数±标准差()表示,两组间非参数比较采用Mann-Whitney U检验,多组间非参数比较采用Kruskal-Wallis检验,两两比较采用Dunns检验。相关性分析采用Spearman等级相关。设双尾检验P<0.05为差异有统计学意义。
结 果
1 CHB患者PBMC及HBV特异性CTLs表面CD244和PD-1的表达模式
CHB患者HBV特异性CTLs阳性细胞较健康对照组明显升高,组间差异有统计学意义(P<0.01),见图1A。PBMC表面CD244的表达在IT组及m-CHB组下调,组间差异有统计学意义(P<0.05),见图1B;PBMC表面PD-1的表达组间差异无统计学意义(P>0.05),见图1C。HBV特异性 CTLs表面CD244或PD-1单独表达比在PBMC上表达明显增加(75.49% ± 14.37%vs 32.48% ± 15.09%,P <0.01;87.27% ±12.69%vs 23.45% ±8.58%,P <0.01),但CHB不同临床类型的特异性CTLs表面CD244或PD-1的单独表达差异无统计学意义(均P >0.05),见图 1D、E。
2 CD244与PD-1的共表达模式与CHB疾病进程的相关性
外周血PBMC上CD244与PD-1的共表达在ACLF、s-CHB、m -CHB、IT及健康对照5组间存在显著差异(P<0.01),见图2A;在CHB不同临床类型中,随病情进展,CD244与PD-1在HBV特异性CTLs上共表达有上调趋势,组间差异有统计学意义(P <0.01),见图2B。
3 CD244和PD-1表达与IFN-γ水平间的关系,以及与CHB疾病进程的相关性
CD244或PD-1单阳性HBV特异性 CTLs和CD244与PD-1双阳性HBV特异性CTLs分泌IFN-γ水平在CHB不同临床类型间的差异均有统计学意义(P<0.05或P<0.01),见图3A~C。进一步相关分析显示CD244或PD-1单阳性HBV特异性CTLs分泌IFN-γ能力与该单阳性细胞比例呈负相关(r= -0.2942,P <0.05;r= -0.3901,P <0.01),见图3D、E;PD-1和CD244双阳性的HBV特异性CTLs分泌IFN-γ能力与该细胞比例亦呈负相关,差异有统计学意义(r= -0.5409,P <0.01),见图3F。

Figure1.Expression of CD244 and PD-1 on total and virus-specific CTLs in IT patients(n=7),m-CHB patients(n=34),s-CHB patients(n=20),ACLF patients(n=20)and HC(n=14).A:the percentage of CD8+Pent+T -cells;B,C:the distribution of total CD244 and PD-1 expression among different groups;D,E:the distribution of CD244 and PD -1 expression on virus-specific CTLs among different groups;F~H:representative Zebra plots of Pent+CD8+T-cells,CD244+Pent+CD8+T-cells and PD-1+Pent+CD8+T-cells,respectively.Example graphs show events after gating on CD3+CD8+populations.*P <0.05,**P < 0.01.图1 CHB不同临床类型患者PBMC和HBV特异性CTLs表面CD244与PD-1的表达
讨 论
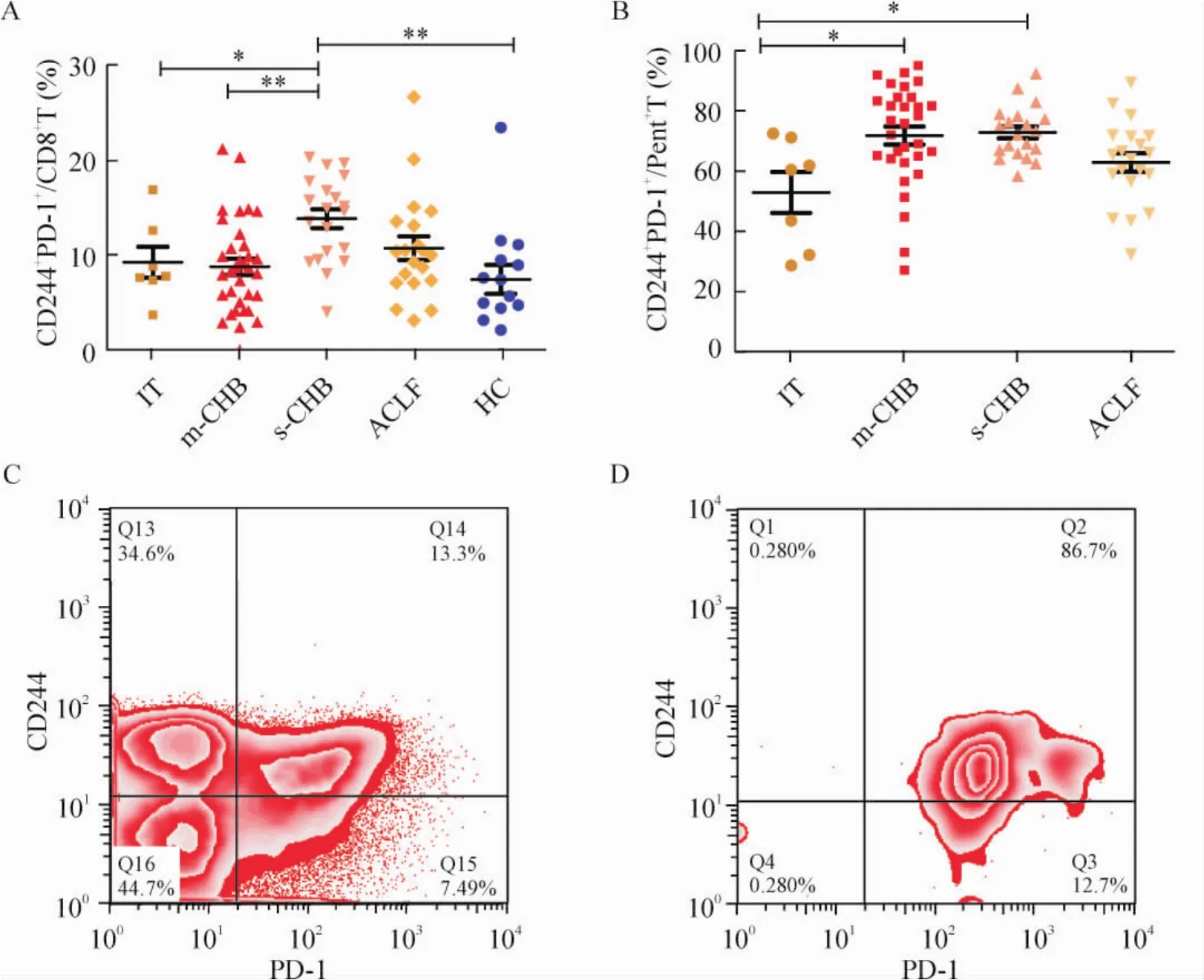
Figure2.Co-expression of CD244 and PD-1 on CD8+T-cells(A)and Pent+CD8+T-cells(B)in CHB patients.Example graphs show events of CD244+PD-1+cells after gating on CD3+CD8+T-cell(C)and CD3+Pent+CD8+T-cell populations(D).*P <0.05,**P <0.01.图2 CHB不同临床类型患者PBMC和HBV特异性CTLs表面CD244与PD-1共表达水平的比较
目前研究认为HBV感染慢性化的关键因素是HBV持续存在导致细胞免疫(主要是HBV特异性CTLs)功能低下[4-5]。探讨 HBV 特异性 CTLs功能低下的免疫病理机制一直是研究的热点。研究表明导致T淋巴细胞功能低下的原因除了缺乏CD4+T细胞辅助作用[10]、调节性 T淋巴细胞功能活化[11-12]及 IL -10[13-14]等免疫调节因子的过度表达外,CD8+T细胞表面负性共刺激信号分子的过度表达也发挥了重要影响。体内外研究发现在慢病毒感染机体中,抗原特异性T淋巴细胞上高表达PD-1,伴随细胞增殖及分泌功能的降低[4]。用抗PD-L1/2抗体阻断PD-1信号通路,可恢复耗竭T细胞的增殖及分泌能力,利于病毒清除[5]。后续研究发现PD-1与其它免疫抑制分子共表达在CD8+T细胞功能耗竭中发挥着协同作用,如PD-1与T细胞免疫球蛋白3(T -cell immunoglobulin -3,Tim -3)[15]、PD -1与淋巴细胞激活基因3(lymphocyte activation gene-3,LAG-3)[16]、PD-1 与 CD160、2B4[17]等。CD244,也叫做2B4,属于淋巴细胞活化信号分子(signaling lymphocytic activation molecule,SLAM)家族成员之一,组成性表达于NK细胞上,起始作为NK细胞活化分子而被大家熟知[18]。2B4还可以表达于CD8+T细胞、粒细胞及单核细胞等细胞上[19],其受体为CD48,后者表达于大部分的造血细胞上[20]。文献报道,CD244活化信号转导依赖NK细胞或者T细胞上含免疫受体酪氨酸活化基序(immunoreceptor tyrosine-based activation motif,ITAM)的 NKp46 或者TCR受体复合物[21]。故而CD244需在第一信号的刺激下,作为共刺激信号分子与配体CD48交联后,在胞内第二信号的辅助下向下游传递活化或抑制信号[22]。近年来有研究者在慢性淋巴细胞性脉络膜丛脑膜炎病毒(lymphocytic choriomeningitis virus,LCMV)[6]感染的小鼠中发现2B4有免疫抑制的功能,可加重CD8+T细胞功能耗竭。陆续在有关HBV[7]、HCV[8]、HIV 等[23]的慢性感染研究中也发现了这个现象。研究者认为CD244分子交联后传递活化或者抑制信号依赖于以下几点:(1)CD244分子的表达密度,若低、中度表达传递活化信号,若为高表达则传递抑制信号;(2)与其它抑制分子如PD-1等的共表达情况;(3)胞内SLAM相关蛋白(SLAM-associated protein,SAP)的多少。
我们的研究利用五聚体技术及流式细胞术检测CHB不同临床类型患者外周血HBV特异性CTLs的比例及其表面负性共刺激信号分子CD244与PD-1的表达差异,结果显示类似PD-1变化趋势,CD244在HBV特异性CTLs上表达较其在PBMC上表达明显升高,特异性CTLs表面CD244表达越高,该细胞分泌IFN-γ能力越弱,这与国外其它研究结果一致。这提示CD244表达上调与HBV特异性CTLs功能低下相关。另外,我们的研究显示在CHB患者体内,HBV特异性CTLs表面CD244和PD-1共表达明显上调,并伴有CD244和PD-1双阳性的特异性CTLs分泌IFN-γ功能的下降。这说明在HBV持续感染患者体内,CD244与 PD-1在 HBV特异性CTLs表面共表达,可抑制该细胞的分泌功能,提示CD244可能协同PD-1抑制T细胞功能,共同导致HBV感染慢性化。

Figure3.The distribution of IFN-γ released by CD244+Pent+CD8+T-cells(A),PD-1+Pent+CD8+T-cells(B),CD244+PD-1+Pent+CD8+T-cells(C)in IT patients(n=7),m-CHB patients(n=31),s-CHB patients(n=20),ACLF patients(n=18).D~F:corrlation of the percentage of the upper mentioned T-cells with IFN-γ released by themselves,respectively.*P < 0.05,**P <0.01.图3 CHB不同临床类型患者CD244和PD-1单阳性或者双阳性的HBV特异性CTLs分泌IFN-γ水平的比较
另外,在慢性HBV感染的不同临床类型之间,HBV特异性CTLs表面CD244或PD-1单独表达水平无明显差异。这说明CD244或PD-1单独表达与CHB病程进展无直接相关性,与我们之前有关PD-1的研究结果一致[24]。但 CHB中、重度组 HBV特异性CTLs比例及其表面CD244和PD-1共表达水平较免疫耐受组明显升高,伴有CD244和PD-1双阳性的特异性CTLs分泌IFN-γ功能的下降;当病情恶化进展至ACLF,CD244和PD-1共表达水平下降,而该细胞分泌IFN-γ的能力得以恢复。这提示CD244与PD-1可能存在不重叠的免疫抑制作用,两者共表达上调可加重T细胞功能耗竭,并可能对疾病的进展有更好的预示作用。研究表明,HBV感染机体后,若出现HBV特异性CTLs上高表达PD-1,则机体控制炎症活动,利于疾病恢复;但若PD-1延迟表达或低水平表达,则易发展为急性肝衰竭[25]。我们推测,诱因激活CHB患者免疫反应,免疫细胞在清除病毒的同时损伤肝细胞,炎症因子增加,机体免疫自稳激活,诱导HBV特异性CTLs细胞上高表达CD244、PD-1等抑制分子,从而抑制效应细胞过度活化所造成的机体损伤,但若该分子表达量不足以抑制效应细胞功能或过迟表达则可能会使机体自稳调节减弱或者失败,最终导致病情恶化并进展至肝衰,甚至死亡;但若过早,过强,则会抑制免疫反应,导致病毒持续存在。因而CD244、PD-1等抑制分子在CHB患者体内上调表达与在急性乙型肝炎患者体内有着同样的作用,即可抑制效应细胞的细胞毒性功能,减少对肝细胞的杀伤,倘若其表达延迟或者过低,则疾病易演变为ACLF。HBV特异性CTLs表面CD244和PD-1共表达模式与CHB疾病进程相关这一推测,我们需要进一步随访观察疾病不同进展情况下的HBV特异性CTLs表面CD244、PD-1的表达情况与细胞功能变化来证实。
总之,本研究显示CD244在CHB患者外周血HBV特异性CTLs上高表达,并协同PD-1发挥着免疫抑制效应,提示CD244可能与CHB患者HBV特异性CTLs功能低下及CHB疾病进展相关。
[1]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].中华肝脏病杂志,2011,19(1):13 -24.
[2]邓 洪,崇雨田,韩晓燕,等.慢性乙型肝炎患者特异性细胞毒性T淋巴细胞的变化[J].中华肝脏病杂志,2006,14(10):721 -724.
[3]Wherry EJ.T cell exhaustion[J].Nat Immunol,2011,12(6):492-499.
[4]Peng G,Li S,Wu W,et al.PD-1 upregulation is associated with HBV-specific T cell dysfunction in chronic hepatitis B patients[J].Mol Immunol,2008,45(4):963-970.
[5]Tzeng HT,Tsai HF,Liao HJ,et al.PD -1 blockage reverses immune dysfunction and hepatitis B viral persistence in a mouse animal model[J].PLoS One,2012,7(6):e39179.
[6]Blackburn SD,Shin H,Haining WN,et al.Coregulation of CD8+T cell exhaustion by multiple inhibitory receptors during chronic viral infection[J].Nat Immunol,2008,10(1):29-37.
[7]Raziorrouh B,Schraut W,Gerlach T,et al.The immunoregulatory role of CD244 in chronic hepatitis B infection and its inhibitory potential on virus-specific CD8+T-cell function[J].Hepatology,2010,52(6):1934 -1947.
[8]Schlaphoff V,Lunemann S,Suneetha PV,et al.Dual function of the NK cell receptor 2B4(CD244)in the regulation of HCV-specific CD8+T cells[J].PLoS Pathog,2011,7(5):e1002045.
[9]中华医学会感染病学分会肝衰竭与人工肝学组,中华医学会肝病学分会重型肝病与人工肝学组.肝衰竭诊疗指南[J].中华肝脏病杂志,2006,14(9):643-646.
[10]Frank GM,Lepisto AJ,Freeman ML,et al.Early CD4+T cell help prevents partial CD8+T cell exhaustion and promotes maintenance of herpes simplex virus 1 latency[J].J Immunol,2010,184(1):277 -286.
[11]Rushbrook SM,Hoare M,Alexander GJ.T-regulatory lymphocytes and chronic viral hepatitis[J].Expert Opin Biol Ther,2007,7(11):1689 -1703.
[12]庄 鹏,王湘郴,罗国辉,等.慢性乙肝患者外周血CD4+CD25+FOXP3+Tregs及HBV抗原特异性CTLs的检测和分析[J].中国病理生理杂志,2011,27(9):1786-1789.
[13]Blackburn SD,Wherry EJ.IL-10,T cell exhaustion and viral persistence[J].Trends Microbiol,2007,15(4):143-146.
[14]高月求,孙学华,章晓鹰,等.乙肝病毒蛋白对慢性乙型肝炎患者PBMCs功能的影响[J].中国病理生理杂志,2007,23(6):1161 -1163.
[15]Zhou Q,Munger ME,Veenstra RG,et al.Coexpression of Tim-3 and PD-1 identifies a CD8+T-cell exhaustion phenotype in mice with disseminated acute myelogenous leukemia[J].Blood,2011,117(17):4501 -4510.
[16]Grosso JF,Goldberg MV,Getnet D,et al.Functionally distinct LAG-3 and PD-1 subsets on activated and chronically stimulated CD8 T cells[J].J Immunol,2009,182(11):6659-6669.
[17]Bengsch B,Seigel B,Ruhl M,et al.Coexpression of PD-1,2B4,CD160 and KLRG1 on exhausted HCV -specific CD8+T cells is linked to antigen recognition and T cell differentiation[J].PLoS Pathog,2010,6(6):e1000947.
[18]Mathew PA,Garni-Wagner BA,Land K,et al.Cloning and characterization of the 2B4 gene encoding a molecule associated with non-MHC-restricted killing mediated by activated natural killer cells and T cells[J].J Immunol,1993,151(10):5328 -5337.
[19]Boles KS,Nakajima H,Colonna M,et al.Molecular characterization of a novel human natural killer cell receptor homologous to mouse 2B4[J].Tissue Antigens,1999,54(1):27-34.
[20]Elishmereni M,Levi-Schaffer F.CD48:a co-stimulatory receptor of immunity[J].Int J Biochem Cell Biol,2011,43(1):25 -28.
[21]Bida AT,Upshaw NJ,Dick CJ,et al.2B4 utilizes ITAM-containing receptor complexes to initiate intracellular signaling and cytolysis[J].Mol Immunol,2011,48(9 -10):1149-1159.
[22]Chlewicki LK,Velikovsky CA,Balakrishnan V,et al.Molecular basis of the dual functions of 2B4(CD244)[J].J Immunol,2008,180(12):8159 -8167.
[23]Yamamoto T,Price DA,Casazza JP,et al.Surface expression patterns of negative regulatory molecules identify determinants of virus-specific CD8+T-cell exhaustion in HIV infection[J].Blood,2011,117(18):4805 -4815.
[24]谢冬英,陈凤娟,林炳亮,等.PD-1和PD-L1表达与慢性HBV感染者肝脏病变程度的相关性[J].中华实验和临床感染病杂志:电子版,2010,4(3):287-293.
[25]Zhang Z,Zhang JY,Wherry EJ,et al.Dynamic programmed death 1 expression by virus-specific CD8 T cells correlates with the outcome of acute hepatitis B[J].Gastroenterology,2008,134(7):1938 -1949.e3.

