不同剂量骨髓间充质干细胞移植对大鼠矽肺纤维化形成的影响*
赵曼曼, 崔建忠, 李 冉, 都凌杰, 田艳霞, 阚 泉, 张 娟, 高俊玲△
(1河北联合大学基础医学院组胚教研室,河北省煤矿卫生与安全实验室,2唐山市工人医院神经外科,河北 唐山 063000)
矽(尘)肺病是我国最为严重的职业卫生问题之一,在职业病中发病率和死亡率均较高,严重危害我国的生产力和劳动人民的身体健康,成为影响社会健康持续发展的重大公共卫生和社会问题。直至目前,矽肺纤维化的发病机理尚未明确,无早期诊断的特异性指标,无特异性治疗药物和方法,不可治愈,无法逆转。因此,寻找一种安全、有效、低毒的新型抗矽肺纤维化药物或措施已经成为迫切需要解决的问题。近年来,随着干细胞研究的深入发展,以骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)为代表的干细胞移植治疗在脂多糖(lipopolysaccharide,LPS)诱导的肺损伤、博来霉素和石棉引起的肺纤维化中有积极的效果[1]。然而,BMSCs在矽肺纤维化中是否同样发挥作用,至今鲜有文献报道。本实验采用SiO2气管内灌注法制作大鼠矽肺纤维化模型,并给予不同剂量BMSCs治疗,通过观察组织形态学改变、检测炎症因子及胶原蛋白表达情况,探讨BMSCs外源性移植对大鼠矽肺纤维化的疗效及其量效关系,为矽肺纤维化的防治研究提供一定的实验依据。
材料和方法
1 材料
1.1 动物 BMSCs的供体动物:选择SPF级幼年雄性SD大鼠10只,3~6周龄,体重100~120 g;BMSCs的受体动物:选择SPF级成年雌性SD大鼠50只,体重180~220 g,均由北京维通利华动物公司提供。
1.2 主要试剂 DMEM高糖培养基购自Gibco;10%胎牛血清购自HyClone;0.25%胰酶购自Sigma;SiO2粉尘购自Sigma;Masson三色染色试剂盒购自福州迈新生物技术开发有限公司;SABC免疫组化试剂盒购自武汉博士德生物有限公司;DAB显色试剂盒购自北京天根生物技术有限公司;BCIP/NBT显色液购自武汉博士德生物工程有限公司;RIPA裂解液及蛋白酶抑制剂购自上海贝博生物技术有限公司;PVDF膜购自Roche,Ⅰ抗羊抗鼠的多克隆抗体性别决定区Y(sex-determining region Y,SRY)蛋白及兔抗鼠的多克隆抗体肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、转化生长因子 β(transforming growth factor β,TGF -β)、Ⅰ型胶原、Ⅲ型胶原和β -actin均购自Santa Cruz;Ⅱ抗山羊抗兔IgG购自武汉博士德生物工程有限公司;Alexa Fluor标记的荧光Ⅱ抗驴抗羊IgG购自Santa Cruz。
2 方法
2.1 大鼠BMSCs的分离及培养 颈椎脱臼处死大鼠,无菌分离股骨和胫骨,暴露骨髓腔。用DMEM高糖培养基冲洗骨髓腔,收集冲洗液,1000 r/min低温离心10 min后弃去上清液,用含10%胎牛血清的DMEM高糖培养基重悬细胞。计数后按1×105/cm2密度接种于培养瓶中,置于37℃、5%CO2孵箱中培养,48 h后首次换液,以后每2~3 d换液1次。待细胞95%融合时,用0.25%胰酶消化,按1∶2的比例进行传代,细胞传至第3代用于实验。
2.2 实验分组及动物模型制备 将50只雌性SD大鼠随机分为5组:(1)对照组:每只大鼠左、右支气管内各灌注灭菌氯化钠溶液0.5 mL;(2)矽肺模型组:每只大鼠左、右支气管内各灌注灭菌氯化钠溶液与SiO2粉尘混悬液(50 g/L)0.5 mL;(3)BMSCs治疗A组:每只大鼠于造模成功后24 h经尾静脉注射BMSCs与DMEM悬液1.0 mL(1×109/L);(4)BMSCs治疗B组:每只大鼠于造模成功后24 h经尾静脉注射BMSCs与DMEM悬液1.0 mL(3×109/L);(5)BMSCs治疗C组:每只大鼠于造模成功后24 h经尾静脉注射BMSCs与DMEM悬液1.0 mL(5×109/L)。于造模后21 d处死各组大鼠取材备用。
2.3 肺组织形态学检测 取右肺下部肺组织以质量分数为4%多聚甲醛常规固定24 h、梯度乙醇脱水、二甲苯透明、浸蜡、石蜡包埋、5 μm连续切片。进行HE染色及Masson染色(按Masson三色染色试剂盒说明书进行操作),光学显微镜下观察。
2.4 免疫组织化学法检测TNF-α和TGF-β 操作按SABC免疫组化试剂盒说明进行,烤片,脱蜡,灭活,抗原修复,BSA封闭,兔抗鼠的多克隆抗体4℃孵育过夜(均为 1∶50),阴性对照用 PBS(0.01 mol/L,pH 7.3)代替Ⅰ抗孵育,山羊抗兔IgG室温孵育30 min,SABC室温20 min,DAB显色。苏木素轻度复染,中性树胶封片。将切片用Image Pro-Plus 6.0图像分析系统进行分析,以积分吸光度(integrated absorbance value,IA)值表示,每张切片随机选择10个(400倍)具有代表性的相互非重叠高倍视野进行测定。
2.5 免疫印迹法检测 TNF-α、TGF-β、Ⅰ型胶原和Ⅲ型胶原的蛋白表达量 取肺组织100 mg,加入1 mL RIPA裂解液,4 μL蛋白酶抑制剂,低温下匀浆,10000 r/min低温离心10 min。标准蛋白曲线测定上清蛋白浓度,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转移至PVDF膜上。5% 脱脂奶粉37℃封闭2 h,兔抗鼠多克隆抗体(TNF-α、TGF-β和 β-actin工作浓度:1∶500)4℃孵育过夜,山羊抗兔IgG(工作浓度:1∶3000)37℃孵育2 h。以BCIP/NBT避光显色。将PVDF膜用扫描仪扫描后,经ImageJ图像分析系统进行半定量分析,以目标与内参照(β-actin)吸光度(A)值的比值作为分析对象进行比较。
2.6 免疫荧光染色法检测SRY表达情况 留取心、肝、脾、肾、肺组织标本,经 4%甲醛固定 24 h,入30%蔗糖溶液(0.1 mol/L PBS,pH 7.4),浸泡至组织块沉底,OCT包埋剂包埋,恒温箱冰冻切片机切片(片厚15 μm)。滴加0.4%Triton -100 孵育10 min,驴血清封闭1 h,滴加SRY抗体(工作浓度:1∶200),4℃湿盒孵育过夜,阴性对照用PBS(0.01 mol/L,pH 7.3)代替Ⅰ抗孵育,加入Alexa Fluor标记的荧光Ⅱ抗(工作浓度:1∶1000),37℃湿盒避光孵育2 h,中性甘油封片,用激光扫描共聚焦显微镜(Olympus FV1000)观察并摄片。
3 统计学处理
结 果
1 BMSCs的形态学观察
原代细胞在48 h之内贴壁,以分散的克隆聚集方式增殖,细胞形态基本为均匀纺锤形和梭形,核居中,偶有宽大扁平的多边形细胞。造血干细胞及其它细胞呈非贴壁生长,通过多次换液逐渐减少,BMSCs纯化。2周后原代细胞95%融合,进行传代。传代后细胞度过生长抑制期,增长加速,呈现漩涡状和放射状集落生长倾向,随着传代次数增加,细胞形态更为均一,为梭形成纤维细胞样。本实验所用细胞为第3代BMSCs。依据细胞的生长特性、形态特征和前期实验流式细胞仪检测结果,鉴定其为BMSCs。
2 HE染色形态学检测结果
对照组见肺泡结构清晰,肺泡壁薄,未见明显炎细胞浸润。矽肺模型组见肺泡间隔增宽,肺间质炎症细胞浸润,以巨噬细胞和淋巴细胞浸润为主,有明显矽结节形成。BMSCs治疗A组肺泡间隔略增宽,少量炎症细胞浸润,矽结节少且小。BMSCs治疗B组较A组的病理改变更轻。BMSCs治疗C组较矽肺模型组病变程度加重,肺泡结构破坏消失,矽结节多且大,并且出现部分融合现象,见图1。

Figure1.The morphological observation of lung tissue in each group(HE staining,×200).A:control group;B:model group;C:BMSCs A group;D:BMSCs B group;E:BMSCs C group.图1 各组大鼠肺组织形态学观察
3 Masson染色形态学检测结果
Masson染色可见胶原纤维呈蓝色,肌纤维、胞质、红细胞呈红色,细胞核呈蓝褐色。对照组大鼠肺间质内有少量纤细的胶原分布。矽肺模型组肺组织见大片状密集的胶原纤维沉积,小血管壁及支气管周围胶原增生明显,并向肺间质延伸,呈网状或束状。BMSCs治疗A组大鼠肺组织胶原沉积明显减少,呈小片状或小束状,BMSCs治疗B组较A组改善情况更显著。BMSCs治疗C组较矽肺模型组肺组织胶原沉积更加致密,且结节内数量不等的胶原纤维呈同心圆排列,纤维化程度加重,见图2。

Figure2.The collagen changes of lung tissue in each group(Masson staining,×400).A:control group;B:model group;C:BMSCs A group;D:BMSCs B group;E:BMSCs C group.图2 各组大鼠肺组织的胶原变化
4 TNF-α和TGF-β的免疫组织化学检测结果
TNF-α和TGF-β阳性表达产物为棕褐色,呈颗粒状分布于胞浆中,颜色越深表达越强,细胞核复染呈蓝色。对照组TNF-α和TGF-β阳性细胞偶见于肺泡间质。矽肺模型组见大量棕黄色阳性细胞,多数聚集在矽结节内,并主要定位于炎症细胞和巨噬细胞的胞浆。BMSCs治疗A组较矽肺模型组阳性细胞表达有下降趋势,数量减少,强度减弱(P<0.05)。BMSCs治疗B组较A组阳性细胞数量和强度减少减弱更加明显(P<0.05)。BMSCs治疗C组较矽肺模型组阳性细胞数量略增多,表达强度略增强(P >0.05),见图3、4和表1。
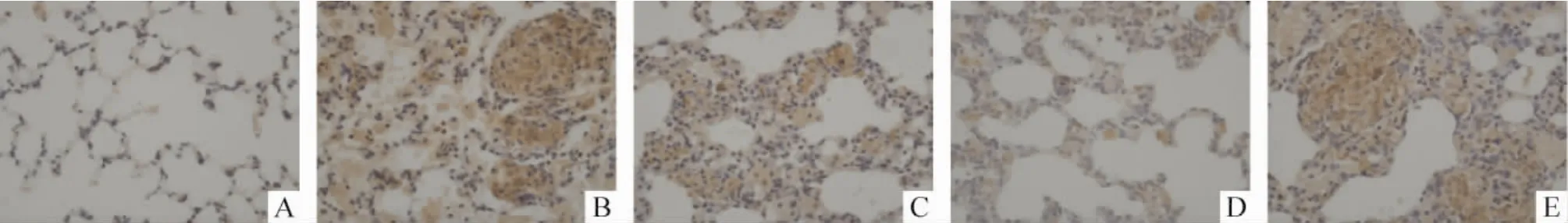
Figure3.The expression of TNF-α protein of lung tissue in each group(immunohistochemical staining,×400).A:control group;B:model group;C:BMSCs A group;D:BMSCs B group;E:BMSCs C group.图3 各组大鼠肺组织TNF-α蛋白表达

Figure4.The expression of TGF-β protein of lung tissue in each group(immunohistochemical staining,×400).A:control group;B:model group;C:BMSCs A group;D:BMSCs B group;E:BMSCs C group.图4 各组大鼠肺组织TGF-β蛋白表达
表1 各组大鼠肺组织TNF-α和TGF-β蛋白的表达Table1.The expression of TNF-α and TGF-β proteins of lung tissue in each group(IA..n=10)

表1 各组大鼠肺组织TNF-α和TGF-β蛋白的表达Table1.The expression of TNF-α and TGF-β proteins of lung tissue in each group(IA..n=10)
*P <0.05 vs control group;▲P <0.05 vs model group;★P <0.05 vs BMSCs A group.
Protein Control Model BMSCs A BMSCs B BMSCs C TNF - α 14.83 ±1.68 45.87 ±3.18* 30.84 ±2.36▲* 20.84 ±2.23▲★* 49.05 ±3.36*TGF - β 14.31 ±1.42 41.93 ±2.89* 27.05 ±2.16▲* 19.52 ±2.06▲★* 43.85 ±3.24*
5 免疫印迹法检测TNF-α、TGF-β、Ⅰ型胶原和Ⅲ型胶原结果
对照组TNF-α、TGF-β、Ⅰ型胶原和Ⅲ型胶原仅有少量基础表达。矽肺模型组较模型对照组其蛋白表达明显增强(P<0.05)。BMSCs治疗A组较矽肺模型组蛋白表达明显减弱(P<0.05),BMSCs治疗B组较A组蛋白表达减弱更加显著 (P<0.05),但仍高于对照组表达量,BMSCs治疗C组较矽肺模型组蛋白表达略增强(P>0.05),见图5。
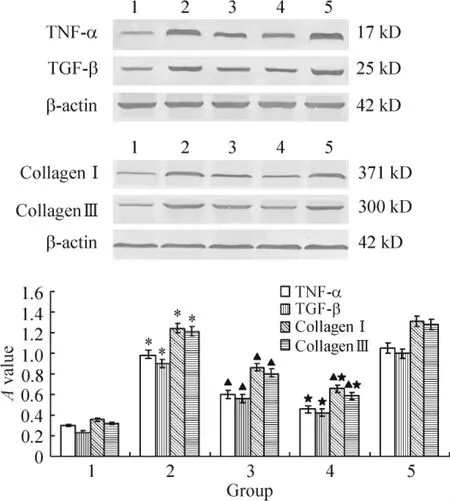
Figure5.The expression of TNF-α,TGF-β,collagenⅠand collagenⅢproteins in lung tissues..n=10.*P<0.05 vs control group;▲P <0.05 vs model group;★P<0.05 vs BMSCs A group.1:control group;2:model group;3:BMSCs A group;4:BMSCs B group;5:BMSCs C group.图5 各组大鼠 TNF-α、TGF-β、collagenⅠ和 collagenⅢ蛋白的表达
6 SRY的免疫荧光法检测结果
SRY阳性表达产物为绿色荧光,分布于胞核中。BMSCs治疗B组的心、肝、脾、肾、肺组织荧光染色切片在激光扫描共聚焦显微镜下观测结果示:心、脾组织中未见绿色荧光,肝、肾组织中见微量绿色荧光(BMSCs在血流丰富器官瘀滞所致),肺组织中见大量绿色荧光呈散点状分布,见图6。
讨 论

Figure6.The expression of SRY of different organs in BMSCs B group(immunofluorescence,×400).A:heart;B:liver;C:spleen;D:kidney;E:lung.图6 BMSCs治疗B组大鼠心、肝、脾、肾、肺组织中SRY表达
矽肺纤维化的损伤机制复杂,且损伤后的逆转需要多角度、多环节、多靶标的干预策略,至今临床上尚无明确有效的治疗方法。目前鉴于对矽肺发生后组织异常修复的认识,使得BMSCs在肺损伤中的角色逐渐引起生命科学界的关注。BMSCs是来源于骨髓的一种多能干细胞,具有高度自我更新和多方向分化的潜能(可分化为脂肪细胞、心肌细胞、骨骼肌细胞、神经细胞和内皮细胞等多种组织细胞类型);还可感知损伤信号,迁移至损伤区,发挥修复和再生的能力[2];并且具有较强的免疫调节功能,进行异体移植时可避免免疫排斥反应[3];除此之外,BMSCs具有旁分泌功能,可生成多种细胞因子,促进血管再生及损伤修复[4]。因此,BMSCs已经成为具有广泛应用前景的各种疾病的细胞与基因治疗来源。近几年来,较多研究者不仅在动物损伤模型(脑损伤、心肌损伤、脊髓损伤、骨损伤等)中证实明BMSCs的疗效,还在诸多器官纤维化疾病中发现BMSCs能够减轻胶原沉积,防治靶器官纤维化,在临床上具有巨大的潜在应用价值。正如Zheng等[5]证实BMSCs可抑制二乙基亚硝胺(diethylnitrosamine,DEN)诱导的小鼠肝纤维化的形成,并发现BMSCs在一定的微环境诱导下可分化为肝细胞,修复肝损伤,恢复肝功能,降低肝纤维化。同年Lan等[6]证实移植BMSCs可下调肝纤维化大鼠炎症反应,促进肝再生,抑制活化肝星状细胞,改善肝脏病理组织学和肝功能。此外,BMSCs还被广泛用于治疗急慢性心肌梗死,拮抗心肌纤维化。BMSCs可以转化为心肌细胞参与心肌收缩、改善梗死区血运、抑制心室重构,最终促进心肌梗死后心功能的恢复[7],并可通过旁分泌机制,减少心梗面积,增强心肌梗死的修复[8]。
总之,BMSCs为器官纤维化的防治提供了一条崭新的思路,同时也给肺纤维化的防治带来了希望。然而,BMSCs在肺领域的应用研究落后于其它器官,主要由于肺组织细胞来自多胚层、结构功能复杂,所以目前尚处于动物实验阶段。有研究者将BMSCs注入博来霉素所致的肺纤维化动物模型后,发现其可向肺部移行,具有明显趋化移居倾向,并且可分化为肺泡上皮细胞和血管内皮细胞等,参与损伤肺组织的修复重建[9]。尽管BMSCs在矽肺纤维化中的应用至今鲜有文献报道,但如上所述为我们的设想提供了现实可行的依据。
本次实验以此为基础展开,为了更好的示踪BMSCs在体内聚集、存活及分布状况,提取雄性幼鼠的BMSCs注入雌性成年大鼠体内,通过监测SRY的表达示踪BMSCs情况。有关移植时间窗的选择,我们参照 Ortiz等[10]及 Cui等[11]的研究结果,损伤后早期进行BMSCs输注有显著的治疗效果,这与肺内损伤部位微环境随病程发展变化有关,因此在矽肺模型制备成功后24 h经尾静脉注射BMSCs进行治疗。形态学结果显示:BMSCs移植治疗后,肺间质炎症细胞浸润减少、矽结节的数量及大小减少减小、胶原沉积及纤维化程度减轻。提示BMSCs可减缓矽肺纤维化的病理进程,推测可能通过BMSCs向II型肺泡上皮细胞分化,在一定程度上恢复和重建肺泡上皮细胞池,使之不至于被耗尽,增加肺泡上皮细胞的来源,不断替代已破坏的细胞,促进组织修复,维持肺组织结构和功能的完整性。TNF-α和TGF-β是肺泡巨噬细胞(alveolar macrophages,AM)吞噬粉尘后释放的主要致炎致纤维化因子,在矽肺纤维化的发生发展中具有重要作用。Ⅰ型胶原、Ⅲ型胶原可代表晚期胶原的沉积情况,反映纤维化程度。这些可作为观测BMSCs治疗矽肺纤维化疗效的指标。免疫组织化学及免疫印迹结果显示:BMSCs可下调TNF-α、TGF-β、Ⅰ型胶原、Ⅲ型胶原的表达,其可能机制是BMSCs旁分泌白细胞介素-1受体拮抗剂(interleukin-1 receptor antagonist,IL1RN)[12]、TNF-α拮抗剂[10]等细胞因子,来减少炎症因子的产生及阻断导致纤维化的信号通路,发挥抗炎/抗纤维化的作用。那么此疗效与移植细胞的数量是否有关联,我们将进一步探讨。实验中在BMSCs治疗组设3个剂量梯度,结果显示中剂量组较低剂量组的治疗效果显著,高剂量组不但没有起到治疗作用反而加重病情,其具体机制未明,可能由于过量的BMSCs在体内微环境的调控下分化为肌成纤维细胞和成纤维细胞[13],加重矽肺纤维化程度。由此推断BMSCs治疗矽肺纤维化需要合适的细胞数量,疗效与剂量之间并非正比直线关系。其具体的机制还有待进一步研究证实。
综上所述,本研究证实了BMSCs对矽肺纤维化有积极的治疗效果,可缓解并部分逆转肺纤维化的病理状态、减轻炎症反应、抑制晚期胶原沉积、拮抗纤维化的发生,促进肺组织损伤后的修复重建,且此疗效与移植细胞数量相关。为BMSCs面向临床的应用提供理论和实验依据,对预防、治疗乃至最终消除矽肺具有重要的经济和社会意义。
[1]Brody AR,Salazar KD,Lankford SM.Mesenchymal stemcells modulate lung injury[J].Proc Am Thorac Soc,2010,7(2):130-133.
[2]Li X,Song G.Roles of matrix metalloproteinase in migration and differentiation of bone marrow-derived mesenchymal stem cells[J].Sheng Wu Yi Xue Gong Cheng Xue Za Zhi,2012,29(2):387 -391,396.
[3]Le Blanc K,Ringdén O.Immunomodulation by mesenchymal stem cells and clinical experience[J].J Intern Med,2007,262(5):509-525.
[4]Liu Y,Dulchavsky DS,Gao X,et al.Wound repair by bone marrow stromal cells through growth factor production[J].J Surg Res,2006,136(2):336-341.
[5]Zheng JF,Liang LJ.Intra- portal transplantation of bone marrow stromal cells ameliorates liver fibrosis in mice[J].Hepatobiliary Pancreat Dis Int,2008,7(3):264 -270.
[6]Lan L,Chen Y,Sun C,et al.Transplantation of bonemarrow-derived hepatocyte stem cells transduced with adenovirus-mediated IL-10 gene reverses liver fibrosis in rats[J].Transpl Int,2008,21(6):581 -592.
[7]Li JH,Zhang N,Wang JA.Improved anti-apoptotic and anti-remodeling potency of bone marrow mesenchymal stem cells by anoxic pre-conditioning in diabetic cardiomyopathy[J].J Endocrinol Invest,2008,31(2):103 -110.
[8]Fang J,Chen L,Fan L,et al.Enhanced therapeutic effects of mesenchymal stem cells on myocardial infarction by ischemic postconditioning through paracrine mechanisms in rats[J].J Mol Cell Cardiol,2011,51(5):839-847.
[9]Zhang X,Wang H,Shi Y,et al.Role of bone marrowderived mesenchymal stem cells in the prevention of hyperoxia-induced lung injury in newborn mice[J].Cell Biol Int,2012,36(6):589 -594.
[10]Ortiz LA,Gambelli F,McBride C,et al.Mesenchymal stem cell engraftment in lung is enhanced in response to bleomycin exposure and ameliorates its fibrotic effects[J].Proc Natl Acad Sci U S A,2003,100(14):8407-8411.
[11]Cui A,Dai HP,Dai JW,et al.Effects of bone marrow mesenchymal stem cells on bleomycin induced pulmonary fibrosis in rats[J].Zhonghua Jie He He Hu Xi Za Zhi,2007,30(9):677-682.
[12]Ortiz LA,Dutreil M,Fattman C,et al.Interleukin 1 receptor antagonist mediates the antiinflammatory and antifibrotic effect of mesenchymal stem cells during lung injury[J].Proc Natl Acad Sci U S A,2007,104(26):11002-11007.
[13]Rojas M,Xu J,Woods CR,et al.Bonemarrow-derived mesenchymal stem cells in repair of the injured lung[J].Am J Respir Cell Mol Biol,2005,33(2):145 -152.

