人骨形态发生蛋白2和9对人胃癌MNK-45细胞增殖、凋亡和迁移的影响及其机制
叶立伟, 陈 娴,武 睿, 段 亮,张昀源, 杨 霞,王海燕, 何通川,周 兰
(重庆医科大学检验医学院临床检验诊断学教育部重点实验室,重庆 400016)
胃癌是一种常见的消化道恶性肿瘤,其病因和发病机制目前并未完全阐明,目前比较明确的是幽门螺杆菌的感染与其相关,虽然抗幽门螺杆菌治疗的成功使胃癌的发生已有所减低[1],但其发病率和致死率仍位于癌症的第4位和第2位[2],仍然是危害人类健康的主要杀手之一,故此,我们对胃癌的基础研究仍需不断加强。
骨形态发生蛋白(bone morphogenetic proteins,BMPs)是转化生长因子β(transforming growth factor β,TGF-β)超家族的成员之一,最初因其能诱导骨的形成而得名。近来的研究发现该家族多个成员和肿瘤的发生发展及转归有密切的关系,已有关于抑制脑肿瘤、前列腺癌、结直肠癌的生长和促进其凋亡的报道[3-5],我们前期研究发现BMPs对骨肉瘤也有抑制作用[6]。关于BMPs对胃癌的报道存在较大的争议,有学者认为BMP2高表达可以促进胃癌的转移,是预后不良的表现[7];也有报道BMP2基因甲基化失活可能与胃癌的发生相关,过表达BMP2可以抑制胃癌细胞的增殖[8-9]。为进一步探讨BMP对胃癌细胞的作用,我们以重组腺病毒 AdBMP2和AdBMP9感染人胃癌MNK-45细胞,观察MNK-45细胞的增殖、凋亡和迁移情况。
Wnt/β-catenin信号途径与肿瘤的发生发展密切相关[10],β-catenin在胞浆中的高度聚积是该途径活化的标志。很多研究提示在胃癌的发生发展过程中,Wnt/β -catenin被异常激活[11]。GSK -3β 是多功能的丝氨酸/苏氨酸类蛋白激酶,其功能的发挥主要受自身磷酸化位点的影响,通常认为Tyr216的磷酸化使其活化,而 Ser9的磷酸化会使其失活[12-13],目前发现 GSK -3β 可以作用于40 多种蛋白底物,对细胞的生长、分化、迁移和凋亡均有影响[13]。为探讨BMP2和BMP9对MNK-45细胞的作用机制是否是通过Wnt/β-catenin信号途径,我们观察了重组腺病毒AdBMP2和AdBMP9感染的MNK-45细胞β-catenin和GSK-3β的表达水平。
材料和方法
1 材料
胃癌细胞 MNK-45、重组腺病毒 AdBMP2、AdBMP9和AdGFP均由美国芝加哥大学医学中心分子肿瘤研究室何通川教授惠赠;DMEM培养基和胎牛血清(fetal bovine serum,FBS)购自HyClone;细胞培养板购自Corning Costar;MTT和DMSO购自Sigma;Hoechst 33258染料购自江苏碧云天生物技术研究所;所用的Ⅰ抗包括 BMP2、BMP9、GSK-3β、p-GSK-3β(Ser9)和β-catenin均购自Santa Cruz;兔抗羊免疫组化试剂盒PV-6002(Ⅱ抗)和DAB购自北京中杉金桥公司。
2 细胞培养
胃癌细胞MNK-45用DMEM,加入 10%FBS和1%青、链霉素,0.25%胰蛋白酶消化后置于37℃、5%CO2饱和湿度箱中培养,此细胞为贴壁生长型细胞。
3 实验分组
(1)空白组:不施加任何处理因素的MNK-45细胞;(2)实验对照组:AdGFP感染的MNK-45细胞;(3)实验组:AdBMP2和AdBMP9分别感染MNK-45细胞。每组实验至少重复3次。
4 方法
4.1 免疫细胞化学(immunocytochemistry,ICC) 对数生长期胃癌细胞制备细胞爬片(24孔板),每组设3个复孔,当细胞株融合度达50%左右时分别加入适量相应的腺病毒(荧光显微镜下观察感染病毒的细胞占总细胞的30%左右为宜),37℃、5%CO2培养箱中继续观察和培养,分别于感染后48 h弃去旧培养基,进行ICC,具体操作见北京中杉金桥公司免疫组化试剂盒说明书(注:胞浆中有棕黄色颗粒为阳性)。实验结果用Image-Pro Plus(IPP)6.0分析。
4.2 MTT法检测细胞增殖能力 用0.25%胰蛋白酶消化MNK-45细胞,制成单细胞悬液,以每孔1000个接种于96孔板中,每组设6个复孔,每孔100 μL完全培养基,待细胞贴壁后按照实验分组分别加入AdGFP、AdBMP2和 AdBMP9,6~8 h后换成双无培养基,此时记为0 h,于24 h始用MTT法于波长为492 nm处测吸光度(A);连续检测5 d。
4.3 Hoechst 33258荧光染色法和流式细胞术(flow cytometry,FCM)检测细胞凋亡率 Hoechst 33258荧光染色法:对数生长期骨肉瘤细胞种板(24孔板),每组设3个复孔,当细胞株融合度达60% ~70%时分别加入相应的腺病毒,37℃、5%CO2培养箱中继续观察和培养,6~8 h后换成含1%FBS的培养基,此时开始计时,72 h后按照凋亡试剂盒检测凋亡细胞,并计算凋亡率。凋亡率(%)=凋亡细胞数/细胞总数×100%。
FCM:取对数生长期的MNK-45细胞以2.5×105接种于T25培养瓶,贴壁后进行实验干预,分组及处理方式同前。72 h后,收集各组细胞,PBS洗2次,1 mL PBS重悬细胞。30 min内送重庆医科大学生命科学院进行检测。
4.4 划痕愈合实验和Transwell小室检测细胞迁移能力
4.4.1 划痕愈合实验 对数生长期MNK-45细胞种板(6孔板),细胞融合度达70% ~80%时分别用相应的腺病毒感染,6~8 h换液,24 h后镜下观察感染病毒的细胞占总细胞的30%左右,并用10 μL Tips头(Fisher)在孔的正中轻轻做十字划痕,于72 h取出孔板,在同一观察点处动态观察划痕愈合情况。比较各组细胞的愈合情况,通过测量多个点划痕宽度,计算平均划痕愈合率。划痕愈合率(%)=(0 h划痕宽度-72 h划痕宽度)/0 h划痕宽度×100%。
4.4.2 Transwell小室 将小室置于24孔细胞培养板内,超净台内紫外线照射过夜。用不含血清的培养液制备单细胞悬液,将MNK-45细胞密度调整为3×105cells/well与400 μL双无DMEM培养基混匀加入上室中;在下室即24孔板内加入600 μL含20%FBS的DMEM培养液。培养48 h后,结晶紫染液常温染色30 min,PBS洗3次。染色完毕后将小室自然风干,将小室膜置于载玻片上在显微镜下观察、计穿膜细胞数。
4.5 Western blotting检测蛋白的表达水平 对数生长期MNK-45细胞,细胞融合度达60% ~70%时分别用相应的腺病毒感染,6~8 h换液,24 h后镜下观察病毒感染情况在30%左右,此时开始计时。72 h后提取细胞总蛋白,分光光度法测蛋白浓度,每个上样孔以200 μg的量上样 ,所有Ⅰ抗的稀释度均为1∶1000,按DAB试剂盒说明书进行化学发光检测,并用Gel Doc凝胶成像仪采集图像;用Quantity One 4.5.0软件测定各条带的灰度值。
5 统计学处理
结 果
1 重组腺病毒携带的目的基因BMP2和BMP9在MNK-45细胞中成功表达
ICC法示AdBMP2和 AdBMP9感染48 h后,BMP2和BMP9的表达水平明显高于空白组和AdGFP组,IPP软件分析棕色颗粒的吸光度值示AdBMP2组是 GFP 组的 1.89倍(P <0.05),而AdBMP9组是AdGFP 组的1.67倍(P <0.05),表明重组腺病毒携带的目的基因BMP2和BMP9在被感染的MNK-45细胞中成功表达,见图1。

Figure1.Expression of BMP2 and BMP9 in MNK -45 cells after infected with AdGFP,AdBMP2 or AdBMP9 measured using immunocytochemistry assay(×100).图1 免疫细胞化学检测AdBMP2或AdBMP9感染MNK-45细胞48 h后BMP2和BMP9蛋白的表达
2 上调BMP2和BMP9表达抑制胃癌细胞MNK-45的增殖
MTT法显示,AdBMP2组和AdBMP9组的MNK-45活细胞数在前3 d较对照组无明显变化;AdBMP2组第4、5 d的活细胞数分别较GFP组降低34.39%和49.15%,两组差异有统计学意义(P<0.05);AdBMP9组第 4、5 d的活细胞数分别较AdGFP组降低36.20%和56.13%,两组差异有统计学意义(P<0.05),见图2。这说明BMP2和 BMP9抑制MNK-45细胞的增殖,并呈时间依赖性。
3 上调BMP2和BMP9表达促进胃癌细胞MNK-45的凋亡

Figure2.Effects of BMP2 and BMP9 overexpression on proliferation of MNK-45 cells measured using MTT assay..n=3.*P <0.05 vs AdGFP group.图2 BMP2和BMP9作用后胃癌细胞MNK-45增殖的变化
AdBMP2和AdBMP9作用于MNK-45细胞72 h后,Hoechst33258染色可见这2组凋亡细胞数目较空白组和AdGFP组明显增加,AdBMP2组细胞凋亡率较AdGFP组增加2.58倍(P<0.01);AdBMP9组细胞凋亡率较AdGFP组增加2.69倍(P<0.01),空白组与AdGFP组相比无明显差异,见图3A、C。
流式细胞术显示,AdBMP2组和AdBMP9组凋亡细胞数目较空白组和AdGFP组明显增加,AdBMP2组早期凋亡细胞是AdGFP组的3.22倍(P<0.01),晚期凋亡细胞是 AdGFP组的2.12倍(P<0.05);AdBMP9组早期凋亡细胞是AdGFP组的1.86倍(P<0.05),晚期凋亡细胞是AdGFP组的5.18倍(P<0.01);空白组与AdGFP组相比无明显差异,见图3B、D。Hoechst 33258染色与流式细胞术一致,提示BMP2和BMP9均可以促进MNK-45细胞的凋亡。
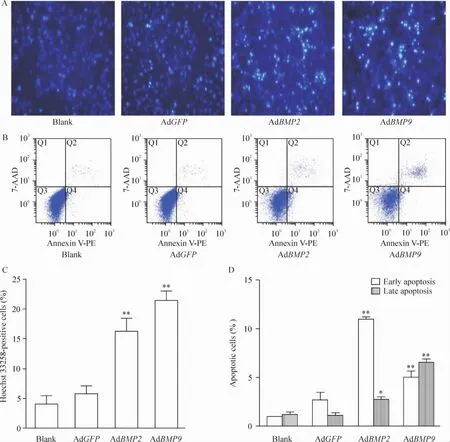
Figure3.The effects of BMP2 and BMP9 overexpression on apoptosis of MNK -45 cells.Apoptosis was measured using Hoechst 33258 staining(×100;A,C)and flow cytometry(B,D)after 72 h..n=3.*P<0.05,**P<0.01 vs AdGFP group.图3 BMP2和BMP9作用后MNK-45细胞的凋亡情况
4 上调BMP2和BMP9表达抑制胃癌细胞MNK-45的迁移
图4可以看出空白对照组和AdGFP组划痕均在72 h基本愈合,而AdBMP2组和AdBMP9组可见细胞往划痕区生长,愈合率分别是59.91% ±2.41%和49.91%±2.19%,与对照组比差异显著(P<0.01),空白组与AdGFP组之间无明显差异(P>0.05)。
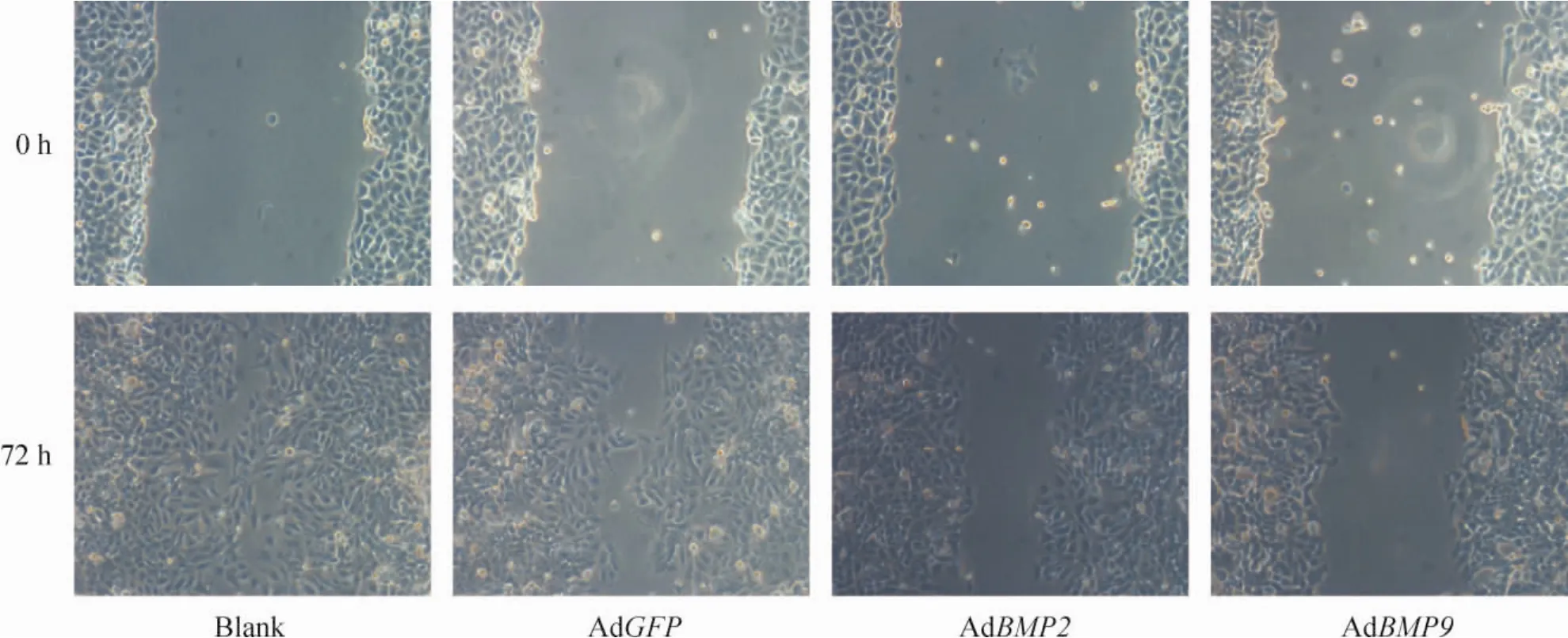
Figure4.Effects of BMP2 and BMP9 overexpression on the migration of MNK-45 cells measured by wound healing assay(×100).图5 BMP2和BMP9作用MNK-45细胞后迁移能力的改变
图5显示AdBMP2组和AdBMP9组较AdGFP组的穿膜细胞数明显减少,AdBMP2组为AdGFP组的36.84%,AdBMP9组为 AdGFP 组的38.12%,分别较AdGFP组降低61.88% 和 63.16%,差异显著(P<0.01),而空白组与AdGFP组之间无明显差异(P >0.05)。
以上2个实验均表明,BMP2和BMP9均可以抑制胃癌细胞MNK-45的迁移。
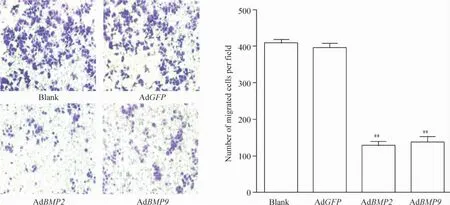
Figure5.Effects of BMP2 and BMP9 overexpression on the migration of MNK-45 cells measured by Transwell chambers(×150)..n=3.**P<0.01 vs AdGFP group.图5 BMP2和BMP9作用MNK-45细胞后迁移能力的改变
5 上调BMP2和BMP9表达促进胃癌细胞MNK-45 p-GSK-3β的表达
Western blotting检测发现,AdBMP2和AdBMP9作用于MNK-45细胞72 h后,这2组p-GSK-3β的表达量分别较AdGFP组增加9.94倍(P<0.01)和15.97倍(P <0.01),AdGFP 组和空白对照组之间的差异无统计学意义(P>0.05);而各组间总GSK-3β的表达量相比均无明显差异(P>0.05),提示BMP2和BMP9能增加MNK-45细胞p-GSK-3β的水平,但对总GSK-3β无明显影响,见图6。图6还显示,无论AdBMP2还是AdBMP9的处理都对β-catenin的表达量无明显影响(P>0.05)。
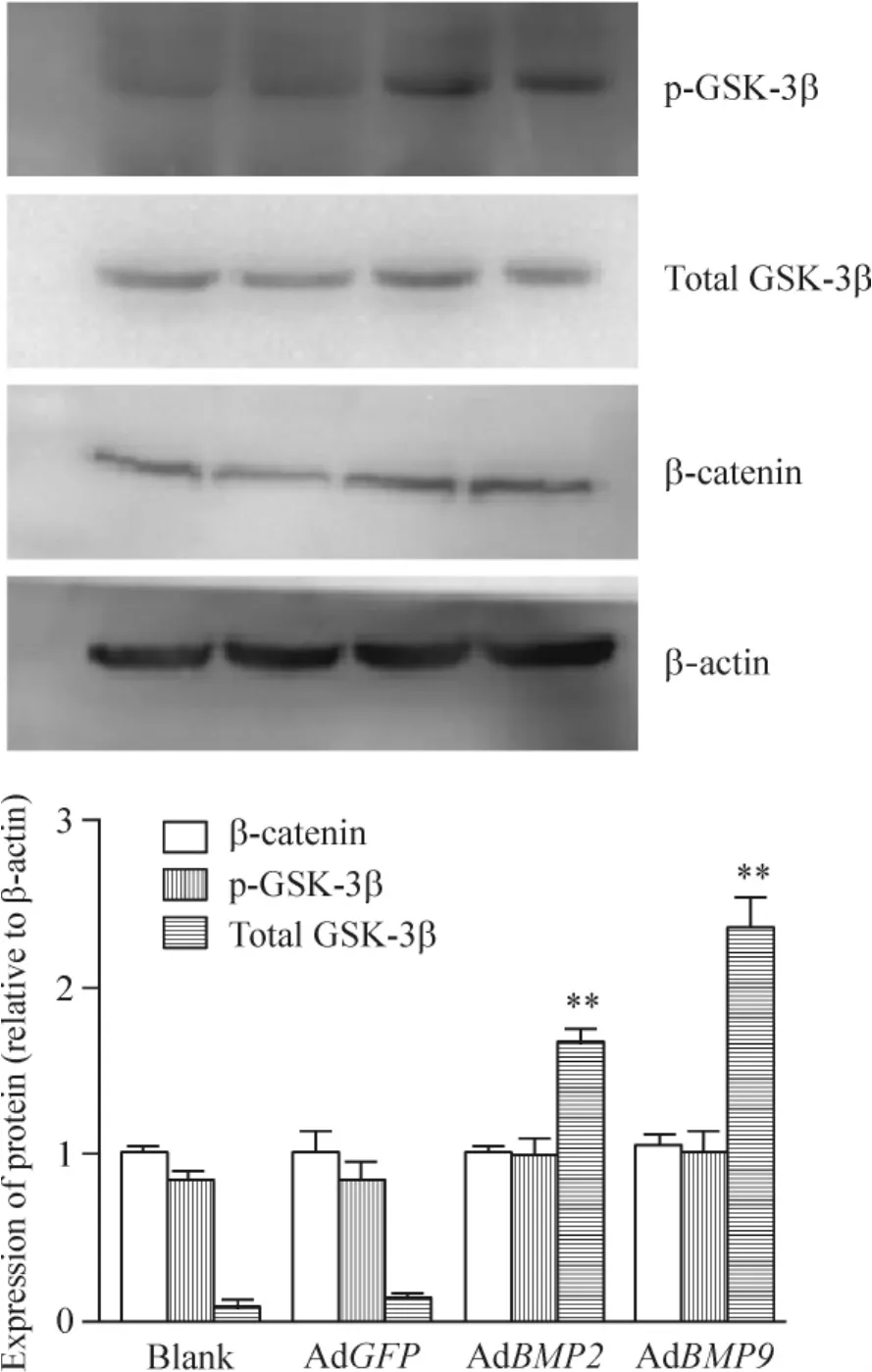
Figure6.GSK -3β and β -catenin protein expression in MNK-45 cells infected with AdBMP2 and AdBMP9 for 72 h detected by Western blotting..n=3.**P<0.01 vs AdGFP group.图6 BMP2和BMP9对 MNK-45细胞内 GSK-3β和β-catenin表达水平的影响
讨 论
BMP2和BMP9作为TGF-β蛋白家族的成员,在本研究中发现,其对人胃癌细胞MNK-45的增殖具有抑制作用,并且该作用呈一定的时间依赖性;同时,能够促进该细胞凋亡,抑制其迁移。这与我们前期研究BMPs成员对骨肉瘤的抑制和文献报道的对结直肠癌的抑制性作用是一致的[5-6],以上提示其在肿瘤的治疗发面具有潜在的临床价值。同时,我们发现BMP2和BMP9均能使胃癌MNK-45细胞的p-GSK-3β水平升高,但对总GSK-3β和 β-catenin的表达无明显影响,而GSK-3β和 βcatenin都是经典Wnt/β-catenin途径的关键分子,二者是否与BMPs对胃癌MNK-45的抑制作用有关呢?首先我们了解一下Wnt/β-catenin途径:是一组胞间分泌蛋白Wnts,通过与细胞膜上Frz受体家族成员作用将信号传到细胞内,经DVL蛋白传至GSK-3β,使其功能受到抑制,致使β-catenin、GSK-3β和APC形成的蛋白降解复合体不能磷酸化β-catenin,继而抑制其泛素化和降解,导致胞浆中游离的β-catenin增多,后者便进入胞核与转录活化因子TCF结合,启动下游靶基因的转录。β-catenin是该途径的中心分子,它在胞浆中的水平升高是该途径激活的标志。而在本文中虽然GSK-3β发生了磷酸化失活,但是什么原因导致β-catenin的表达水平无变化呢?
一般认为 p-GSK-3β磷酸化失活有2种作用[12],一种是使Wnt信号通路降解复合体解聚,β-catenin的磷酸化受抑制,而在胞浆中大量积聚,但是本研究中却发现BMP2和BMP9虽然使p-GSK-3β增高,但对 β-catenin的表达影响却不大,其原因可能是GSK-3β对β-catenin的影响本身就很复杂,它除了通过参与降解复合体影响βcatenin,也可以通过其它途径,比如presenilin 1蛋白,在CHO、HEK293、MEF等细胞中 GSK -3β 磷酸化失活可以使presenilin 1蛋白升高,而后者通过其它分子降低细胞中β-catenin的稳定性从而促进其降解[14],所以p-GSK-3β增高并不一定引起βcatenin的降解。而且BMP作用后除了影响 p-GSK-3β外,是否还影响了降解复合体其它成员的功能(比如APC)导致降解复合体失活,还有待进一步验证。因此单纯的p-GSK-3β增高,对 βcatenin的表达可能影响不大,这与文献报道的在胃癌细胞中GSK-3β的激活不参与β-catenin的代谢过程是一致的[15]。因此我们推测BMP2和BMP9对胃癌细胞MNK-45的抑制作用与β-catenin水平无关。p-GSK-3β的另一种作用是参与微管稳定性的调控[16],但其与BMP2和BMP9对胃癌细胞MNK-45的抑制作用是否相关还有待进一步研究。
[1]Fukase K,Kato M,Kikuchi S,et al.Effect of eradication of Helicobacter pylori on incidence of metachronous gastric carcinoma after endoscopic resection of early gastric cancer:an open- label,randomised controlled trial[J].Lancet,2008,372(9636):392 -397.
[2]Yaghoobi M,Bijarchi R,Narod SA.Family history and the risk of gastric cancer[J].Br J Cancer,2010,102(2):237-242.
[3]Piccirillo SG,Reynolds BA,Zanetti N,et al.Bone morphogenetic proteins inhibit the tumorigenic potential of human brain tumour- initiating cells[J].Nature,2006,444(7120):761-765.
[4]Miyazaki H,Watabe T,Kitamura T,et al.BMP signals inhibit proliferation and in vivo tumor growth of androgen- insensitive prostate carcinoma cells[J].Oncogene,2004,23(58):9326 -9335.
[5]Hardwick JC,Kodach LL,Offerhaus GJ,et al.Bone morphogenetic protein signalling in colorectal cancer[J].Nat Rev Cancer,2008,8(10):806 -812.
[6]吴丽美,何焕玲,李星星,等.人骨形态发生蛋白3抑制骨肉瘤细胞系MG63和U2OS的体外生长[J].基础医学与临床,2009,29(7):731-736.
[7]Kang MH,Oh SC,Lee HJ,et al.Metastatic function of BMP-2 in gastric cancer cells:the role of PI3K/AKT,MAPK,the NF-κB pathway,and MMP-9 expression[J].Efxp Cell Res,2011,317(12):1746 -1762.
[8]Shirai YT,Ehata S,Yashiro M,et al.Bone morphogenetic protein-2 and -4 play tumor suppressive roles in human diffuse - type gastric carcinoma[J].Am J Pathol,2011,179(6):2920-2930.
[9]Wen XZ,Akiyama Y,Baylin SB,et al.Frequent epigenetic silencing of the bone morphogenetic protein 2 genethrough methylation in gastric carcinomas[J].Oncogene,2006,25(18):2666-2673.
[10]Luo J,Chen J,Deng ZL,et al.Wnt signaling and human diseases:what are the therapeutic implications?[J].Lab Invest,2007 ,87(2):97 -103.
[11]Oshima H,Oguma K,Du YC,et al.Prostaglandin E2,Wnt,and BMP in gastric tumor mouse models [J].Cancer Sci,2009,100(10):1779 -1785
[12]Forde JE,Dale TC.Glycogen synthase kinase 3:a key regulator of cellular fate[J].Cell Mol Life Sci,2007,64(15):1930-1944.
[13]Doble BW,Woodgett JR.GSK-3:tricks of the trade for a multi- tasking kinase[J].J Cell Sci,2003,116(Pt 7):1175-1186.
[14]Uemura K,Kuzuya A,Shimozono Y,et al.GSK - 3β activity modifies the localization and function of presenilin 1[J].J Biol Chem,2007,282(21):15823 -15832.
[15]Cho YJ,Yoon J,Ko YS,et al.Glycogen synthase kinase-3β does not correlate with the expression and activity of β - catenin in gastric cancer[J].APMIS,2010,118(10):782-790.
[16]Wakefield JG,Stephens DJ,Tavaré JM.A role for glycogen synthase kinase-3 in mitotic spindle dynamics and chromosome alignment[J].J Cell Sci,2003,116(Pt 4):637-646.

