汉防己甲素对人鼻咽癌细胞株的放射增敏作用及其机制*
吴喜福, 张革化△, 黎景佳, 黄健聪, 王 凯,严睿成, 郑 坚, 谢逢安, 叶 进, 刘 贤
(1中山大学附属第三医院耳鼻咽喉-头颈外科,广东 广州 510630;暨南大学附属第一医院2肿瘤科,3直线加速器室,广东 广州 510632)
鼻咽癌 (nasopharyngeal carcinoma,NPC)是源于鼻咽部上皮的鳞状细胞癌,因解剖位置隐匿、毗邻重要器官,治疗以放射治疗为首选。虽然放疗技术的发展明显提高了早期NPC患者的5年总生存率,但晚期患者疗效仍不理想。治疗失败的主要原因之一是放疗后肿瘤局部残留或复发。NPC细胞对放射线抵抗是一个突出的问题,已有研究显示放射抵抗者高达23.2%[1-2]。同步放化疗虽提高了 NPC的疗效,但伴随的毒副反应使患者的依从性下降,5年总生存率仍未获得明显改善[3]。因此,如何提高NPC对放射线照射的敏感性成为亟待解决的问题。
研究发现汉防己甲素(tetrandrine,Tet)具有抗肿瘤效应,并能增加肿瘤细胞对放射线照射的敏感性[4]。本研究拟探讨 Tet对人鼻咽癌细胞株CNE1和CNE2是否具有放射增敏作用,并研究其增敏机制,为寻找NPC的放射增敏剂提供理论依据。
材料和方法
1 细胞
人NPC高分化鳞癌细胞株CNE1和低分化鳞癌细胞株CNE2由中山大学肿瘤医院惠赠。细胞采用含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的RPMI-1640培养基培养,每2~3 d传代1次。
2 主要试剂
Tet购于大连富生天然药物开发有限公司(纯度>98%),溶液配制方法参考文献[5]。四甲基偶氮唑盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-tetrazolium bromide,MTT]购于 Sigma,二甲基亚砜(dimethyl sulfoxide,DMSO)购于天津市大茂化学试剂厂,细胞周期试剂盒购于南京凯基生物科技发展有限公司。
3 细胞照射
采用SIEMENZ直线加速器产生的6 MV的X线照射细胞,剂量率为2.5 Gy/min。照射时在细胞培养板加垫0.5 cm厚的有机玻璃板及硅胶补偿膜,放射源至细胞的距离为100 cm,照射野为25 cm×25 cm。
4 主要方法
4.1 细胞增殖抑制实验
4.1.1 Tet增殖抑制实验 CNE1和 CNE2细胞分别以每孔1000个接种于96孔板,每组5个平行孔,待细胞贴壁后分别给予 0、1、2、3、4、5、10 和 20 μmol/L Tet溶液培养24 h。终止培养,每孔加入5 g/L的MTT 20 μL,继续孵育4 h后,吸去孔内上清液并加入DMSO 150 μL,振荡10 min后于490 nm波长测定吸光度值,计算Tet的半数抑制浓度(50%inhibitory concentration,IC50)。
4.1.2 Tet最大非细胞毒性剂量筛选实验 CNE1和CNE2细胞分别以每孔1000个接种于96孔板,每组5个平行孔,待细胞贴壁后分别给予0、0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.5、1.8 和 2 μmol/L Tet溶液培养,培养24 h后细胞换液。MTT法测定吸光度值,连续检测6 d,绘制不同Tet剂量下的细胞生长曲线。
4.1.3 Tet联合放射线照射对细胞增殖抑制实验设立空白对照组和单纯Tet组、单纯放射线照射组和Tet联合放射线照射组。CNE1和CNE2细胞分别以每孔1000个接种于96孔板,每组5个平行孔,待细胞贴壁后单纯放射线照射组及Tet联合放射线照射组给予4 Gy放射线照射,照射结束后,单纯Tet组及Tet联合放射线照射组立即给予最大非细胞毒性剂量的Tet溶液培养,培养24 h后细胞换液。MTT法测定吸光度值,连续检测6 d,绘制各组的细胞生长曲线。
4.2 克隆形成实验 操作方法参考文献[6],设立单纯放射线照射组和Tet联合放射线照射组。CNE1和 CNE2 细胞分别以 100、200、400、800、2000 和5000个接种于直径6 cm的培养皿,每组3个平行皿,待细胞贴壁后分别给予 0、1、2、4、6 和 8 Gy放射线照射,照射结束后,Tet联合放射线照射组立即给予最大非细胞毒性剂量的Tet溶液培养24 h。细胞换液后继续培养,待10~12 d长出肉眼可见的克隆后,吸去培养基,PBS洗涤、甲醇固定、姬姆萨染色,计算50个细胞以上的克隆数。根据克隆数计算克隆形成率、细胞存活分数,采用单击多靶模型拟合细胞存活分数曲线及放射生物学参数平均致死剂量(mean lethal dose,Do)、准阈剂量(quasi-field dose,Dq)、2 Gy 细胞存活分数(survival fraction at 2 Gy,SF2)及放射增敏比(senitivity enhancement ratio,SER)。克隆形成率(%)=克隆形成数/接种细胞数×100%。细胞存活分数(%)=某一剂量照射组的克隆数/(该组接种细胞数×PE)×100%。SER=单纯放射线照射组Do/Tet联合放射线照射组Do[7]。
4.3 流式细胞仪检测细胞周期 设立空白对照组、单纯Tet组、单纯放射线照射组和Tet联合放射线照射组。CNE1和CNE2细胞分别以2×105cells/well接种于6孔板,每组3个平行孔,待细胞贴壁后单纯放射线照射组及Tet联合放射线照射组给予4 Gy放射线照射,照射结束后,单纯Tet组及Tet联合放射线照射组立即给予最大非细胞毒性剂量的Tet溶液培养24 h。胰酶消化、收集细胞,PBS洗涤、70%乙醇固定过夜。RNase A 37℃水浴30 min,PI避光染色30 min,流式细胞术检测细胞周期。
5 统计学处理
结 果
1 细胞增殖抑制实验
Tet对细胞具有增殖抑制作用,浓度越高增殖抑制作用越明显,提示其增殖抑制作用具有浓度依赖性;Tet对CNE1和CNE2细胞的IC50分别为(12.44±0.05)μmol/L 和(13.39 ± 0.09)μmol/L,见图1A。当 Tet分别为 1.5 μmol/L 和 1.8 μmol/L 时,CNE1和CNE2细胞的生长曲线与空白对照组生长曲线相比差异无统计学意义(P>0.05),提示该剂量的Tet为最大非细胞毒性剂量,见图1B、C。
单纯放射线照射组与空白对照组相比,细胞增殖受到抑制,差异有统计学意义(P<0.05)。而Tet联合放射线照射组与单纯放射线照射组相比,最大非细胞毒性剂量的Tet干预使CNE1和CNE2细胞增殖明显受到抑制,第4~6 d时明显,2组间差异均有统计学意义(P <0.01),见图1D、E。

Figure1.Inhibitory effect of Tet on the proliferation of CNE1 and CNE2 cells.A:relative survival after exposure to Tet for 24 h;B and C:the maximum non-cytotoxic dose of Tet;D and E:the inhibitory effect of Tet and radiation on the proliferation..n=3.*P <0.05 vs control;▲▲P <0.01 vs 4 Gy.图1 细胞增殖抑制实验
2 克隆形成实验
采用单击多靶模型拟合细胞存活分数曲线并计算放射生物学参数,结果提示CNE1和CNE2细胞的SF2分别为 0.42 ±0.05 和 0.54 ±0.02,见图 2。CNE1细胞:单纯放射线照射组的Do和Dq分别为1.26 ±0.02 Gy和0.93 ±0.12 Gy,Tet联合放射线照射组Do和Dq分别为(0.73±0.05)Gy和(0.67±0.03)Gy;CNE2细胞:单纯放射线照射组的Do和Dq分别为(2.27 ±0.04)Gy 和(1.24 ±0.08)Gy,Tet联合放射线照射组 Do和 Dq分别为(1.61±0.08)Gy和(1.10 ±0.06)Gy。Tet对 CNE1 和CNE2细胞的 SER分别为1.73和1.40(P <0.05)。
3 流式细胞仪检测细胞周期
空白对照组CNE1和CNE2细胞的G1期细胞比例分别为(65.23 ±9.33)%和(44.47 ±2.55)%,单纯Tet组G1期细胞比例分别为(67.39±4.65)%和(51.90 ±8.90)%,G1期细胞比例虽有所升高,但差异并无统计学意义(P>0.05)。空白对照组CNE1和CNE2细胞的 G2期细胞比例分别为(11.41±1.50)%和(14.48±1.80)%,而单纯放射线照射组G2期细胞比例分别为(42.62 ±2.07)%和(34.82 ±2.74)%,2组间差异有统计学意义(P<0.01)。Tet联合放射线照射组,2株细胞G2期细胞比例分别为(17.02 ±1.87)%和(19.64 ±4.82)%,与单纯放射线照射组相比明显降低,差异有统计学意义(P<0.01),见图3。

Figure2.Colony formation assay.-Tet:radiation group;+Tet:Tet plus radiation group..n=3.*P<0.05 vs-Tet.图2 克隆形成实验
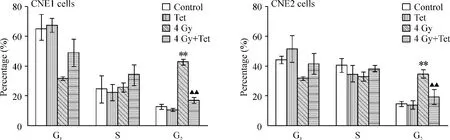
Figure3.Cell cycle analyzed by flow cytometry..n=3.**P<0.01 vs control;▲▲P<0.01 vs 4 Gy.图3 细胞周期结果
讨 论
Tet又名粉防己碱,为千金藤属植物粉防己块根中的主要成分,化学结构为双苄基异喹啉生物碱,分子式为C33H42N2O6。Tet为非选择性钙通道拮抗剂,具有降压、镇痛、抗炎、抗纤维化、降血糖等作用。近年来研究发现Tet具有抗肿瘤作用,表现为直接抗肿瘤、增加放射敏感性、逆转肿瘤细胞多重耐药和抗血管形成[8-10]。已有的研究提示Tet的抗肿瘤作用机制主要通过抑制CDK/cyclin E和CDK4转导通路、抑制CDK4、CDK6、cyclin D1和E2F1蛋白降解、抑制p53/p21Cip1的表达等途径,诱导肿瘤细胞阻滞于G1期[5]。
作为一个理想的放射增敏剂(radiation sensitizing agents,RAS),应该具备如下特点:(1)化学性质稳定、不易和其它物质反应;(2)有效剂量没有毒性或毒性很低;(3)易溶于水,便于给药;(4)专对肿瘤细胞,特别是对肿瘤乏氧细胞有较强的放射增敏作用;(5)有较长的生物半衰期,并在体内能保持其药物毒性,足以渗入整个肿瘤;(6)在常规分次治疗,较低的药物剂量即可有放射增敏作用;而关于抗肿瘤药物用于增敏研究的剂量选择,经验用量为抗肿瘤药物 IC50的 1/10 ~1/5[11]。
本研究在探讨Tet对CNE1和CNE2细胞IC50的基础上,进一步通过MTT实验得出Tet对CNE1和CNE2细胞的最大非细胞毒性剂量,分别为1.5 μmol/L 和 1.8 μmol/L,采用此剂量研究 Tet的放射增敏作用较以往的经验用量更为科学、可信。
已有文献证实放射线照射可导致细胞DNA双链断裂、细胞周期阻滞于G2期,并启动一系列DNA损伤修复机制防止在M期进行异常分裂,以对抗放射线损伤[12-13]。本研究中,流式细胞术提示单纯放射线照射能显著增加2株细胞的G2期细胞比例(P<0.05),而Tet联合放射线照射与单纯放射线照射相比,G2期细胞比例明显降低(P<0.01);MTT法与克隆形成实验结果提示Tet联合放射线照射能显著抑制细胞增殖、增加细胞对放射线的敏感性,放射增敏比分别为1.73和1.40(P <0.05)。因此,我们推测Tet去除放射线照射诱导的G2期细胞阻滞可能是其放射增敏的机制之一。由于细胞在G2期能完成DNA损伤修复,而Tet可能导致尚未进行DNA修复的细胞直接进入下一周期,表现为G2期细胞比例减少,损伤后的细胞在进入到下一周期后不能正常生长而死亡,从而达到放射增敏作用。
综上所述,最大非细胞毒性剂量的Tet对人鼻咽癌细胞株CNE1和CNE2具有放射增敏作用,其机制可能与去除放射线照射诱导的G2期细胞阻滞有关。
[1]Wang J,Shi M,Hsia Y,et al.Failure patterns and survival in patients with nasopharyngeal carcinoma treated with intensity modulated radiation in Northwest China:a pilot study[J].Radiat Oncol,2012,7:2.
[2]Ng WT,Lee MC,Hung WM,et al.Clinical outcomes and patterns of failure after intensity-modulated radiotherapy for nasopharyngeal carcinoma[J].Int J Radiat Oncol Biol Phys,2011,79(2):420-428.
[3]Lee AW,Tung SY,Chua DT.Randomized trial of radiotherapy plus concurrent-adjuvant chemotherapy vs radiotherapy alone for regionally advanced nasopharyngeal carcinoma[J].J Natl Cancer Inst,2010,102(15):1188 -1198.
[4]Yu J,Liu F,Sun M,et al.Enhancement of radiosensitivity and the potential mechanism on human esophageal carcinoma cells by tetrandrine[J].Cancer Biother Radiopharm,2011,26(4):437-442.
[5]Meng LH,Zhang H,Hayward L,et al.Tetrandrine induces early G1arrest in human colon carcinoma cells by down-regulating the activity and inducing the degradation of G1-S-specific cyclin-dependent kinases and by inducing p53 and p21Cip1[J].Cancer Res,2004,64(24):9086-9092.
[6]Franken NA,Rodermond HM,Stap J,et al.Clonogenic assay of cells in vitro[J].Nat Protoc,2006,1(5):2315-2319.
[7]阎春红,范小航,杨惠玲,等.2-甲氧雌二醇对人肺癌细胞的放射增敏作用[J].中国病理生理杂志,2010,26(1):137-141.
[8]Qian XP,Liu BR,Hu J,et al.Inhibitory effect of tetrandrine on angiogenesis[J].Ai Zheng,2008,27(10):1050-1055.
[9]Wu JM,Chen Y,Chen JC,et al.Tetrandrine induces apoptosis and growth suppression of colon cancer cells in mice[J].Cancer Lett,2010,287(2):187 -195.
[10]Shen H,Xu W,Chen Q,et al.Tetrandrine prevents acquired drug resistance of K562 cells through inhibition of mdr1 gene transcription[J].J Cancer Res Clin Oncol,2010,136(5):659-665.
[11]沈 瑜,糜福顺.肿瘤放射生物学[M].第1版.北京:中国医药科技出版社,2002:254-258.
[12]Pawlik TM,Keyomarsi K.Role of cell cycle in mediating sensitivity to radiotherapy[J].Int J Radiat Oncol Biol Phys,2004,59(4):928-942.
[13]Kao GD,Mckenna WG,Yen TJ.Detection of repair activity during the DNA damage-induced G2delay in human cancer cells[J].Oncogene,2001,20(27):3486 -3496.

