SLP-2 在胃癌组织中的表达及其预后意义*
颜淑梅, 吴秋良△, 奚少彦, 梁建中, 张 玉, 冯沿芬,侯景辉, 卢佳斌, 黄春雨, 杜紫明, 周志伟
(1华南肿瘤学国家重点实验室,中山大学肿瘤防治中心2病理科,3胃胰科,广东 广州510060)
胃癌是常见的消化道恶性肿瘤之一,其发病率呈逐年上升趋势。尽管胃癌在以手术为主的综合治疗方面取得了许多进展,但是5 年生存率仍然徘徊在30%~40 %左右,此现状促使学者们对胃癌的发病机理及预后做多方面、多层次的研究。红细胞膜整合蛋白SLP-2(stomatin -like protein 2)是stomatin 家族的新成员之一[1],SLP-2 或其它整合蛋白与周边组织细胞骨架联合起来,参与了离子通道转导、鞘脂类的组织以及胆固醇丰富的脂质筏的调控,影响细胞的黏附功能,从而成为肿瘤细胞侵袭转移的重要因素之一。近年来发现SLP -2 作为一种细胞膜与线粒体内膜相关蛋白,可能参与了对细胞凋亡和细胞周期的调控,也可能在癌细胞侵袭、转移等方面具有重要作用[2]。Zhang 等[3]首次发现SLP -2基因在食管鳞状细胞癌中过表达,并与肿瘤的发生﹑发展关系密切。Jinawath 等[4]采用cDNA 微阵列的方法,发现stomatin 基因在弥散型胃癌中表达上调。张剑等[5]最近发现SLP -2 在胃腺癌组织中呈高表达,并与胃腺癌的淋巴结转移和TNM 分期相关,但未研究与预后的关系。本实验采用免疫组化方法检测了胃癌组织SLP-2 蛋白表达,探讨其在病理分期、淋巴结转移、侵袭程度、预后等临床特征方面的意义。
本研究采用兔抗SLP-2 多克隆抗体,应用免疫组化两步法,研究SLP -2 基因的表达产物即SLP -2 蛋白在胃癌组织内定位、分布及SLP -2 蛋白表达与胃癌临床病理的关系,探讨其在胃癌发生、发展、入侵和转移中的重要作用,为胃癌的诊断、监测和治疗提供重要理论依据。
材 料 和 方 法
1 临床资料
数据源于中山大学肿瘤防治中心数据库,剔除伴严重基础疾病的病例。选取2005 年4 月至2006年12 月胃癌手术切除标本190 例,男性130 例,女性60 例,年龄最大82 岁,最小20 岁,中位年龄58 岁。术前术后均未行化疗和放疗。按2010 年TNM 分期标准分期,其中I 期23 例,II 期42 例,III 期100 例,IV 期25 例。其中淋巴结转移阳性者140 例,阴性者50 例。病理分化程度:高/中分化腺癌69 例,低分化腺癌(包括印戒细胞癌和黏液腺癌)121 例。所有病例都有完整的临床资料及石蜡标本。所有活检标本均用10%中性甲醇液固定,切片HE 染色,由临床病理高年资医生阅片作出病理诊断。
2 方法
10%甲醇固定标本,石蜡包埋,切成4 μm 厚切片。采用链酶亲和素-生物素-过氧化物酶复合物(SP)法(SP 试剂盒迈新公司产品),石蜡切片用二甲苯脱蜡,梯度乙醇水化后用微波柠檬酸钠修复20 min,用过氧化物酶阻断剂(A 试剂)阻断内源性过氧化物酶的活性,正常动物血清(B 试剂)封闭非特异性抗体,滴加1∶200 兔抗人SLP-2 多克隆抗体(Proteintech Group Inc),4 ℃过夜。次日滴加生物素标记的第Ⅱ抗体(C 试剂)、链霉菌抗生素蛋白-过氧化物酶溶液(D 试剂)、新鲜配制的3,3 -二氨基联苯胺(DAB)显色,苏木素复染,脱水、中性树胶封固。已知阳性胃癌切片作为阳性对照,PBS 缓冲液代替Ⅰ抗作为阴性对照。
3 SLP2 蛋白免疫组化的评分标准
组织切片中显示胞质为淡黄色或棕黄色者为阳性细胞标志,SLP-2 蛋白定位于细胞质,凡显色强度与背景无差异者为阴性,而显色强度高于背景的为阳性表达。按照Song 等[6]SLP -2 免疫反应计分标准,将SLP-2 的表达染色强度得分与阳性细胞比例得分相乘。其中强度评分标准:1 分为阴性,2 分为弱阳性,3 分为中等阳性,4 分为强阳性;而阳性细胞比例分为:0 分为无阳性细胞,1 分为≤10%的阳性细胞,2 分为11% ~50%的阳性细胞,3 分为51% ~75%的阳性细胞,4 分为>75%的阳性细胞。由2 位病理医生独立阅片,取其平均值。SLP2 表达阳性的标准为得分>8 分。
4 随访
本组采用书信或电邮、电话与门诊复诊随访。随访起点时间为行胃癌手术当天,随访至2011 年9月26 日(2 ~76.5 个月,中位随访40.5 个月)。随访终点为死亡日期。
5 统计学处理
应用SPSS 16.0 软件,对SLP -2 蛋白的阳性率与临床病理参数、预后之间的关系用χ2检验。累积生存率根据寿命表法计算,生存曲线用Kaplan -Meier 法分析,单因素生存分析用log -rank 检验,用Cox 回归进行多因素分析。以P <0.05 为差异有统计学意义。
结 果
1 SLP-2 在胃癌组织中的表达及其与胃癌临床病理特征的关系
SLP-2 蛋白在胃癌组织和正常胃黏膜中的表达情况见图1。SLP 蛋白在胃癌组织细胞浆和细胞膜中呈棕褐色粗颗粒状,正常黏膜阴性或者弱阳性。SLP-2 蛋白在胃癌组织中表达的阳性率为63.2%(120/190)。SLP-2 蛋白的阳性率与胃癌浸润深度(P <0.01)、TNM 分期(P <0.01)及淋巴结转移(P<0.05)有关,而与性别、年龄、肿瘤分化程度、肿瘤直径及远处转移均无关,见表1。
2 胃癌预后影响因素的单因素和多因素分析
单因素分析结果显示:不同TNM 分期(P <0.01)、淋巴结转移(P <0.01)、远处转移(P <0.01)、肿瘤直径(P <0.01)、分化程度(P <0.05)、癌组织浸润深度(P <0.01)和SLP-2 表达情况患者生存期均有显著差异。单因素分析中,将SLP-2 表达阴性患者的死亡风险比设定为1,SLP -2 阳性患者的死亡风险比为2.23(95%CI:1.29 ~3.85,P <0.01)。从单变量分析中找到显著影响预后的各指标,经Cox 比例风险模型多因素分析显示,仅有TNM分期和肿瘤直径是显著独立的预后指标(P <0.05,P<0.01),见表2。
3 SLP-2 表达与术后生存率的关系(Kaplan-Meier 生存分析)
SLP-2 阴性表达者生存率曲线始终在其阳性表达者之上,随时间延长,生存率下降缓慢。5 年累计生存率SLP-2 阴性表达明显高于阳性表达(P <0.01),见图2。
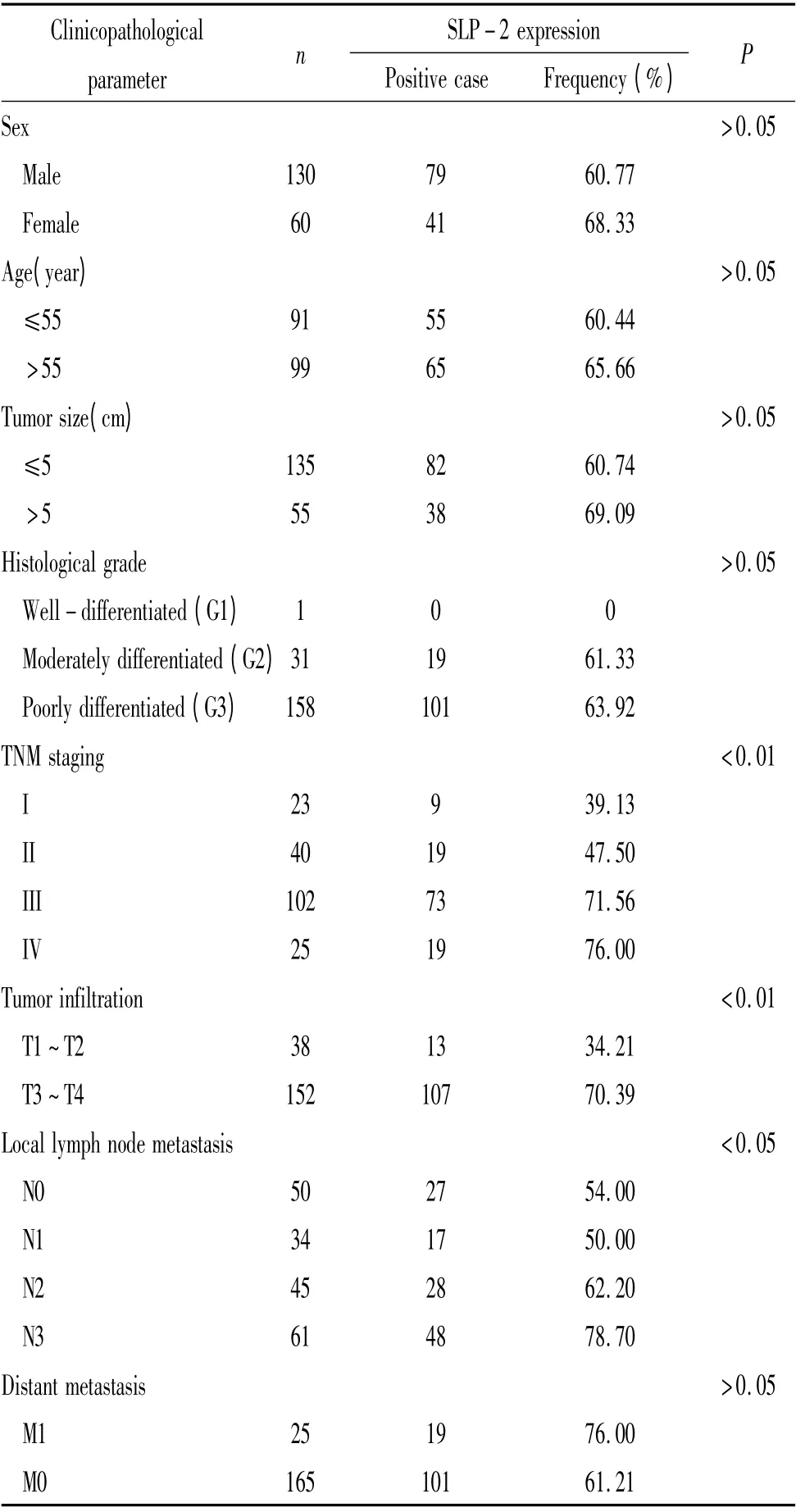
表1 SLP-2 蛋白表达与临床病理参数之间的关系Table 1. Relationship between expression of SLP-2 protein and clinicopathological characteristics

表2 影响190 例胃癌患者预后的临床病理变量的单因素和多因素分析Table 2. Univariate and multivariate survival analysis of clinicopathological variables in 190 cases of gastric carcinoma patients
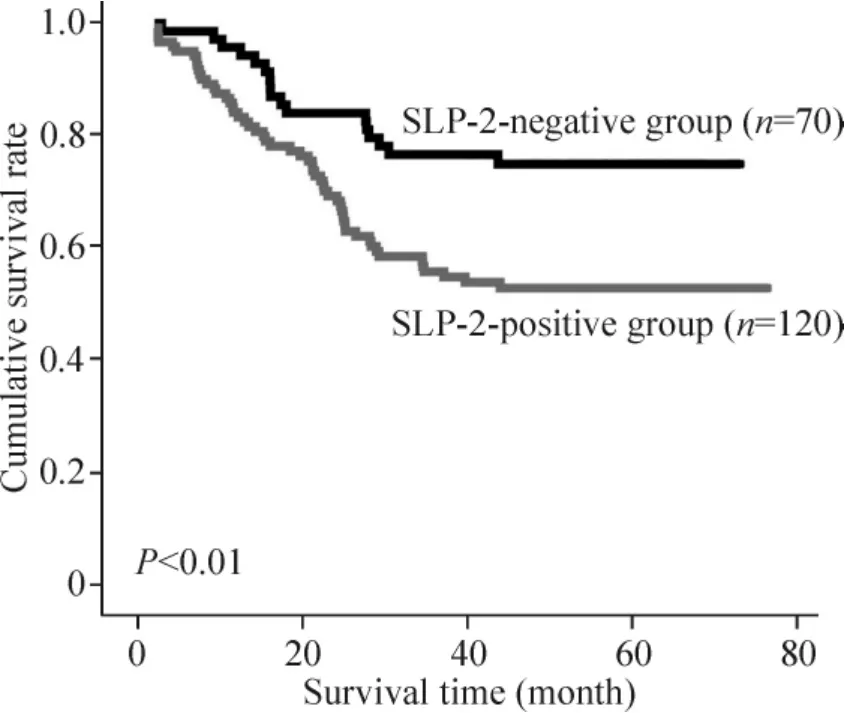
Figure 2. Kaplan - Meier survival curves of gastric cancer patients after gastrectomy. The survival rate of the patients in SLP - 2 - positive group was significantly lower than that of the patients in SLP -2 - negative group (log-rank test,P <0.01).图2 术后胃癌患者的生存曲线
讨 论
胃癌具有早期症状不明显、复发率高、淋巴结转移早等特点,胃癌的病死率一直居高不下。然而,目前虽然有许多分子证实参与了胃癌的多种恶性表型,比如HER -2、VEGF、EGFR 等,但其在判断预后方面的价值一直存在着争议。因此,寻找新的与胃癌发生发展以及患者生存时间有关的生物学指标有重要的临床意义。
SLP-2 基因是2000 年首次发现并命名的一个新基因,其表达产物在当时被鉴定为细胞膜相关蛋白[1]。SLP-2 是stomatin 基因超家族的一员,定位于染色体9p13.1[7],其编码的SLP-2 蛋白在人体组织中分布广泛,其中在骨骼肌和心脏中的表达水平较高。有研究推测,该蛋白也出现在成熟红细胞膜中,并且与血影蛋白-肌动蛋白细胞骨架相结合,或与其它整合膜蛋白结合,但其本身并不整合到膜脂质双层结构中,可能作为外周膜蛋白起作用,从而将stomatin 或其它整合膜蛋白与细胞骨架联系起来,调控离子通道的转导、鞘脂和富含胆固醇的脂筏组织[7-8]。近年来关于线粒体的蛋白组学研究发现,SLP-2 存在于细胞的线粒体中[9],并与一些线粒体内膜相关蛋白有直接结合,可能参与调节与其结合的线粒体膜相关蛋白的稳定性[2,10]。
SLP-2 在人的多种组织中如脑、肺、胸腺、气管、食管黏膜、胃、心脏、结肠、小肠、肾脏、肌肉等中广泛表达[11]。多项研究表明,SLP-2 在恶性肿瘤中表达明显上调,在肿瘤的发生、发展过程中可能具有重要作用。Zhang 等[3]首次发现SLP-2 在食管鳞癌组织中表达上调,表达水平是正常食管黏膜的6 倍以上,其反义核酸可抑制肿瘤细胞的生长和增殖,使裸鼠致瘤能力大大降低。Cao 等[12-13]发现SLP -2 在喉鳞癌、乳腺癌中高表达,与预后相关。此后的一些研究表明,SLP - 2 在肺癌、子宫内膜癌、结直肠癌[6,12,14-18]等恶性肿瘤中也存在高表达。推测其在恶性肿瘤中的高表达是一个较为普遍的现象,SLP-2 可能是一个新的癌基因. 但目前关于SLP -2 基因的研究较少,其分子机制相关的研究更少。Song等[6]通过基因敲除技术,发现经SLP -2 基因敲除的神经胶质瘤细胞的侵袭、转移能力下降,其分子机制可能是抑制了NF - κB/MMP -9 转导通路。张剑等[5]最近发现SLP-2 在胃腺癌组织中呈高表达,并与胃腺癌的淋巴结转移和TNM 分期相关。
本实验采用免疫组织化学法检测190 例胃腺癌组织中SLP-2 蛋白表达水平,结果显示,SLP-2 蛋白阳性率为63.2%(120/190)。结合免疫组织化学结果和患者临床病理资料进行分析发现,SLP -2 蛋白的高表达与胃癌浸润深度、TNM 分期及淋巴结转移有关(P <0.05),即较晚期病例的胃腺癌组织SLP-2 蛋白的表达水平高于较早期病例的胃腺癌组织,有淋巴结转移的病例相对应的胃腺癌组织中SLP-2蛋白的表达水平高于无淋巴结转移的病例,癌组织浸润超出肌层的病例相对应的胃腺癌组织中SLP-2蛋白的表达水平高于癌组织浸润局限于肌层内的病例;而SLP-2 蛋白的表达与其它临床病理参数没有显著相关性。提示SLP -2 可能是一个与胃腺癌分期和转移相关的指标,在胃腺癌的发展、浸润及转移中起一定的促进作用。临床资料进一步显示:SLP -2 阳性表达患者5 年生存率明显低于其阴性表达者,Kaplan-Meier 显示SLP-2 阴性表达者5 年累积生存率高于阳性表达者,说明SLP-2 在一定程度上促进肿瘤的生长,其表达提示胃癌预后相对较差。
本研究发现SLP-2 在胃腺癌组织中呈高表达,并与胃腺癌的胃癌浸润深度、TNM 分期及淋巴结转移相关。从Cox 比例风险模型单、多因素分析可见:只有肿瘤直径和TNM 分期是显著独立的预后指标,SLP-2 虽不是独立的预后因素,但它与影响胃癌预后因素存在相互关联,其过度表达在一定程度上能影响胃癌的预后。这提示SLP -2 表达不仅参与了胃癌的发生,而且与肿瘤的进展、转移有关;其基因产物阳性表达的胃癌患者更易发生淋巴结转移。然而SLP-2 参与恶性肿瘤发生发展的作用机制尚不清楚。Christie 等[19]研究发现,SLP -2 可能通过调节线粒体膜磷脂浓度,使得线粒体膜离子通道复合物顺利组装合成,包括复合物I、II,从而增加细胞的ATP 储备。通过Song 等[6]的研究结果,我们可以推测SLP-2 可能通过影响MMP -9 蛋白的表达来干扰NF-κB/MMP -9 转导通路,从而影响肿瘤细胞的侵袭、转移能力。因此,SLP-2 可能作为胃癌的一个有意义的预后指标,指导胃癌患者的预后生存,并有可能作为一个新的肿瘤靶向治疗的靶点,但对其具体功能及机制,有待我们更深入地研究。
[1] Wang Y,Morrow JS. Identification and characterizationof human SLP - 2,a novel homologue of stomatin (band 7.2b)present in erythrocytes and other tissues[J]. J Biol Chem ,2000,275(11):8062 -8071.
[2] Hájek P,Chomyn A,Attardi G. Identification of a novel mitochondrial complex containing mitofusin 2 and stomatin-like protein 2[J]. J Biol Chem,2007,282(8):5670 -5681.
[3] Zhang L,Ding F,Cao W,et al. Stomatin-like protein 2 is overexpressed in cancer and involved in regulating cell growth and cell adhesion in human esophageal squamous cell carcinoma[J]. Clin Cancer Res,2006,12(5):1639-1646.
[4] Jinawath N,Furukawa Y,Nakamura Y. Identification of NOL8,a nucleolar protein containing an RNA recognition motif(RRM),which was overexpressed in diffuse - type gastric cancer[J].Cancer Sci,2004,95(5):430 -435.
[5] 张 剑,李建生,吴 敏,等.SLP -2 在胃癌中的表达及意义[J].世界华人消化杂志,2012,20(19):1778 -1781.
[6] Song L,Liu L,Wu Z,et al. Knockdown of stomatin-like protein 2 (STOML2)reduces the invasive ability of glioma cells through inhibition of the NF -κB/MMP -9 pathway[J]. J Pathol ,2012,226(3):534 -543.
[7] Kheradmand F,Werner E,Tremble P,et al.Role of Racl and oxygen radicals in eollagenase -1 expression induced by cell shape change[J].Science,1998,280(5365):898-902.
[8] Evers EE,Zondag GC,Malliri A,et al. Rho family proteins in cell adhesion and cell migration[J].Eur J Cancer,2000,36(10):1269 -1274.
[9] Chevallet M,Lescuyer P,Diemer H,et al. Alterations of the mitochondrial proteome caused by the absence of mitochondrial DNA:a proteomic view[J]. Electrophoresis,2006,27(8):1574 -1583.
[10] Da Cruz S,Parone PA,Gonzalo P,et al. SLP -2 interacts with prohibitins in the mitochondrial inner membrane and contributes to their stability[J]. Biochim Biophys Acta,2008,1783(5):904 -911.
[11] 张立勇,王 涛,丁 芳,等.SLP -2 基因在食管鳞癌中的差异表达以及其生物信息学分析[J].世界华人消化杂志,2004,12(7):1517 -1521.
[12] Cao WF,Zhang B,Liu YX,et al. SLP -2 high expression associated with HER2/neu protein expression decreased breast cancer patient survival [J]. Am J Clin Pathol,2007,128(3):430 -436.
[13] Cao WF,Zhang LY ,Liu MB,et al. Prognostic significance of stomatin-like protein 2 overexpression in laryngeal squamous cell carcinoma:a clinical,histologic,and immunohistochemistry analyses with tissue microarray[J].Hum Pathol,2007,38(5):747 -752 .
[14] 苏 雷,张 建,魏秀琴,等. Slp2 基因的差异表达与肺癌的分化和转移[J]. 中国肿瘤临床,2005,32(12):678 -680.
[15] Chang D,Ma K,Gong M,et al. SLP -2 overexpression is associated with tumour distant metastasis and poor prognosis in pulmonary squamous cell carcinoma[J]. Biomarkers,2010,15(2):104 -110.
[16] 冯旺琴,崔竹梅,冯凤芝,等. SLP -2 mRNA 在子宫内膜癌中的表达及其意义[J].中华妇产科杂志,2005,40(8):553 -557.
[17] 祁代华,李建生,王康康. SLP -2 和CDC42 蛋白在结直肠癌组织中的表达及临床意义[J]. 中华消化杂志,2009,29(3):191 -192.
[18] 曹文枫,张立勇,张 斌,等. SLP -2 蛋白在食管鳞状细胞癌中的表达及其与肿瘤侵袭转移的关系[J]. 中华肿瘤杂志,2010,32(11):830 -833.
[19] Christie DA,Lemke CD,Elias IM,et al. Stomatin-like protein 2 binds cardiolipin and regulates mitochondrial biogenesis and function [J]. Mol Cell Biol,2011,31(18):3845 -3856.

