宫颈癌组织中Sox-2的表达变化及意义
(北京军区总医院,北京 107000)
宫颈癌是女性最常见的恶性肿瘤之一,居女性恶性肿瘤死亡率第2位。我国年均新发宫颈癌约13.15万例,占全球总新发病例的28.8%,位居女性恶性肿瘤第1位[1]。近年来研究显示肿瘤干细胞是肿瘤形成的重要原因[2],其具有干细胞特性,在肿瘤细胞中所占数量少,但可以进行自我更新和多项分化,从而使肿瘤不断生长[3]。研究发现在白血病、乳腺癌、脑胶质瘤、结肠癌、视网膜母细胞瘤、胰腺癌、肺癌等许多肿瘤中都存在有肿瘤干细胞[4~7]。近年研究表明,干细胞关键转录因子Sox-2基因是性别决定区因子,在胚胎干细胞维持自我更新及多向性发展过程中起着决定性的作用,是维持胶质瘤祖细胞增殖和遗传特性的关键转录调节因子,其异常表达与肺癌、乳腺癌、口腔肿瘤、食管癌、睾丸干细胞肿瘤、脑膜瘤等许多肿瘤的发生、发展密切相关[8]。目前宫颈癌干细胞的研究尚处于初步阶段,关于Sox-2基因在宫颈癌中表达的研究尚少见。2009年2月~2011年9月,本研究观察了Sox-2蛋白及其mRNA在宫颈癌组织中的表达变化,为宫颈癌的诊断和治疗从干细胞角度提供理论基础。
1 材料与方法
1.1 临床资料 宫颈癌组织标本84例,宫颈CIN组织标本66例,正常宫颈组织标本22例。宫颈癌及宫颈CIN组织分别来源于在北京军区总医院妇产科行手术切除治疗、经病理证实的宫颈癌及宫颈CIN患者。其中宫颈癌患者年龄33~56岁,宫颈CIN患者年龄28~40岁。正常宫颈组织来源于行子宫肌瘤全切术的患者,患者年龄40~51岁。三组患者年龄相比,P均>0.05。
1.2 方法
1.2.1 主要试剂 鼠抗人Sox-2单克隆抗体购自美国Epitomics公司,链霉卵白素—生物素过氧化物酶(SP)标记的试剂盒及DAB均购自北京中杉金桥生物技术有限公司。Trizol Reagent试剂盒(美国Invitrogen公司),2×Taq PCR Master Mix(北京天根生物技术有限公司)。
1.2.2 Sox-2蛋白的检测 采用免疫组化SP法。标本行4 μm厚切片,二甲苯脱蜡,梯度乙醇水化,用3%的H2O2抑制内源性过氧化酶活性,0.01 mol/L枸橼酸钠(pH 6.0)行抗原修复,在约100℃条件下加热10 min,PBS洗片,10%BSA封闭非特异性位点10 min,一抗4℃孵育过夜,PBS代替一抗作阴性对照。PBS冲洗3遍,SP法染色,DAB显色后行苏木精复染,常规脱水、透明、干燥、封片。
1.2.3 Sox-2 mRNA的检测 采用RT-PCR法。按照Trizol Reagent试剂盒说明书提取组织总RNA。按照2×Taq PCR Master Mix使用说明,在20 μL的反应体系中合成细胞总cDNA。PCR体系为50 μL,内含模板 2 μL,Taq 酶 12.5 μL,目的引物各 0.5 μL,补水至50 μL。反应条件除退火温度外均为预变性94℃ 3 min,变性94℃ 30 s,退火58 s,延伸72℃ 30 s,共25个循环。Sox-2上游引物:5'-CCCTGTGGTTACCTCTTCC-3', 下 游 引 物:5'-CTCCCATTTCCCTCGTTT-3',退火温度58℃,产物长度为295 bp;内参GAPDH上游引物:5'-GGGTGATGCTGGTGCTGAGTATGT-3',下游引物:5'-AAGAATGGGAGTTGCTGTTGAAGTC-3',退火温度58℃,产物长度为616 bp。
1.2.4 结果判定 ①Sox-2蛋白:光镜下 Sox-2蛋白主要定位于细胞核,部分胞质着色。免疫组化结果采用半定量计分法判定.按着色程度评分,不着色计0分,浅黄色计1分,棕黄色计2分,棕褐色计3分;按阳性细胞百分比计分,每张切片随机选取5个高倍镜视野(×400),无阳性细胞记0分,阳性细胞百分比<25%计1分,25% ~50%计2分,51% ~75%计3分,>75%计为4分。上述两项评分乘积<2分为阴性(-),2~3分为弱阳性(+),4~6分为阳性(++),>6分为强阳性(+++),+~+++判定为Sox-2蛋白表达阳性。②Sox-2 mRNA:用内参照GAPDH光密度值标化目的基因的光密度值进行半定量分析,得到Sox-2 mRNA的相对表达量:(Sox-2 mRNA光密度值/GAPDH光密度值)×100%。
1.2.5 统计学方法 采用SPSS17.0软件进行统计学分析。计量资料比较采用t检验,计数资料比较采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 宫颈癌组织、CIN组织及正常宫颈组织中Sox-2蛋白的表达比较 宫颈癌组织、CIN组织及正常宫颈组织中Sox-2蛋白阳性表达率分别为85.71%(72/84)、36.36%(24/66)、0.18%(4/22),三者相比,P均 <0.01。
2.2 Sox-2蛋白表达与宫颈癌临床病理参数的关系
见表1。由表1可见,宫颈癌组织中Sox-2蛋白表达水平与患者年龄无关(P>0.05);与宫颈癌淋巴结转移、临床分期、分化程度有关 (P均<0.05)。
2.3 宫颈癌组织、CIN组织及正常宫颈组织中Sox-2 mRNA的表达比较 宫颈癌组织、CIN组织及正常宫颈组织中Sox-2 mRNA的相对表达量分别为0.877 ±0.208、0.463 ±0.093、0.243 ±0.023,Sox-2 mRNA在宫颈癌组织、CIN组织及正常宫颈组织中的表达有显著性差异(P均<0.01),Sox-2 mRNA的表达随着宫颈癌病理学分级的上升而升高。详见图1。
3 讨论
研究认为,宫颈癌中也存在肿瘤干细胞,对宫颈癌的发生发展有重要作用[9]。肿瘤干细胞来源于宫颈储备细胞的一部分[10],因此有关学者已将研究目标指向宫颈储备细胞,高危型人乳头瘤病毒(HPV)的持续感染是导致宫颈癌发病的重要因素,研究证实肿瘤细胞球来源于HPV感染的宫颈干细胞[11],这类细胞可能具有自我更新和多项分化潜能,其常见标记物有 CK17、p63 和 p16[12]。冯定庆等[13]从19例子宫颈癌患者的肿瘤组织中分离获得宫颈癌干细胞,并分离培养形成肿瘤细胞球,表达干细胞标志物Oct4和Piwil2蛋白,接种于裸鼠皮下12周后全部成瘤,其病理类型与来源标本一致。
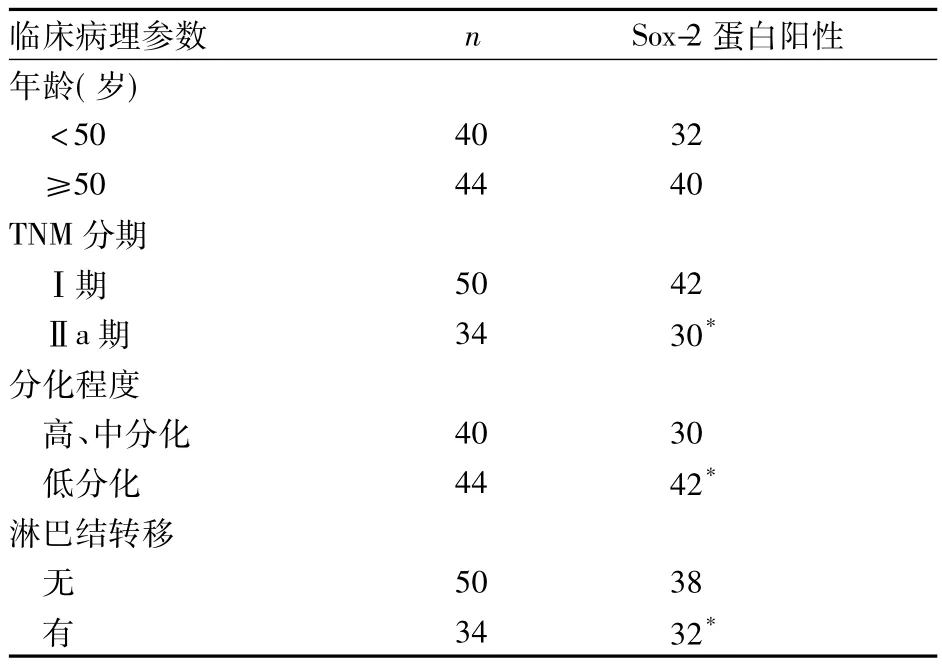
表1 Sox-2蛋白表达与宫颈癌临床病理参数的关系(例)

图1 宫颈癌组织、CIN组织及正常宫颈组织中Sox-2 mRNA的表达比较
Sox-2基因被认为在肿瘤干细胞的发生发育方面起重要作用。Sox是一类具HMGDNA结合区域特征性的转录因子家族[14],在真核生物中高度保守的,其蛋白是重要的转录调控因子,在性别决定和分化、早期神经系统发育及多种组织器官的形成中具有重要作用。其中Sox-2亚型归属于该家族B群,参与诱导干细胞转录过程。研究发现,Sox-2是诱导干细胞的一个关键转录因子,其与KLF4、Oct4和c-Myc共同作用,可以诱导鼠和人成体细胞成多功能祖细胞(IPS),表明其具有干细胞调控的特性。在Oct 4、Sox-2、NANOG和 LIN28联合诱导时,也能使人成体细胞发生上述变化,诱导后的细胞还有胚胎干细胞特性。表明Sox-2具有干细胞多向分化调控的特性,提示Sox-2基因是维持干细胞特性的重要基因。有学者发现,Sox-2在肺癌[15]、食管癌和肛管鳞癌中的表达率分别为94%、96%和100%,在相应的腺癌中表达率21%、13%和17%,提出Sox-2有可能作为消化道肿瘤或其他肿瘤鳞癌和腺癌的分子区分标志性指标[13]。最新基因干涉研究表明,对Sox-2基因表达进行干涉可阻止乳腺癌细胞进入S期,使其细胞周期停留在G1期,并改变了细胞形态[16]。说明干预Sox-2基因表达能够抑制肿瘤细胞增殖。
本研究在Ⅰ期及Ⅱa期宫颈癌患者中均检测到Sox-2蛋白表达,说明宫颈癌组织中可能均存在数量不等、具有干细胞特征的多能性低分化或未分化的肿瘤细胞。这些表达Sox-2的具有干细胞特征的细胞可能就是宫颈癌干细胞,有希望在细胞分离纯化和体内成瘤实验中进行进一步分离和鉴定。本研究结果显示,Sox-2蛋白阳性表达率及其mRNA相对表达量宫颈癌组织>CIN组织>正常宫颈组织,且Sox-2蛋白的表达随宫颈癌分化程度的降低而增加。肿瘤细胞分化程度越低,其基因结构及表型越接近原始幼稚的干细胞,恶性程度相对较高的宫颈癌组织中存在具有干细胞特征的肿瘤细胞数量也较多。上述结果提示Sox-2可能参与了宫颈癌组织的癌变过程,并可能与宫颈癌的浸润转移关系密切,且其高表达的肿瘤其恶性程度高,这与国内外的研究结果一致[13~15]。
综上所述,Sox-2与宫颈癌的发生发展有密切关系,研究Sox-2蛋白及基因在宫颈癌中的作用及其机制有助于进一步了解宫颈癌的生物学行为,有望为该病的早期诊断和治疗提供新的分子靶点。
[1]Parkin DM,Bray F,Ferlay J,et al.Estimating the world cancer burden:Globocan 2000 [J].Int J Cancer,2001,94(2):153-156.
[2]万丽娟,高桂卿.宫颈癌干细胞表面标志物的研究进展[J].现代妇产科进展,2011,20(12):990-992.
[3]Weissman IL.Stem cells:units of development,units of regeneration,and units in evolution[J].Cell,2000,100(1):157-168.
[4]Chambers I,Tomlinson SR.The transcriptional foundation of pluripotency[J].Development,2009,136(14):2311-2322.
[5]Gangemi RM,Griffero F,Marubbi D,et al.Sox2 silencing in glioblastomatumor-initiatingcells causes stop of proliferation and loss oftumorigenicity[J].Stem Cells,2009,27(1):40-48.
[6]Schmitz M,Temme A,Senner V,et al.Identification of Sox2 as anovel glioma-associatedantigen and potential target for T cellbasedimmunotherapy[J].Br J Cancer,2007,96(8):1293-1301.
[7]Chen Y,Shi L,Zhang L,et al.The molecular mechanism governingthe oncogenic potential of Sox2 in breast cancer[J].J Biol Chem,2008,283(26):17969-17978.
[8]Adam JB,Hideo W,Craig HM,et al.SOX2 is an amplified lineage-survival oncogene in lung and esophageal squamous cell carcinomas[J].Nature Genetics,2009,(41):1238-1242.
[9]Sato A,Ishiwata T,Matsuda Y.Expression and role of nestin in human cervical intraepithelialneoplasia and cervical cancer[J].Int J Oncol,2012,41(2):441-448.
[10]张松灵,张海鹏,王艳丽.正常宫颈及宫颈癌组织中干细胞标记物表达情况的研究[J].中国妇幼保健,2008,23(3):392-393.
[11]Martens JE,Arends J,Van der Linden PJ,et al.Cytokeratin 17 and p63 are markers of the HPV target cell,the cervicalstem cell[J].Anticancer Res,2004,24(2B):771.
[12]Regauer S,Reich O.CK17 and p16 expression patterns distinguish(atypical)immature squamousmetaplasia from high-grade cervical in traepithelial neoplasia(CINⅢ)[J].Histopathology,2007,50(5):629.
[13]冯定庆,李彩荣,朱园园,等.子宫颈癌干细胞的分离培养及生物学特性鉴定[J].肿瘤,2010,30(4):42-44.
[14]Reményi A,Lins K,Nissen LJ,et al.Crystal structure of a POU/HMG/DNA ternary complex suggests differential assembly of Oct4 and Sox2 on two enhancers[J].Genes Dev,2003,17(16):2048-2059.
[15]Kondo T,Setoguchi T,Taga T.Persistence of a small subpopulation of cancer stem like cells in the Caglioma cell line[J].Proc Natl Acad Sci USA,2004,101(3):781-786.
[16]Rivenbark AG,Stolzenburg S,Beltran AS,et al.Epigenetic reprogramming of cancer cells via targeted DNA methylation[J].Epigenetics,2012,7(4):350-360.

