CHO细胞初始接种密度对细胞毒性试验结果的影响
管 莹,夭建华,高 茜,曾婉俐,黄海涛,李雪梅,缪明明
(云南烟草科学研究院,云南 昆明 650106)
体外细胞毒性试验作为一类重要的体外试验,在新药研发以及化学物质毒性评价方面均发挥着重要的作用。中性红比色法和噻唑蓝(MTT)比色法是目前应用较多的两种毒理学检测细胞毒性的方法,具有简便、快捷、灵敏等特点,广泛应用于评定食品、药品、化妆品对细胞的毒性作用[1~7]。
据报道[6~10],由于使用的细胞种类不同,细胞毒性试验中适合的细胞初始接种密度存在较大差异。本实验室实际检测工作中发现,细胞毒性试验定量测定结果的变异较大,可比性较差,而细胞初始接种密度可能是影响定量测定结果的重要因素,但未见文献报道。鉴于此,为了提高中性红比色法和MTT比色法体外细胞毒性试验结果的半定量或定量检测的可靠性和可比性,作者就CHO细胞初始接种密度对中性红比色法和MTT比色法体外细胞毒性试验的影响进行了比较,旨在为运用中性红比色法和MTT比色法对化学品、食品等受试物的毒理学检测提供参考。
1 实验
1.1 材料、试剂和仪器
中国仓鼠卵巢细胞(CHO细胞),中国科学院昆明动物研究所。
DMEM/F12(Solarbo公司),胎牛血清(美国Klark),PBS,胰酶,中性红(Sigma公司),二甲基亚砜(DMSO)。
96孔及24孔细胞培养板(Corning公司),二氧化碳培养箱(Forma公司),酶标仪(Bio-Rod公司),Borgwaldt RM20/CS型半自动转盘式吸烟机。
1.2 受试物的制备
按国标方法[11],利用半自动转盘式吸烟机抽吸40支标准测试用美国肯塔基卷烟3R4F,用直径92 mm的剑桥滤片捕集燃吸后产生的烟气总粒相物(TPM);将剑桥滤片放入三角瓶中,加入适量DMSO,使TPM在DMSO中的浓度为10 mg·mL-1;超声20 min;过滤收集TPM提取液;储存于-80 ℃,备用。
1.3 细胞的传代培养
将CHO细胞按常规方法传代培养:DMEM/F12完全培养液(含10%胎牛血清),37 ℃,5%CO2。
1.4 细胞倍增时间的测定
取CHO对数生长期的细胞,用胰酶进行消化,吹打均匀,细胞计数后分别以细胞密度(×104个·mL-1)为2、4、6、8、10接种于24孔板中,每孔0.5 mL,分别于24 h、48 h各取3孔,弃去培养液及未贴壁细胞,加入1 mL PBS洗2次后去上清,用胰酶消化贴壁细胞后进行细胞计数。按式(1)计算细胞倍增时间(tD)[8]:
(1)
式中:tD为t1~t2时间范围内细胞的倍增时间;n1为t1时刻的细胞数;n2为t2时刻的细胞数[13]。
1.5 中性红比色法测定受试物对细胞的抑制率
取CHO对数生长期的细胞,用胰酶进行消化,吹打均匀,细胞计数后分别以细胞密度(×104个·mL-1)为2、4、6、8、10接种于96孔板中,每孔200 μL,置于37 ℃、5% CO2培养箱中培养24 h;加入受试物,受试物终浓度(μg·mL-1)分别为50、100、120、140、160、200、300,每个浓度6个复孔,置于37 ℃、5% CO2培养箱中培养24 h;加入浓度为100 μg·mL-1的中性红DMEM无血清培养液,每孔200 μL,置于37 ℃、5% CO2培养箱中培养3 h;去除中性红溶液,加入1%的甲醛溶液200 μL,固定1 min;去除固定液,每孔加入200 μL中性红萃取液(现配,水∶乙醇∶乙酸=49∶50∶1),置于微量振荡器上振荡10 min,用酶标仪测量540 nm处吸光度值。按式(2)计算细胞抑制率(X):
(2)
式中:ODn为样品多孔平均OD值;OD0为空白多孔平均OD值;ODc为对照多孔平均OD值[14]。
1.6 MTT比色法测定受试物对细胞的抑制率
取CHO对数生长期的细胞,用胰酶进行消化,吹打均匀,细胞计数后分别以细胞密度(×104个·mL-1)为2、4、6、8、10接种于96孔板中,每孔200 μL,置于37 ℃、5% CO2培养箱中培养24 h;加入受试物,受试物终浓度(μg·mL-1)分别为50、100、120、140、160、200、300,每个浓度6个复孔,置于37 ℃、5% CO2培养箱中培养24 h;加入浓度为5 mg·mL-1的MTT溶液,每孔20 μL,置于37 ℃、5% CO2培养箱中培养3 h;去除溶液,加入DMSO溶液,每孔200 μL,置于微量振荡器上振荡10 min,用酶标仪测量490 nm处吸光度值。计算细胞抑制率。
1.7 统计学方法
采用SPSS 16.0软件的one-way ANOVA功能进行方差分析。
2 结果与讨论
2.1 CHO细胞初始接种密度对细胞倍增时间的影响(图1)
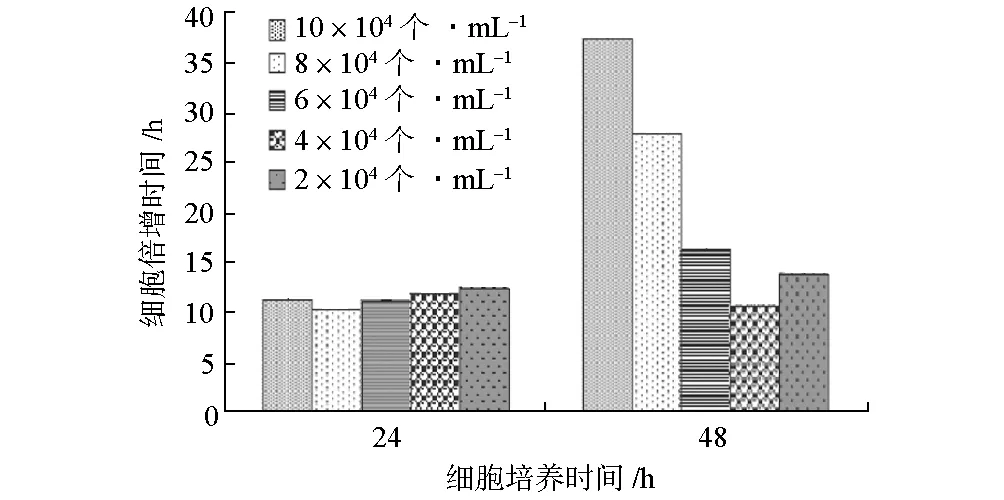
图1 CHO细胞初始接种密度对细胞倍增时间的影响
由图1可知,各浓度组在24 h内细胞倍增时间无明显差异(P>0.05),大约10~15 h增殖一代。而细胞培养第48 h时,8×104个·mL-1与10×104个·mL-1实验组细胞生长速度明显减慢,分别为28 h和37 h左右增殖一代;2×104个·mL-1、4×104个·mL-1、6×104个·mL-1实验组细胞生长速度与培养24 h相近,仍然为10~15 h增殖一代。因此,以初始密度2×104~6×104个·mL-1接种细胞,CHO在连续48 h的培养时间内细胞增殖速度较为稳定。
2.2 CHO细胞初始接种密度对中性红比色法测定受试物的细胞抑制率的影响(图2)
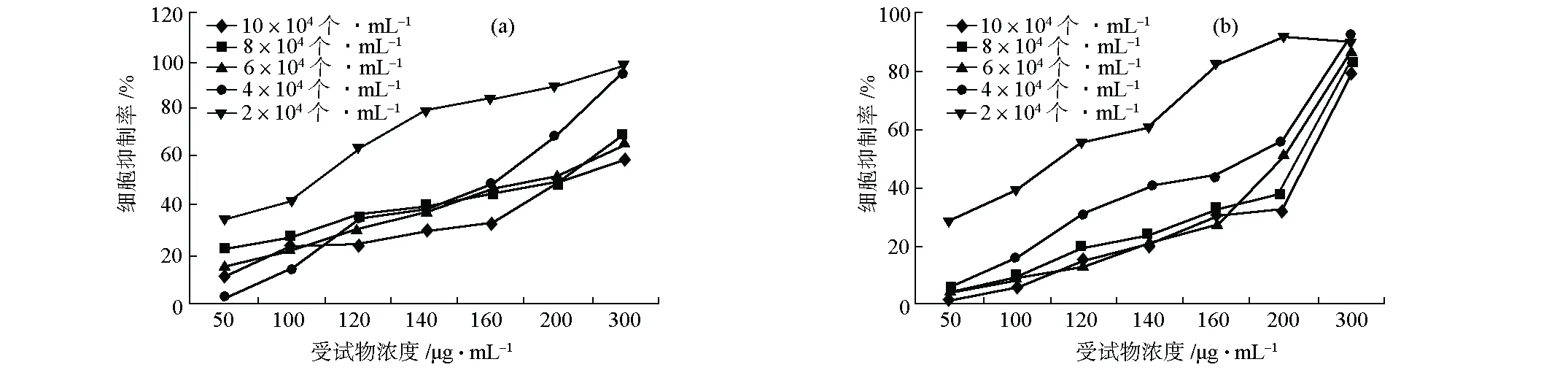
图2 CuSO4(a)和TPM(b)对不同初始接种密度CHO细胞的抑制率
由图2可知,随着细胞初始接种密度的降低,两种受试物对CHO细胞的抑制率均呈升高趋势。
利用SPSS 16.0软件中的LSD多重比对法,对CuSO4及TPM两种受试物在剂量(μg·mL-1)为50、100、120、140、160、200、300时对CHO细胞初始接种密度(×104个·mL-1)为10、8、6、4、2的细胞抑制率进行方差分析,结果见表1。
表1CuSO4和TPM对不同初始接种密度CHO细胞的抑制率的方差分析
Tab.1Varianceanalysis(Pvalue)ofinhibitionrateofCHOcellswithdifferentinitialseedingdensitiestreatedbyCuSO4andTPM
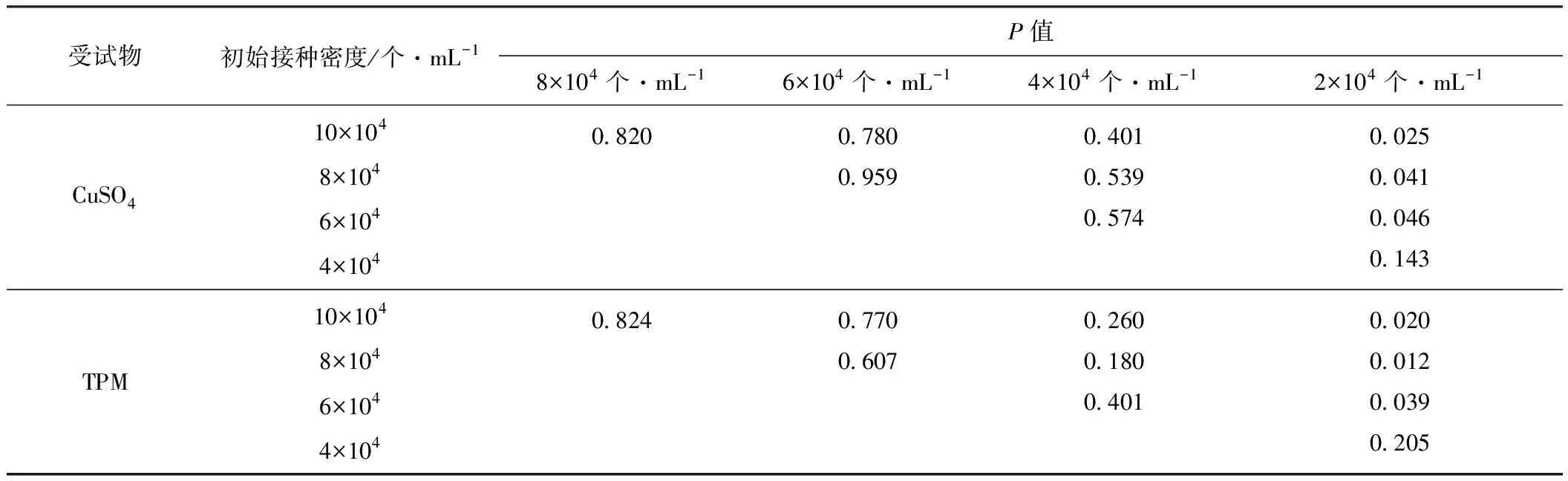
受试物初始接种密度/个·mL-1P值8×104个·mL-16×104个·mL-14×104个·mL-12×104个·mL-1CuSO410×1048×1046×1044×1040.8200.7800.9590.4010.5390.5740.0250.0410.0460.143TPM10×1048×1046×1044×1040.8240.7700.6070.2600.1800.4010.0200.0120.0390.205
由表1可知,受试物为CuSO4或TPM时,2×104个·mL-1实验组与10×104个·mL-1、8×104个·mL-1、6×104个·mL-13个实验组的细胞抑制率间存在显著差异(P<0.05);10×104个·mL-1、8×104个·mL-1、6×104个·mL-1、4×104个·mL-14个实验组间细胞抑制率均无显著差异(P>0.05)。
上述结果表明,两种受试物对CHO细胞的抑制率随细胞初始接种密度的降低均呈升高的趋势,当CHO细胞的初始接种密度为4×104~10×104个·mL-1时用中性红比色法测定的同一受试物对细胞的抑制率相对稳定,在统计学上无显著差异(P>0.05)。
2.3 CHO细胞初始接种密度对MTT比色法测定受试物的细胞抑制率的影响(图3)
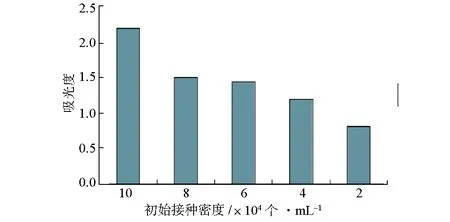
图3 MTT比色法测定不同初始接种密度CHO细胞的吸光度
通常情况下用MTT比色法进行检测时,为了保证实验结果的线性,MTT在490 nm处的吸光度值最好在0~1.2范围内。由图3可知,除2×104个·mL-1、4×104个·mL-1实验组MTT吸光度值低于1.2外,其余3组的吸光度值均超出了线性范围。
2.4 讨论
(1)细胞毒性试验通常采用处于对数生长期的细胞,这是由于对数生长期的细胞代谢旺盛、生长迅速、代时稳定,个体形态、化学组成和生理特性等均较一致,利用对数生长期的细胞进行试验有利于比较试验结果。无论是中性红比色法还是MTT比色法,细胞毒性试验的周期均为48 h,而受试物是在细胞完全贴壁后加入,即细胞接种后24 h,因此,培养48 h细胞的稳定增殖对试验结果的可重复性的影响尤为重要。本研究利用细胞倍增试验对CHO细胞不同初始接种密度下48 h内的细胞倍增时间进行了测定,结果显示以2×104~6×104个·mL-1的初始接种密度接种细胞,细胞在连续48 h的培养时间内生长速度较为稳定。而以较高初始密度(8×104~10×104个·mL-1)接种细胞,由于生长空间有限,当细胞达到饱和密度后,细胞间的接触抑制作用导致细胞增殖减慢,细胞停止生长,进入平台期,这不利于试验结果的比较。
(2)随细胞初始接种密度的降低,CuSO4和TPM两种受试物对CHO细胞的抑制率均呈升高趋势。这可能是由于,细胞初始接种密度不同,同一浓度的受试物对于实际受试细胞个体来说所需要承受的相对剂量是不同的。细胞越少,同样浓度的受试物相对每个受试细胞来说所需要承受的剂量越高。不同的细胞毒性试验其最适细胞初始接种密度有所不同。中性红比色法的最适细胞初始接种密度比MTT比色法高,这可能是由于中性红比色法细胞毒性试验过程中比MTT比色法多了清洗和固定等步骤,对细胞有一定损耗,因此细胞初始接种密度应适当提高。
(3)目前关于化学物质细胞毒性的研究报道中,由于各研究目标样品的靶器官不同,所选择的细胞也有所差异。例如王明衡等[9]选取HL-7702肝细胞对食品添加剂亚硫酸钠的细胞毒性进行检测,细胞初始接种密度为2.5×105个·mL-1;而苏建青等[7]选择鸡胚成纤维细胞(CEF)对人参皂角促细胞增殖作用进行了检测,细胞初始接种密度为1×106个·mL-1。由此可见,细胞毒性试验由于使用的细胞种类不同,具体选用的细胞初始接种密度也有所差异,且范围较大[6~10]。目前,对于不同比色法所适用的细胞初始接种密度,尚未见相关文献进行严格限定。而本研究结果也证明细胞初始接种密度确实是影响细胞毒性试验结果的重要因素之一,且不同的细胞毒性试验其最适初始接种密度有所不同,并通过试验得到了CHO细胞进行中性红比色法和MTT比色法细胞毒性试验的最适细胞初始接种密度的范围,在具体试验操作中应根据试验需求选取最适浓度,以提高试验结果的可重复性及可比性。
3 结论
综合CHO细胞倍增试验与CHO细胞不同初始接种密度对中性红比色法和MTT比色法两个细胞毒性试验影响的结果,发现:以2×104~6×104个·mL-1为初始接种密度,细胞在48 h内生长速度较为稳定;以4×104~6×104个·mL-1的初始密度接种细胞,中性红比色法细胞毒性试验结果较为稳定,可重复性较好;而以2×104~4×104个·mL-1的初始密度接种细胞,MTT比色法细胞毒性试验结果较稳定。
参考文献:
[1] 林祥梅,王建峰,梅琳,等.用人角质细胞评价4种化妆品的细胞毒性[J].毒理学杂志,2008,22(1):75-76.
[2] 夭建华,陈辉敏,方力,等.国内外卷烟危害性评价方法现状和发展趋势[J].烟草科技,2007,(1):50-53.
[3] 卢斌斌,Ryan M,Lynne W,等.3种不同焦油卷烟烟气的细胞毒性比较[J].烟草科技,2007,(12):38-41.
[4] 马亚萍,白剑英.MTT法探讨N-乙酰半胱氨酸对Na2SO3小鼠脾淋巴细胞毒性的影响[J].山西医科大学学报,2006,37(10):1020-1021.
[5] 熊习昆,杨颖,谭小华,等.3T3中性红试验在化妆品光毒性检测中的应用[J].中国公共卫生,2006,22(10):1207-1209.
[6] 刘锐克,周军兰,梁建辉.中性红比色法检测大鼠小脑神经瘤活细胞[J].中国药理学与毒理学杂志,2003,17(1):74-78.
[7] 苏建青,褚秀玲,李俊霞,等.中性红染色法检测人参皂苷及其衍生物对CEF增殖的影响[J].安徽农业科学,2009,37(35):17523-17525.
[8] 夭建华,缪明明,米其利,等.卷烟主流烟气细胞毒性在5种细胞系中的反应差异[J].中国烟草学报,2011,17(3):67-70.
[9] 王明衡,白剑英,原福胜.食品添加剂亚硫酸钠对HL-7702肝细胞的毒性作用[J].山西医科大学学报,2008,39(1):21-23.
[10] 司晓辉,刘正.人牙周膜成纤维细胞的体外培养及其生物学性状[J].陕西医学杂志,2001,30(4):195-197.
[11] GB/T 19609-2004,卷烟用常规分析用吸烟机测定总粒相物和焦油[S].
[12] 鞠桂芝,付士波,刘建香,等.X-射线照射对EL-4淋巴瘤细胞周期进程及细胞倍增时间的影响[J].辐射研究与辐射工艺学报,1998,16(3):157-160.
[13] 严泉剑,郭金龙,刘恩靖,等.绘制细胞生长曲线及细胞群体倍增时间的简化计算[J].前卫医药杂志,2000,17(4):228-229.
[14] 唐萍,米其利,倪红梅,等.CHO细胞中性红试验参数研究[J].云南大学学报(自然科学版),2010,32(S1):127-129.

