RsrA-CFP融合蛋白的克隆表达及圆二色性分析
陈 欢,叶邦策
(华东理工大学 生物反应器工程国家重点实验室,上海 200237)
天蓝色链霉菌是研究链霉菌的模式菌,2002年完成测序工作,预测基因大约为7825个,调控基因占到12.3%[1]。σR(sigR)是天蓝色链霉菌细胞内氧化还原自稳的广域调控子,受σR调控的基因超过30个。trxBA和trxC是受σR调控的下游基因,编码硫氧还原蛋白及二硫键还原途径相关的酶基因。trxBA和trxC基因受到σR调控激活后开始大量转录表达,翻译出硫氧还原蛋白和二硫键还原途径的相关酶,这些酶快速地发挥它们的酶活性,以最快速度消除由于氧化压力对细胞内蛋白带来的损伤,使天蓝色链霉菌安全度过恶劣的氧化状态,忍受极端的环境[2]。
RsrA蛋白是调控σR活性的anti-sigR因子,对天蓝色链霉菌的σR调控机理的研究非常重要。
为深入研究RsrA蛋白的功能,作者在此将RsrA蛋白用青色荧光蛋白CFP进行标记融合表达[3,4],通过构建rsrA/cfp/pET-28a(+)融合表达质粒,在大肠杆菌BL21(DE3)中大量表达;利用镍柱亲和层析分离纯化RsrA-CFP蛋白,并用SDS-PAGE鉴定蛋白分子量和纯度;利用圆二色性初步测定RsrA-CFP融合蛋白二级结构,为RsrA蛋白的后续功能研究奠定基础。
1 实验
1.1 材料
1.1.1 菌株与质粒
天蓝色链霉菌M145,上海交通大学邓子新教授馈赠;大肠杆菌DH5α、大肠杆菌BL21(DE3)、pET-28a(+)质粒,生物反应器工程国家重点实验室保藏;pECFP-N1质粒,华东理工大学杨弋教授馈赠。
1.1.2 培养基
LB培养基:称取2.5 g LB粉末,加入去离子水,搅拌至全部溶解,定容到100 mL。若配制固体培养基,则另加入1.5%琼脂。121 ℃灭菌30 min,冷却备用。
YEME培养基:分别称取3 g酵母提取物、5 g蛋白胨、3 g麦芽提取物、10 g葡萄糖,加入去离子水,搅拌至全部溶解,定容到1000 mL。115 ℃灭菌20 min,冷却后添加2 mL 2.5 mol·L-1的MgCl2·6H2O(121 ℃灭菌30 min)。
1.1.3 试剂
限制性内切酶EcoRI、HindⅢ、NcoI、DNA聚合酶rTaq、GC Buffer、Buffer、dNTP、T4连接酶、DNA ladder,Takara公司;LB粉末、琼脂糖凝胶DNA回收纯化(离心柱型)试剂盒、细菌基因组DNA抽提(离心柱型)试剂盒、PCR产物回收纯化(离心柱型)试剂盒,上海捷瑞;琼脂糖,上海博升;质粒小提(离心柱型)试剂盒,天根生化。测序由上海美季生物公司完成,引物由上海生工生物工程有限公司合成。
1.2 方法
1.2.1rsrA和cfp基因的克隆
将天蓝色链霉菌M145接种至YEME培养基中,于30 ℃、200 r·min-1培养3~4 d,进行基因组抽提。根据CFP和RsrA蛋白融合特点进行引物设计:rsrA正向引物RsrAA:5′-CATGCCATGG-GCAGCTGCGGAGAGCCG-3′(NcoI),rsrA反向引物RsrAB:5′-CCGGAATTCGGACTCCTGCGGGG-CCG-3′(EcoRI),cfp正向引物CFPA:5′-CGGAATTCGGAGGAAGCATGGTGAGCAAGGGCGA-3′(EcoRI),cfp反向引物CFPB:5′-CCCAAGCTTCTTGTACAGCTCGTCCATGCC-3′(HindⅢ)。除必要的酶切位点和保护碱基外,rsrA正向引物增加2 bp用于消除移码突变,cfp正向引物增加9 bp的linker用于消除结构域之间的相互影响。
rsrA基因扩增条件:94 ℃预变性5 min;94 ℃变性30 s,68 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸 7 min。rsrA基因扩增体系:ddH2O 15 μL,GC Buffer(×2) 25 μL,dNTP 4 μL,RsrAA(20 μmol·L-1) 2 μL,RsrAB(20 μmol·L-1) 2 μL,M145基因组2 μL,rTaq 0.3 μL,总体系50 μL。
cfp基因扩增条件:94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸 7 min。cfp基因扩增体系:ddH2O 35 μL,Buffer(×10) 5 μL,dNTP 4 μL,CFPA(20 μmol·L-1) 2 μL,CFPB(20 μmol·L-1)2 μL,质粒pECFP-N1 2 μL,rTaq 0.3 μL,总体系50 μL。
1.2.2rsrA/pET-28a(+)表达质粒的构建
将rsrA片段与质粒pET-28a(+)分别进行NcoI和EcoRI双酶切,酶切条件为37 ℃水浴3 h。双酶切体系:Buffer K(×10) 5 μL,ddH2O 31 μL,BSA 5 μL,rsrA或pET-28a(+) 5 μL,EcoRI 2 μL,NcoI 2 μL,总体系50 μL。
将双酶切后的rsrA与pET-28a(+) 在连接体系中按10∶1连接,连接条件为16 ℃水浴过夜。连接体系:Buffer(×10) 1 μL,ddH2O 7.0 μL,rsrA0.4 μL,pET-28a(+) 1.2 μL,T4连接酶0.4 μL,总体系10 μL。
将10 μL连接液全部转化大肠杆菌DH5α,菌液PCR鉴定后将阳性克隆送测序。
1.2.3rsrA/cfp/pET-28a(+)融合表达质粒的构建
抽提上述重组质粒rsrA/pET-28a(+),将cfp片段与质粒rsrA/pET-28a(+)进行EcoRI和HindⅢ双酶切,酶切条件为37 ℃水浴3 h。双酶切体系:Buffer M(×10) 5 μL,ddH2O 36 μL,cfp或rsrA/pET-28a(+) 5 μL,EcoRI 2 μL,HindⅢ 2 μL,总体系50 μL。
将双酶切后的cfp与rsrA/pET-28a(+)在连接体系中按10∶1连接,连接条件为16 ℃水浴过夜。连接体系:Buffer(×10) 1 μL,ddH2O 6.9 μL,cfp0.4 μL,rsrA/pET-28a(+) 1.3 μL,T4连接酶0.4 μL,总体系10 μL。
将10 μL连接液全部转化大肠杆菌DH5α[5],双酶切筛选鉴定后将阳性克隆送测序,随后将序列完全正确的阳性质粒转化至大肠杆菌BL21(DE3)。
1.2.4 RsrA-CFP蛋白的诱导表达及其条件优化
1.2.4.1 RsrA-CFP蛋白诱导表达及荧光测定
对上述构建的rsrA/cfp/pET-28a(+)/BL21(DE3)菌种进行37 ℃培养过夜活化,按1%接种量接种至20 mL含有卡那霉素抗性(50 μg·mL-1)的LB培养基中继续培养,于30 ℃诱导表达10 h。然后于45 000 r·min-1离心20 min,弃上清收集菌体,加入10 mL PBS缓冲溶液悬浮菌体,进行荧光测定。酶标参数设定为荧光测定,激发光440 nm,扫谱记录460~600 nm。以波长为横坐标、相对荧光值为纵坐标,用GraphPad Prism软件绘制荧光曲线。
1.2.4.2 最佳 IPTG浓度的确定
在上述实验中,RsrA-CFP蛋白表达量较低,因此需要对其进行表达优化。将菌种按1%接种量接种至20 mL含有卡那霉素抗性(50 μg·mL-1)的LB培养基中,于37 ℃培养3 h左右,分别加入0.6%、0.8%、1.0%、1.2%的100 mmol·L-1IPTG于30 ℃摇床诱导表达10 h。然后于45 000 r·min-1离心20 min,弃上清收集菌体,加入10 mL PBS缓冲溶液悬浮菌体,测定相对荧光值,确定最佳IPTG浓度。
1.2.4.3 最佳OD600的确定
将菌种按1%接种量接种至20 mL含有卡那霉素抗性(50 μg·mL-1)的LB培养基中,于37 ℃培养至OD600值分别为0.5、0.6、0.8、1.0时,加入1.0% IPTG,于30 ℃摇床诱导表达10 h。然后于45 000 r·min-1离心20 min,弃上清收集菌体,加入10 mL PBS缓冲溶液悬浮菌体,测定相对荧光值,确定最佳OD600。
1.2.5 SDS-PAGE鉴定
采用上述最佳条件进行蛋白的诱导表达,菌体经超声破碎后,收集粗蛋白液。利用融合蛋白尾部的His标签进行镍柱纯化,操作步骤参照说明书。随后进行SDS-PAGE蛋白电泳鉴定其分子量和纯度。
1.2.6 圆二色性测定RsrA-CFP融合蛋白结构
用PBS(pH值8.0)缓冲溶液将镍柱纯化的RsrA-CFP透析过夜,将透析后的样品稀释至0.5 μmol·L-1。圆二色性仪器预备,以5 L·min-1的流速通入氮气,测量波长设定为190~260 nm,带宽0.25 nm,测量速度2.5 nm·s-1,测量池10 mm(0<吸光值<2)。在相同参数条件下,先测定空气背景基线,再测定PBS缓冲溶液和RsrA-CFP-PBS样品的CD值,结果用CDNN软件进行分析。
2 结果与讨论
2.1 rsrA和cfp基因的克隆(图1)

M1.2000 bp Marker M2.5000 bp Marker 1.rsrA基因扩增产物2,3.pET-28a(+)质粒抽提物 4.cfp基因扩增产物
由图1可看出,rsrA目的条带大小为333 bp(图1a);cfp目的条带大小为744 bp(图1b)。两者均与电泳图上的实际位置相一致,而且PCR反应的特异性很好,无杂带,纯化后可用于后续实验。
2.2 rsrA/pET-28a(+)表达质粒的构建与鉴定(图2)

M.2000 bp Marker 1~10.PCR产物
理论上rsrA/pET-28a(+)PCR后的条带大小为333 bp。由图2可看出,大部分克隆菌都扩增出大小正确的条带,选择2#去测序,结果序列正确,保存此菌液,用于后续实验。
2.3 rsrA/cfp/pET-28a(+)融合表达质粒的构建与鉴定(图3)

M.5000 bp Marker 1,2.pET-28a(+)质粒抽提物3,4,5.挑取的单克隆菌液质粒双酶切产物
理论上双酶切后的2条条带大小分别为1100 bp和5000 bp左右。由图3可看出,条带大小均正确,可认为是阳性克隆,选择3#去测序,结果序列正确,可用于后续实验。
2.4 RsrA-CFP蛋白诱导表达及条件优化
2.4.1 RsrA-CFP蛋白诱导表达及荧光测定
荧光值的高低可以认为是融合蛋白表达量的高低,因此,可省去用SDS-PAGE蛋白电泳分析蛋白诱导表达量的步骤。酶标仪测定时,先扫全谱,确定其最大发射峰,再确定其最大激发峰。RsrA-CFP蛋白的荧光测定曲线见图4。
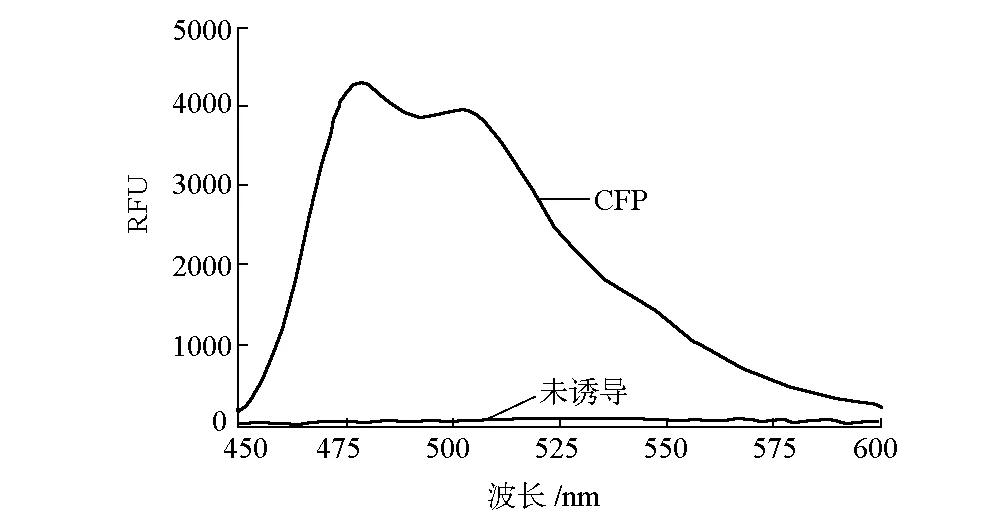
图4 RsrA-CFP蛋白的荧光测定曲线
由图4可看出,最大发射峰为478 nm,与文献值相吻合。最大激发峰为440~458 nm,与文献的CFP荧光特性相吻合,可以确定其表达了目标蛋白RsrA-CFP。
2.4.2 最佳IPTG浓度的确定
IPTG浓度对RsrA-CFP蛋白表达的影响见图5。

图5 IPTG浓度对RsrA-CFP蛋白表达的影响
由图5可看出,随着IPTG浓度的增大,478 nm处的相对荧光值先升高后降低,在1.0%时达到最高。因此,确定最佳IPTG浓度为1.0%。
2.4.3 最佳OD600的确定
OD600对RsrA-CFP蛋白表达的影响见图6。

图6 OD600对RsrA-CFP蛋白表达的影响
由图6可看出,478 nm处的相对荧光值随着OD600的升高而降低。考虑到OD600过低不利于蛋白表达,确定最佳OD600为0.5左右。
2.5 SDS-PAGE鉴定(图7)

M.蛋白Marker 1.RsrA-CFP
理论上RsrA-CFP蛋白分子量为40 kD左右。由图7可看出,条带大小基本正确,纯度较高,可用于后续实验。
2.6 圆二色性测定RsrA-CFP融合蛋白结构(图8)

图8 圆二色性测定RsrA-CFP蛋白二级结构
由图8可看出,RsrA-CFP蛋白二级结构特征CD峰明显。CDNN软件分析后显示,在蛋白二级结构中,螺旋结构占32.2%、平行结构占8.0%、反向平行结构占9.3%、β折叠占16.7%、无规则卷曲占34.4%。这说明构建表达的融合蛋白RsrA-CFP得到了很好的折叠,预示着非常好的活性。
2.7 讨论
(1)首次将RsrA与CFP进行融合表达,这是利用青色荧光蛋白CFP作为荧光标记具有的优点,有益于简化后续确定诱导条件时的检测程序,较传统SDS-PAGE蛋白电泳大幅缩短了检测时间,并降低了成本。
(2)大肠杆菌能够将天蓝色链霉菌内rsrA基因与cfp进行融合可溶表达,证明了这两种原核生物之间的基因相容性。
(3)利用圆二色性初步测定RsrA-CFP蛋白的CD值,CDNN软件分析得到二级结构组成,螺旋结构占了1/3左右,说明构建表达的融合蛋白RsrA-CFP得到了很好的折叠,蛋白很成熟,为后续RsrA蛋白的进一步功能研究奠定了基础。
3 结论
以天蓝色链霉菌M145基因组作模板,扩增σR(sigR)的anti-sigR因子基因rsrA,得到了333 bp基因;以质粒pECFP-N1作模板,扩增青色荧光蛋白基因cfp,得到了744 bp基因。将两个基因融合串联,构建rsrA/cfp/pET-28a(+)融合表达质粒。利用荧光检测技术,确定大肠杆菌BL21(DE3)在OD600为0.5时,用1 mmol·L-1IPTG进行诱导能大量表达融合蛋白RsrA-CFP。用镍柱亲和层析分离纯化RsrA-CFP蛋白,并用SDS-PAGE鉴定其分子量为40 kD左右。利用圆二色性初步测定RsrA-CFP蛋白的CD值,经CDNN软件分析得到:螺旋结构占32.2%、平行结构占8.0%、反向平行结构占9.3%、β折叠占16.7%、无规则卷曲占34.4%,为RsrA蛋白的功能研究奠定了基础。
参考文献:
[1] Bentley S D,Chater K F,Cerdeno-Tarraga A M,et al.Complete genome sequence of the model actinomyceteStreptomycescoelicolorA3(2)[J].Nature,2002,417(6885):141-147.
[2] Paget M S,Kang J G,Roe J H,et al.σR,an RNA polymerase sigma factor that modulates expression of the thioredoxin system in response to oxidative stress inStreptomycescoelicolorA3(2)[J].EMBO Journal,1998,17(19):5776-5782.
[3] Baird G S,Zacharias D A,Tsien R Y.Biochemistry,mutagenesis,and oligomerization of DsRed,a red fluorescent protein from coral[J].Proceedings of the National Academy of Sciences of the United States of America,2000,97(22):11984-11989.
[4] Tsien R Y.The green fluorescent protein[J].Annual Review of Biochemistry,1998,67:509-544.
[5] Sambrcok J,Russell D W.Molecular Cloning——A Laboratory Manual(third edition)[M].New York:Cold Spring Harbor Laboratory Press,2001:4-100.

