正十六烷降解菌的分离、鉴定及降解特性
张 楠,陈波水,方建华,王 九
(解放军后勤工程学院,重庆 401311)
石油及石油产品主要由烷烃和芳香烃等碳氢化合物组成,因其固有的生态毒性和难生物降解性而给环境带来严重的危害[1,2],石油烃污染环境的原位修复和异位修复一直是研究热点[3~7]。生物修复通过添加营养物质和(或)微生物提高污染物在环境中的生物降解能力[8,9],是治理烃污染的有效方法。石油烃的生物降解过程和降解程度受温度、pH值和微生物营养物质(如某些含N、P的化合物)等因素的影响[10~14]。深入研究石油烃的生物降解过程和机制、了解烃降解菌的生理生化特性,是实现烃污染环境生物修复的重要基础。
作者在此以正十六烷(以下简称C16)为唯一碳源,通过富集培养从石油污染土壤中分离出1株C16降解菌,在对菌株进行鉴定的基础上,考察不同pH值条件下菌株对C16的降解能力,以期为石油烃污染的生物修复提供帮助。
1 实验
1.1 土壤样本
重庆某油库储油罐附近土壤(砂土和沙壤土)。
1.2 主要培养基
无机盐培养基:NaCl 0.1 g,NH4NO30.1 g,MgSO4·7H2O 0.05 g,KCl 0.01 g,CaCl20.05 g,用NaH2PO4-NaOH调节pH=5.0或用KH2PO4-K2HPO4调节pH=6.0、7.0、7.8,蒸馏水定容至100 mL,于121 ℃蒸汽灭菌30 min。
C16富集培养基:1.0 g C16加入100 mL无机盐培养基中。
C16无机盐培养基:0.2 g C16加入100 mL无机盐培养基中。
1.3 C16降解菌的分离与鉴定
1.3.1 菌株的分离
采用富集法对C16降解菌进行分离、纯化。方法如下:土壤样本经破碎、过筛、除杂、混匀后,称取50 g加入250 mL无菌水中,充分振荡,浸泡并曝气24 h;取适量接种于100 mL C16富集培养基中驯化,在37 ℃、160 r·min-1下振荡培养,10 d为1个驯化周期,经3个驯化周期后,取富集培养液在LB平板上分离、纯化;据含甘油培养物保藏法于-70 ℃保存备用。
将纯菌种接种于LB液体培养基,于32 ℃、200 r·min-1下振荡培养12 h,8500 r·min-1离心10 min,去上清,称菌体湿重,用无机盐培养基配成10%(质量分数,下同)的菌悬液,备用。
1.3.2 菌株的鉴定
菌株的形态观察方法参见文献[15]。采用VITEK32型全自动微生物分析仪进行自动化鉴定。
1.4 C16降解菌的降解特性测定
1.4.1 标准曲线的绘制
准确称取C16(分析纯)0.0520 g、0.1011 g、0.1523 g、0.2024 g、0.2491 g,分别置于10 mL容量瓶中,用正己烷(分析纯)定容并混匀。采用气相色谱[GC900气相色谱仪:FID检测器;OV17毛细管气相色谱柱;载气(高纯N2)流速50 mL·min-1;燃烧气(H2)流速50 mL·min-1;空气流速100 mL·min-1;检测器温度220 ℃;进样器温度280 ℃;柱温220 ℃;进样量0.5 μL]测定C16的色谱峰面积,采用外标法对峰面积(y)和C16质量(x)进行回归并绘制标准曲线。
1.4.2 降解特性研究
在pH值为7.0的100 mL C16无机盐培养基中加入10%的菌悬液0.5 mL,于34 ℃、200 r·min-1摇床振荡培养一定时间后,依次加入15 g NaCl、10 mL正己烷和100 μL 6 mol·L-1的HCl,于32 ℃、200 r·min-1摇床振荡20 min,然后将培养液倒入分液漏斗静置、分层,取上层清液置于25 mL消解管,加入1 g无水Na2SO4,摇匀,放入4 ℃冰箱中静置1 d,采用气相色谱测定C16峰面积,根据标准曲线计算C16质量,依下式计算C16降解率ε:
式中:m为C16降解后的质量,g;m0为C16降解前的质量,g。
1.4.3 pH值对菌株降解能力的影响
分别在pH值为5.0、6.0、7.0、7.8的100 mL C16无机盐培养基中加入10%的菌悬液0.5 mL,于34 ℃、200 r·min-1摇床振荡培养5 d,采用气相色谱测定峰面积,计算C16降解率。
2 结果与讨论
2.1 菌株的鉴定
从土壤样本中分离出1株以C16为唯一碳源的菌株。该菌株在LB平板上的生长情况以及经革兰氏染色后的形态见图1。

图1 菌株的形态
由图1可知,所分离的菌株在LB平板上的生长菌落为中等大小,不规则形,中间凸起,表面湿润,透明,边缘不整齐,平板呈浅绿色,革兰氏染色阴性;在油镜下呈卵圆形或短杆状。
菌株全自动微生物分析鉴定结果见表1。

表1 菌株自动化鉴定结果
注:“-”表示反应结果为阴性;“+”表示反应结果为阳性
由图1和表1初步确定菌株为铜绿假单胞菌(Pseudomonasaeruginosa)。
2.2 C16的标准曲线(图2)

图2 C16的标准曲线
由图2可知,拟合的C16回归方程为:y=4942620x-5984,R2=0.9933。表明C16的质量与峰面积呈良好的线性关系。
2.3 菌株对C16的降解作用
接种微生物的培养液中C16降解率随降解时间的变化见图3。
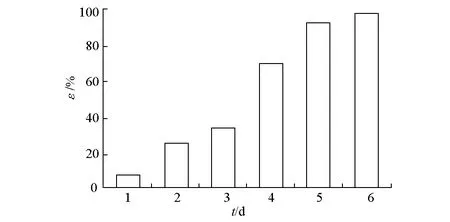
图3 C16降解率随降解时间的变化
由图3可知,C16降解率随降解时间的延长而升高,尤其是第3 d后降解率升幅更为明显,到第6 d时降解率达97.3%。表明所分离的菌株具有良好的降解C16的能力,是有效的C16降解菌。
2.4 pH值对菌株降解能力的影响
不同pH值条件下,接种微生物的培养液培养5 d后的C16降解率见图4。

图4 C16降解率随pH值的变化
由图4可知,在弱酸性至弱碱性(pH值6.0~7.8)条件下,C16能较好地被铜绿假单胞菌所降解;不同pH值下的降解率大小依次为pH值7.0>pH值6.0>pH值7.8>pH值5.0,即中性条件(pH值7.0)最适宜C16降解。在较强酸性条件(pH值5.0)下,菌株降解C16的能力较差,可能是酸性条件下菌株代谢途径改变的缘故。
3 结论
经过富集培养、分离,获得1株以C16为唯一碳源的菌株。根据形态观察和自动化分析鉴定,初步确定该菌株为铜绿假单胞菌(Pseudomonasaeruginosa)。气相色谱分析结果表明,所分离的铜绿假单胞菌菌株具有良好的降解C16的能力,且在中性条件下的降解能力最强。
参考文献:
[1] Bartz W J.Lubricants and the environment[J].Tribology International,1998,31(1-3):35-47.
[2] Haus F,German J,Junter G A.Primary biodegradability of mineral base oils in relation to their chemical and physical characteristics[J].Chemosphere,2001,45(6-7):983-990.
[3] 陆光华,万蕾,苏瑞莲.石油烃类污染土壤的生物修复技术研究进展[J].生态环境,2003,12(2):220-223.
[4] Rojas-Avelizapa N G,Roldá-Carrillo T,Zegarra-Martíez H,et al.A field trial for an ex-situ bioremediation of a drilling mud-polluted site[J].Chemosphere,2007,66(9):1595-1600.
[5] 苏增建,谷慧宇,李敏.海洋石油污染修复研究进展[J].安全与环境学报,2009,9(2):56-65.
[6] 陈立,万力,张发旺,等.土著微生物原位修复石油污染土壤试验研究[J].生态环境学报,2010,19(7):1686-1690.
[7] 罗洪君,王绪远,赵骞,等.石油污染土壤生物修复技术的研究进展[J].四川环境,2007,26(3):104-109.
[8] 钱欣平,阳永荣,孟琴.生物表面活性剂对微生物生长和代谢的影响[J].微生物学通报,2002,29(3):75-78.
[9] Nocentini M,Pinelli D,Fava F.Bioremediation of a soil contaminated by hydrocarbon mixtures:The residual concentration problem[J].Chemosphere,2000,41(8):1115-1123.
[10] 李丽,张利平,张元亮.石油烃类化合物降解菌的研究概况[J].微生物学通报,2001,28(5):89-92.
[11] 李习武,刘志培.石油烃类的微生物降解[J].微生物学报,2002,42(6):764-767.
[12] Atlas R M.Microbial degradation of petroleum hydrocarbons:An environmental perspective[J].Microbiol Rev,1981,45(1):180-209.
[13] Leahy J G,Colwell R R.Microbial degradation of hydrocarbons in the environment[J].Microbiol Rev,1990,54(3):305-315.
[14] 马强.高效石油烃降解菌的分离、鉴定及降解能力研究[D].北京:北京化工大学,2008.
[15] 钱存柔,黄仪秀.微生物学实验教程(第二版)[M].北京:北京大学出版社,2008:23-36,94-100.
——化工原料、农副产品

