大肠杆菌高密度培养研究进展
黎鸿平,黄海婵,钟卫鸿
(浙江工业大学生物与环境工程学院,浙江 杭州 310014)
随着基因重组技术的不断发展,越来越多的外源基因得以在微生物中表达,以便大量快捷地获得外源基因产物或改变微生物的代谢特性。与其它表达系统相比,E.coli表达系统因具有易培养、遗传学背景清楚、表达水平高、培养周期短等特点,成为目前应用最为广泛的表达系统。
工业生产发酵的基本目标是以最低的成本获得最高的细胞或其产物收益,因此大规模高密度培养微生物的技术和工艺变得越来越重要。E.coli的高密度培养技术(HCDC)正是在这样的一种需求下而发展起来的一门重要技术。E.coli高密度培养是一个相对概念,一般是指E.coli在液体培养时菌体干细胞质量(Dry cell weight,DCW)达50 g·L-1以上时的生长状态或培养技术。据Riesenberg[1]报道,在考虑了培养条件和营养物质等因素后,大肠杆菌菌体密度理论上限值能达到200 g·L-1。高密度培养涉及到培养基组成、培养条件等诸多方面。
作者在此就大肠杆菌高密度培养的影响因素、培养方法及基因工程技术在大肠杆菌高密度培养中的最新应用进行简要综述。
1 大肠杆菌高密度培养的影响因素
1.1 菌种
不同的E.coli菌株由于自身代谢系统的不同,在培养条件、对外界环境耐受能力等方面都存在着较大的差异。例如E.coliK系列菌株和E.coliB系列菌株均为较常用的培养菌株,但E.coliB菌株在高密度培养过程中产生的乙酸要比E.coliK少。van de Walle等[2]对E.coliBL21(DE3)和E.coliK(JM109)进行了乙酸代谢研究,发现前者的乙酸积累仅为后者的1/4,菌体密度也高出25%。
1.2 接种量
接种量会影响菌体在发酵罐中的生长速度。较大的接种量可以缩短菌体生长达到最高值的时间,这是因为种子液中含有大量胞外水解酶类,有利于菌体对基质的快速充分利用,缩短生长延迟期。胡爽等[3]在200 L发酵罐中,将接种量由5%增加至10%,最终菌体密度由44.2 g·L-1提高至53.9 g·L-1。但是接种量过大也会使菌体生长过快,菌体生长持续的时间缩短,自溶也较快,反而影响后期的生长。因此,接种时应根据菌体具体的生长情况确定接种量。
1.3 培养基

1.3.1 碳源
不同微生物对碳源的需求各不相同,碳源的种类和浓度对菌体的生长代谢也有不同的影响。葡萄糖是E.coli最易利用的碳源,也是E.coli发酵中最常用的碳源。但葡萄糖浓度超过50 g·L-1后就会抑制E.coli的生长,因此,保持基质中适当的较低的碳源浓度是E.coli高密度培养的关键。李民等[5]研究发现,培养基中初糖浓度为10 g·L-1时,菌体密度和产物表达量均获得了较好的效果。但以葡萄糖作为碳源易产生代谢抑制物质——乙酸,而有研究表明以甘油代替葡萄糖作为E.coli生长的碳源可以减少乙酸的积累,更易达到高密度[6]。Medaglia等[7]在发酵过程中补加麦芽糖和甘油,菌体密度和产物量都提高了2.5倍。
1.3.2 氮源
大量研究表明应对发酵过程中的氮源加以控制,氮源浓度过高对菌体的生长和产物的表达合成都可能产生负面影响。培养E.coli时常用氨水作为主要的氮源,在培养过程中以流加的方式加入培养液,既可用来充当氮源又可用来调节发酵液的pH值,但氨水加入过多会导致细胞的产率下降[8]。碳氮比也是影响E.coli生长的重要因素:当碳氮比过高时,菌体生长代谢缓慢,菌体利用营养物质主要用于合成积累代谢产物;当碳氮比较低时,菌体利用营养物质主要用于自身的生长,菌体初期生长繁殖旺盛,导致代谢废物增多,发酵液粘度增大,进而影响溶氧,使菌体后期生长受到抑制并造成菌体提前衰老自溶。
1.3.3 微量元素
E.coli对钙、钴、铁、铝、锰、锡等微量元素的需求量虽然很小,但微量元素对微生物的生长及活性所起的作用不可忽视,尤其是在高密度培养时更应在培养基中添加适量的微量元素。朱才庆等[9]在培养E.coliDA19时发现,在基本培养基中添加混合微量元素能大大改善菌体生长。
1.4 培养条件
1.4.1 温度
温度对E.coli的生长繁殖有很大的影响。在一定范围内,随着温度的升高,E.coli比生长速率变大;但温度进一步升高,E.coli比生长速率反而会减小。E.coli的最适生长温度为37 ℃,但在近期的一些研究中,经常以低于37 ℃的温度来培养E.coli,当培养温度从37 ℃下降至30 ℃左右时,可使细胞的营养物摄入率和比生长速率减小,减少有害抑制产物(主要是乙酸)的积累和代谢热的产生[10]。Ohta等[11]在培养重组E.coliKS467时,通过将温度从37 ℃降低到30 ℃,成功地将发酵液中乙酸的浓度从10 g·L-1降至5 g·L-1。程立坤等[12]在32 ℃下培养E.coli时,通过控制比生长速率在0.3 h-1以下,使乙酸浓度降至0.90 g·L-1,菌体密度达到53.42 g·L-1。
1.4.2 溶氧
氧是一种难溶气体,常温常压下氧在纯水中的溶解度仅为7 mg·L-1。因此溶氧很容易成为E.coli高密度培养的限制因素,尤其是在高密度培养的后期,发酵液中菌体密度很大,耗氧量极大。溶氧浓度较高时,比生长速率就会增大,使菌体大量繁殖生长;当溶氧浓度超过一定限度时,菌体的比生长速率反而减小,而且还会导致乙酸积累增多,葡萄糖的单位得率反而下降[13]。在高密度培养时,可以通过提高发酵通气量、搅拌速度、通入纯氧等方法来控制溶氧;还可以通过使用氧溶解度高的载体来提高溶氧,如动物来源的血红蛋白和长链的烃等化合物。另外,将能够提高氧传递能力的透明颤藻血红蛋白(VHB)基因克隆并在菌体中表达,也能取得不错的效果[14]。
1.4.3 pH值

1.5 有害副产物
E.coli利用葡萄糖产生的主要有害物质是乙酸,尤其是在较大的比生长速率或供养不足时;但当E.coli在葡萄糖过量的条件下生长时,即使氧充足也会产生乙酸[16]。乙酸的积累对E.coli生长繁殖会产生抑制作用,当其浓度大于5 g·L-1时,菌体生长缓慢,菌体得率和最大可达细胞密度均下降;当其浓度超过14 g·L-1时,菌体停止生长[10]。
Han等[17]认为,细菌在比生长速率较小时通过氧化代谢过程产生的能量足以满足其生长生理的需求,便不会产生乙酸;而在比生长速率较大时,大肠杆菌通过氧化代谢不能产生足够的能量,必须通过乙酸生成途径提供ATP和NADH2。因此,为减少乙酸的积累,可以通过调节限制性底物(如葡萄糖)的供应来控制比生长速率低于临界值。研究表明,比生长速率超过0.35 h-1时就会产生乙酸[10],故一般控制比生长速率在0.1~0.35 h-1之间比较合适,但应根据不同的情况选择合适的比生长速率才能达到高密度培养。另外,通过提高乙酸利用率也能有效减少培养液中乙酸的积累。Oh等[18]认为,乙酸的分解代谢是在许多酶的作用下完成的,而在通常情况下,葡萄糖对这些酶具有抑制作用,所以在含有葡萄糖的培养基中这些酶是以失活状态存在的。因此,解除这种抑制作用的突变株在利用消耗葡萄糖的同时会不断地分解消耗培养基中存在的乙酸[19]。
另外,通过优化培养基、降温培养、透析培养等方法都可以有效地降低乙酸的积累。
2 大肠杆菌高密度培养的方法
E.coli高密度培养的方法主要是补料分批培养。作为目前应用最广泛、最成熟的培养技术,补料分批培养是一种介于分批培养和连续培养之间的补料方法,是在分批培养过程中间歇或连续地补加新鲜培养基,以达到延长菌体生长期和控制培养过程的目的。补料方法分为非反馈补料和反馈补料。
2.1 非反馈补料
非反馈补料主要包括恒速补料、变速补料、指数补料等。
恒速补料是以恒定的速率流加限制性基质的碳源。随着发酵的进行,相对于培养液中的菌体来说,营养浓度是逐渐降低的,菌体的比生长速率也慢慢减小,但菌体能够得到持续的生长,培养液中菌体量在培养过程中是线性增加的。
变速补料是指在培养过程中,营养物质的补加速率以阶段性或线性等方式不断加快或减慢。当菌体浓度较高或菌体生长旺盛时,就加快补料速度,加入更多营养物促进细胞的生长繁殖从而实现高密度;反之,就减慢补料速度。李民等[5]采用三阶段式流加葡萄糖的方法培养重组菌生产骨形成蛋白,取得了较好的效果。Son等[20]采用线性提速补料的方法培养重组大肠杆菌生产SOD,细胞得率为17.6 g·L-1。
指数补料是一种简单而又有效的补料方式,它能使培养体系中营养物的浓度控制在较低的水平,可以有效地减少乙酸等有害代谢物的积累,使菌体密度以一定的比生长速率呈指数形式增加(比生长速率通常维持在0.1~0.35 h-1之间)。Korz等[6]采用指数补料方式,以葡萄糖和甘油为碳源培养重组E.coli,菌体密度分别达到了128 g·L-1及148 g·L-1。孙艳等[21]采用分阶段控制比生长速率的指数补料策略培养E.coliJM109,有效缓解了单一比生长速率情况下溶氧不能无限制地增加的问题,控制培养液中乙酸浓度在2.53 g·L-1左右,细胞密度(OD600)达到91.2。
2.2 反馈补料
反馈补料分为恒溶氧法、恒pH值法、CER(CO2排放率)法等。

表1就几种常用的反馈和非反馈补料方法进行了比较。
由表1可以看出,反馈补料能够根据反馈的信息及时调整补料的速率和策略,但具有一定的滞后性,不能完全避免糖浓度的波动和代谢副产物的积累;而非反馈补料也存在不能根据发酵环境的变化和菌体生长的具体情况作出反馈调节的缺点。因此,如何结合各补料方法的优点同时摒弃其缺点,找到一种新的、更有效的补料方法成为近期研究的热点和突破点。Restaino等[24]在培养E.coliK4产荚膜多糖时,采用在发酵前期用指数补料、在发酵后期用微孔过滤的分阶段混合补料方法,取得了较好的效果,菌体浓度达到36.4 g·L-1,多糖产量达到4.33 g·L-1。Biener等[25]在培养重组E.coliTB1时,建立了一套以菌体生长过程中产生的热量为依据进行关联补料,从而更加准确和持续地控制菌体的比生长速率的培养调控模型,为大肠杆菌的高密度培养提供了新的方向。
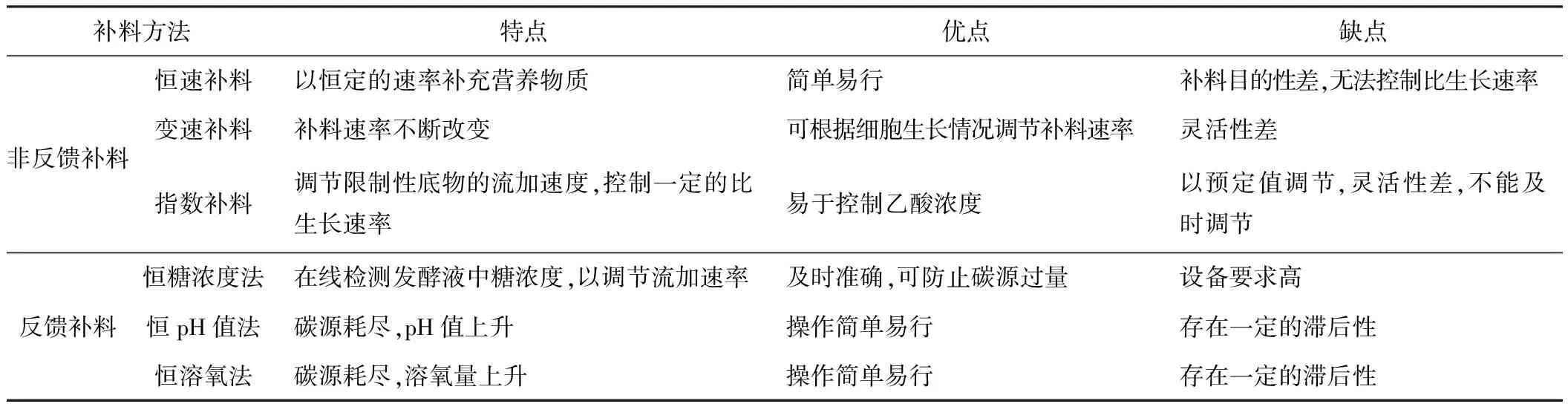
表1 高密度培养流加补料方法的比较
2.3 人工神经网络在补料调控中的应用
由于发酵过程涉及生命体的生长和繁殖,机理复杂,具有高度的非线性、时变性和不确定性,同时过程参数的测量时间长、精度差,因而很难建立适当的计算模型来描述发酵过程[26]。人工神经网络技术由于具有很强的非线性映射能力,它通过网络内部权值的调整来拟合系统的输入输出关系,即只根据输入输出数据来建立模型,可以反映十分复杂的非线性关系,因而很适合于多因变量、多自变量统计中的建模,可以相当准确地模拟系统行为[27],所以,近年来人工神经网络技术在发酵过程的控制、优化等方面得到了广泛的应用。
Duan等[28]在培养E.coliK12时,根据DO-STAT法和pH-STAT法获得的基础数据进行神经网络的建模和训练,用于溶氧和pH值变化模式的识别,进而辨识葡萄糖是过量还是不足,以便更加准确地控制补料速率,使发酵罐中的葡萄糖控制在适合的水平,既不积累代谢副产物又能使菌体以最大的比生长速率生长,提高了菌体密度和外源蛋白的表达量,取得了较好的效果,菌体浓度达到53 g·L-1。
3 基因工程技术在大肠杆菌高密度培养中的应用
基因工程技术在E.coli高密度培养中的应用主要体现在以下两方面:
(1)阻断乙酸产生的主要途径:通过切断碳源生成乙酸的主要代谢通路,可以显著减少乙酸产生。E.coli产生乙酸的途径有两条:一是在丙酮酸氧化酶的作用下,直接由丙酮酸产生乙酸,但在E.coli中此酶的活性很低,产生的乙酸很少;另一条是在乙酸激酶(Ack)和磷酸转乙酰基酶(Pta)的作用下,将乙酰辅酶A转化为乙酸,这是E.coli产生乙酸的主要途径。因此通过敲除Pta或Ack基因,使E.coli中合成乙酸的主要途径受阻,就能有效地减少培养液中乙酸的积累[29]。
(2)改变代谢路径以减少乙酸的形成:由于代谢溢流的存在,在高密度培养过程中当葡萄糖浓度过高时,菌体摄取的葡萄糖有部分会通过三羧酸循环产生乙酸。因此,研究人员通过改变菌体的葡萄糖代谢途径,使菌体摄取的碳源更多地流向其自身的结构和功能物质的合成、减少流向乙酸合成的途径,从而减少乙酸的产生。Soto等[30]通过构建代谢工程菌,使葡萄糖在半乳糖透性酶和葡萄糖激酶的作用下代谢分解,取代原有的磷酸烯醇式丙酮酸的代谢途径,用100 g·L-1的初始葡萄糖浓度培养野生型E.coliW3110和代谢工程菌E.coliVH33,结果显示:E.coliW3110产生的乙酸浓度达到5.3 g·L-1,而E.coliVH33产生的乙酸浓度只有2 g·L-1。Knabben等[31]用初始浓度为130 g·L-1的葡萄糖培养代谢工程菌,使培养液中乙酸的浓度降至0.5 g·L-1左右。
4 结语
目前,人们对大肠杆菌高密度培养进行了大量的研究,并取得了许多成就:了解了许多影响其高密度培养的因素;研究了多种不同的补料方式。同时,随着培养控制手段的进一步发展,监控的培养参数越来越详细,对细菌代谢过程的了解和掌握也越来越透彻,更有利于研究和控制其培养过程。但仍然还有许多不足和不够完善的地方,对大肠杆菌的生长代谢理论也还有待更深入详细地研究。
参考文献:
[1] Riesenberg D.High-cell-density cultivation ofE.coli[J].Curr Op-in Biotechnol,1991,2(3):380-384.
[2] van de Walle M,Shiloach J.Proposed mechanism of acetate accumulation in two recombinantEscherichiacolistrains during high density fermentation[J].Biotechnol Bioeng,1998,57(1):71-78.
[3] 胡爽,蔡海波,蒋加庆,等.重组大肠杆菌HT02高密度高表达HT-1融合蛋白发酵过程优化[J].化工学报,2009,60(12):3063-3070.
[4] Bunch A W.High cell density growth of microorganisms[J].Biotechnol Genet Eng Rev,1994,12(5):536-561.
[5] 李民,陈常庆,朴勤,等.利用恒溶氧—补料分批技术高密度培养大肠杆菌生产重组人骨形成蛋白-2A[J].生物工程学报,1998,14(3):270-275.
[6] Korz D L,Rinas U,Hellmuth K,et al.Simple fed-batch technique for high cell density cultivation ofEscherichiacoli[J].J Biotechnol,1995,39(1):59-65.
[7] Medaglia G,Valsesia G,Panke S.Development of a high cell-density protocol for the production of pregallidermin,a non-toxic precursor of the lantibiotic gallidermin[J].J Biotechnol,2010,145(2):176-185.
[8] Lau J,Tran C,Licari P,et al.Development of a high cell-density fed-batch bioprocess for the heterologous production of 6-deoxyerythronolide B inEscherichiacoli[ J].J Biotechnol,2004,110(1):95-103.
[9] 朱才庆,叶勤.微量元素对大肠杆菌生长和乙酸生成的影响研究[J].微生物学报,2004,44(2):230-234.
[10] Lee S Y.High cell-density culture ofEscherichiacoli[J].Tr-ends Biotechnol,1996,14(3):98-105.
[11] Ohta K,Shibui T,Morimoto Y,et al.High level production of human proapo A-I by fed-batch culture of recombinantEscherichiacoli[J].J Ferment Bioeng,1993,75(2):155-157.
[12] 程立坤,黄静,秦永锋,等.代谢副产物乙酸对L-色氨酸发酵的影响[J].微生物学通报,2010,37(2):166-173.
[13] Castan A,Nasman A,Enfors S-O.Oxygen enriched air supply inEscherichiacoliprocesses:Production of biomass and recombinant human growth hormone[J].Enzyme Microb Technol,2002,30(7):847-854.
[14] 汪嵘,赵颖怡,张云开,等.高密度培养基因工程菌的条件优化[J].广西农业生物科学,2002,21(1):58-61.
[15] 涂桂云,李敏.基因工程菌高密度发酵工艺研究进展[J].工业微生物,2004,34(3):49-52.
[16] Wolfe A J.The acetate switch[J].Microbiol Mol Biol Rev,2005,69(1):12-50.
[17] Han K,Lim H C,Hong J.Acetic acid formation inEscherichiacolifermentation[J].Biotechnol Bioeng,1992,39(6):663-671.
[18] Oh M K,Rohlin L,Kao K C,et al.Global expression profiling of acetate-grownEscherichiacoli[J].J Biol Chem,2002,277(15):13175-13183.
[19] Shiloach J,Fass R.GrowingE.colito high cell density——A historical perspective on method development[J].Biotechnol Adv,2005,23(5):345-357.
[20] Son Y J,Bae J Y,Chong S H,et al.Expression,high cell density culture and purification of recombinant EC-SOD inEscherichiacoli[J].Appl Biochem Biotechnol,2010,162(6):1585-1598.
[21] 孙艳,王长城,张玲,等.重组大肠杆菌产胆固醇氧化酶的指数流加策略[J].化工进展,2010,29(1):130-133.
[22] Jeong K J,Rani M.High-level production of a single chain antibody against anthrax toxin inEscherichiacoliby high cell density cultivation[J].Bioprocess Biosyst Eng,2011,34(7):811-817.
[23] Kim S G,Shin S Y,Park Y C,et al.Production and solid-phase refolding of human glucagon-like peptide-1 using recombinantEscherichiacoli[J].Protein Expr Purif,2011,78(2):197-203.
[24] Restaino O F,Cimini D,De Rosa M,et al.High cell density cultivation ofEscherichiacoliK4 in a microfiltration bioreactor:A step towards improvement of chondroitin precursor production[J].Microb Cell Fact,2011,10(1):1-10.
[25] Biener R,Steinkamper A,Hofmann J.Calorimetric control for high cell density cultivation of a recombinantEscherichiacolistrain[J].J Biotechnol,2010,146(1-2):45-53.
[26] 须文波,潘丰,冯斌.智能控制在发酵过程中的应用[J].无锡轻工大学学报,2000,19(5):455-457.
[27] Fukuda T,Shibata T.Theory and applications of neural networks for industrial control systems[J].IEEE,T Ind Electron,1992,39(6):472-489.
[28] Duan S B,Shi Z P,Feng H J,et al.An on-line adaptive control based on DO/pH measurements and ANN pattern recognition model for fed-batch cultivation[J].Biochem Eng J,2006,30(1):88-96.
[29] Contiero J,Beatty C,Kumari S,et al.Effects of mutations in acetate metabolism on high-cell-density growth ofEscherichiacoli[J].J Ind Microb Biotechnol,2000,24(6):421-430.
[30] Soto R,Caspeta L,Barron B,et al.High cell-density cultivation in batch mode for plasmid DNA production by a metabolically engineeredE.colistrain with minimized overflow metabolism[J].Biochem Eng J,2011,56(3):165-171.
[31] Knabben I,Regestein L,Marquering F,et al.High cell-density processes in batch mode of a genetically engineeredEscherichiacolistrain with minimized overflow metabolism using a pressurized bioreactor[J].J Biotechnol,2010,150(1):73-79.

