大黄提取物对成年大鼠睾丸的毒性作用
胡晓丞,李亚洲,佟继铭,张树峰
(承德医学院中药研究所河北省中药研究与开发重点实验室,河北 承德 067000)
大黄为蓼科植物掌叶大黄(Rheum palmatum L.)、唐古特大黄(Rh.tanguticum Maxim.ex Balf)或药用大黄(Rh.officinale Baill)的干燥根及根茎[1],大黄中主要成分为蒽醌类化合物,含量为3% ~5%,大部分为葡萄糖结合苷,游离苷元有大黄酸、大黄素、芦荟大黄素、大黄酚、大黄素甲醚等[2]。现代药理研究发现,大黄具有泻下、收涩、止血、活血、抗菌、抗病毒、降血压、收缩血管、降低血管脆性、延缓衰老等作用[2]。此外,目前几乎所有治疗急、慢性肾衰竭的中药复方中均有大黄[3]。据统计,8000多种中药制剂中约有800多种含有大黄,一般被认为其不良反应较低,临床应用比较安全,大多数降脂减肥,排毒养颜类中成药均含有大黄[4],以致应用大黄的疗程过长,使大黄相关的不良反应的发生率增高。有关文献报道,大黄使小鼠及金黄地鼠睾丸生精小管上皮细胞层有断脱,金黄地鼠和大鼠的性器官萎缩[4-5];不同年龄大鼠对大黄的耐受性上存在差异,大黄不良反应与年龄具有相关性[6]。本实验通过长期给予大黄水提取物及总蒽醌,采用显微镜、ELISA和免疫组化等实验方法检测大黄对雄性大鼠肾及睾丸等的毒性作用,为临床安全用药提供实验依据。
1 材料与方法
1.1 药品
大黄,购自安国市长安中药材有限公司,产地甘肃。药品批号:20090902。经承德医学院中药研究所刘翠哲研究员鉴定为掌叶大黄的干燥根茎。
1.2 仪器与试剂
STP120自动组织处理机、171型组织自动包埋机和Multiskan MK3酶标仪为美国Thermo Electron公司产品;NIKON Eclipse 80i-尼康生物显微镜为上海江文信息技术有限公司产品;TK-218型恒温摊片烤片机为湖北泰维医疗科技有限责任公司产品。
兔抗免疫组化试剂盒和兔抗Bcl-2及Bax抗体,购自北京博奥森生物科技有限公司。大鼠睾酮、黄体生成素(luteinizing hormone,LH)、卵泡刺激素(follicle-stimulating hormone,FSH)ELISA检测试剂盒,购自南京建成生物工程研究所。
1.3 动物
1.4 大黄提取物的制备
1.4.1 大黄水提取物的制备
大黄药材,粉碎为粗粉,10倍水浸泡2次,合并提取液,过滤,提取率为26.46%,配制成含生药量为 0.24 kg·L-1药液,备用。
1.4.2 大黄总蒽醌的制备
大黄药材,粉碎为粗粉,加15倍水煮沸3次,每次20 min,合并提取液。用D101大孔树脂对提取液进行精制,以70%乙醇溶液洗脱,合并洗脱液,提取率为8.78%,配制成含总蒽醌量为0.02 kg·L-1药液,备用。
1.5 分组及给药
8周龄SD大鼠50只,分别随机分为正常对照组,大黄水提物 0.3,0.6,1.2 g·kg-1组及总蒽醌0.1 g·kg-1组,每组 10 只,ig给药,给药容积5 ml·kg-1,连续给药 30 d。
1.6 一般状态观察
观察给药期间实验大鼠的活动、步态、行为等一般健康情况;每周称体质量1次。
1.7 雌雄合笼交配
镜检法筛选成年发情期雌性SD大鼠,与正常对照组和大黄水提物1.2 g·kg-1组雌雄1∶1合笼交配。次日,用滴管取少量生理盐水释放于被检母鼠的阴道内,再吸出少许阴道内容物,滴于载玻片,用光学显微镜在100倍下检查,发现精子者为阳性(交配成功);否则为阴性。
1.4 统计学处理 采用 SPSS 20.0 软件进行数据分析。计数资料以例数和百分数表示,两组间比较采用 χ2 检验;呈正态分布的计量资料以 ±s 表示,两组间比较采用两独立样本 t 检验,术前、术后资料的比较采用配对 t 检验;呈偏态分布的计量资料以中位数(下四分位数,上四分位数)表示,两组间比较采用 Mann-Whitney U 检验。检验水准(α)为 0.05。
1.8 精子数量、活动率及畸变率的检测
取大鼠一侧附睾,置于盛2 ml生理盐水的平皿中,用眼科剪将附睾纵向剪2~3刀,静置3~5 min,轻轻摇匀,滤纸过滤后备用,然后检查。① 活精子计数:取摇匀的滤液滴入血细胞计数板按红细胞计数法[7]计数(×1010L-1)。② 精子活动率:用伊红活体染色法,计数6个不同视野各100个精子,计算活动精子率(%)。③精子畸形率:取精子滤液涂片,甲醇固定,用2%伊红Y染色12 h,高倍镜下观察100个精子的形态,计数精子畸形率(%)。
1.9 脏器指数的计算[8]
处死大鼠剖取双睾丸和附睾,用滤纸吸干血液,电子天平称重,并计算脏器指数。脏器指数=脏器质量(g)/体质量(g)×100。
1.10 血清中睾酮,LH和FSH的含量测定
腹主动脉取血,立即1360×g下离心10 min,取上清,将血清注入1.5 ml EP管中4℃保存备用。按照ELISA试剂盒说明书方法测定血清中睾酮,LH和FSH的含量。
1.11 睾丸组织病理学观察
睾丸用10%中性甲醛溶液固定,乙醇梯度脱水,二甲苯透明,常规石蜡包埋,5 μm均匀切片,HE染色,观察睾丸形态结构的变化。
1.12 免疫组织化学法[9]检测Bcl-2和Bax表达
睾丸组织蜡块5 μm切片、脱蜡、水化,3%H2O2溶液灭活内源性过氧化物酶,按照试剂盒说明的操作步骤进行DAB显色5~8 min,水洗以终止显色反应,苏木精轻度复染、自来水冲洗返蓝、1%盐酸乙醇分化、水冲洗,然后镜检。Bax,Bcl-2阳性产物表达于间质细胞和生精细胞的胞浆及胞浆内的棕黄色颗粒。采用图像分析系统进行Bax,Bcl-2表达半定量分析,即每组随机选取 10张切片,于 200倍镜下随机选择10个生精小管,测阳性产物表达百分率。
1.13 统计学分析
2 结果
2.1 大黄提取物对动物一般情况及体质量的影响
实验期间,正常对照组大鼠大便正常,活动敏捷,步态、行为及对外界反应情况正常,无死亡。大黄0.6和1.2 g·kg-1组及总蒽醌组大鼠均出现稀便、软便,体质量增长抑制,毛色暗淡,无光泽,不顺滑,精神不振,尿液颜色棕黄等现象,其中1.2 g·kg-1组及总蒽醌组大鼠出现局部被毛呈红色,尿液呈深红色的现象。3周后稀便、软便情况缓解,均无死亡。其中大黄提取物1.2 g·kg-1组及总蒽醌组大鼠反应明显迟缓。表1结果显示,与正常对照组比较,大黄提取物 0.3,0.6 和 1.2 g·kg-1组及总蒽醌组体质量增长受到了明显抑制(P<0.05);与大黄水提物0.3 g·kg-1相比,大黄水提取物 0.6,1.2 g·kg-1组及总蒽醌组体质量下降率有显著差异(P <0.05)。
2.2 大黄水提物对大鼠交配成功率的影响
如表2所示,与正常对照组和大黄水提物0.3 g·kg-1组相比,大黄水提物0.6和1.2 g·kg-1组和总蒽醌组交配成功率明显降低(P<0.05)。

Tab.1 Effect of rhubarb water extract(RWE)and rhubarb total anthraquinone(RTA)on body mass of rats
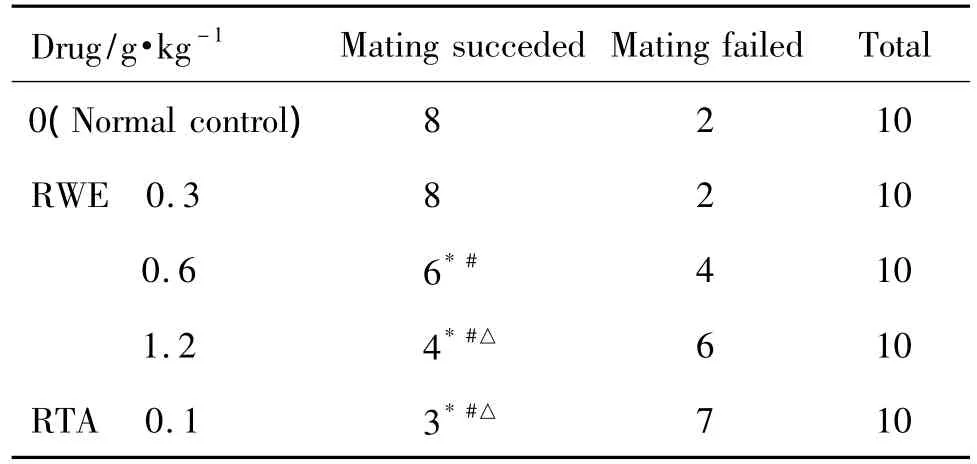
Tab.2 Effect of RWE and RTA on mating success in rats
2.3 大黄提取物对雄性大鼠精子数量、活动率和畸形率的影响
如表3所示,与正常对照组比较,大黄水提物及总蒽醌组精子数量明显减少,活动率明显降低(P<0.05),而精子畸形率无明显差异。
2.4 大黄提取物对大鼠睾丸及附睾指数的影响
如表4所示,与正常对照组比较,大黄提取物0.6和1.2 g·kg-1组和总蒽醌组睾丸质量明显降低(P <0.05),大黄提取物 1.2 g·kg-1和总蒽醌组附睾质量明显降低(P<0.05),大黄提取物0.3与0.6 g·kg-1组附睾质量差异无统计学意义,大黄提取物1.2 g·kg-1组和总蒽醌组睾丸指数明显降低(P<0.05),但各组附睾指数与正常对照组无明显差异。
2.5 大黄提取物对雄性大鼠血清性激素水平的影响
表5结果显示,与正常对照组相比,大黄提取物0.3 g·kg-1组的睾酮,LH,FSH含量无统计学差异,而大黄提取物0.6,1.2 g·kg-1组及总蒽醌组的睾酮浓度均明显降低(P<0.05);而LH,FSH浓度均明显升高(P <0.05)。与大黄提取物0.3和 0.6 g·kg-1组相比,大黄提取物1.2 g·kg-1组和总蒽醌组睾酮明显降低,而LH和FSH含量明显升高(P<0.05)。
2.6 大黄提取物对睾丸组织结构的影响
图1结果显示,正常对照组的间质细胞形态正常,生精小管基膜连续、完整,各级生精细胞形态正常,排列规则,支持细胞形态典型(图1A)。大黄提取物0.3 g·kg-1组的间质细胞出现破裂,管腔增大,但各级生精细胞仍清晰可见(图1B)。大黄提取物0.6 g·kg-1组的间质细胞部分破裂,生精小管管腔不规则,生精上皮细胞层次紊乱,细胞间隙增大(图1C)。大黄提取物1.2 g·kg-1组及总蒽醌组的间质细胞部分消失,生精小管支持细胞缺失,生精细胞间隙增大、部分缺失,细胞层明显减少、变薄(图1D,E)。
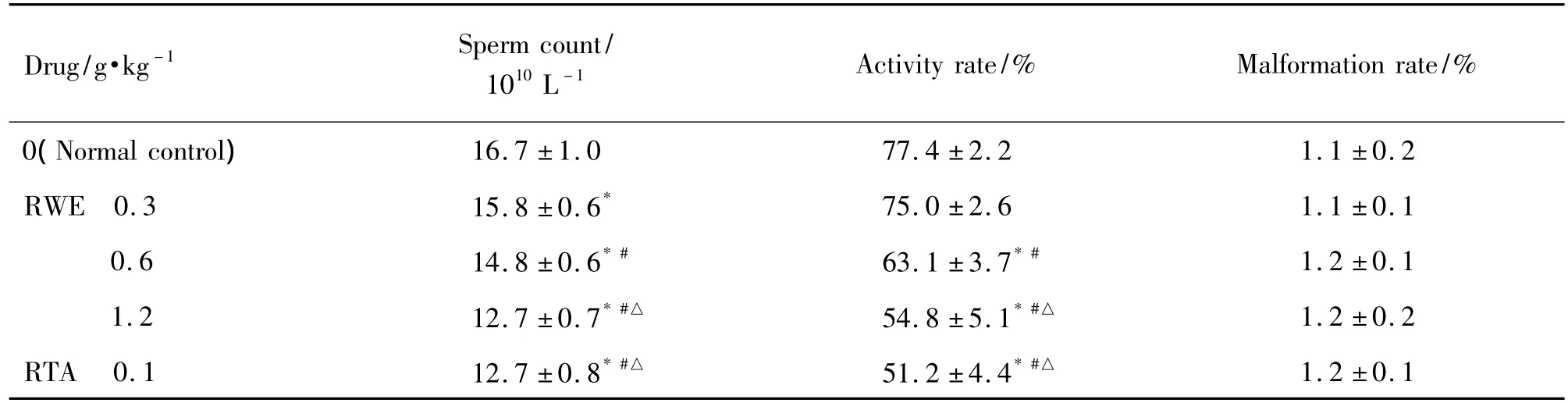
Tab.3 Effect of RWE and RTA on sperm count,the activity rate and malformation rate in rats
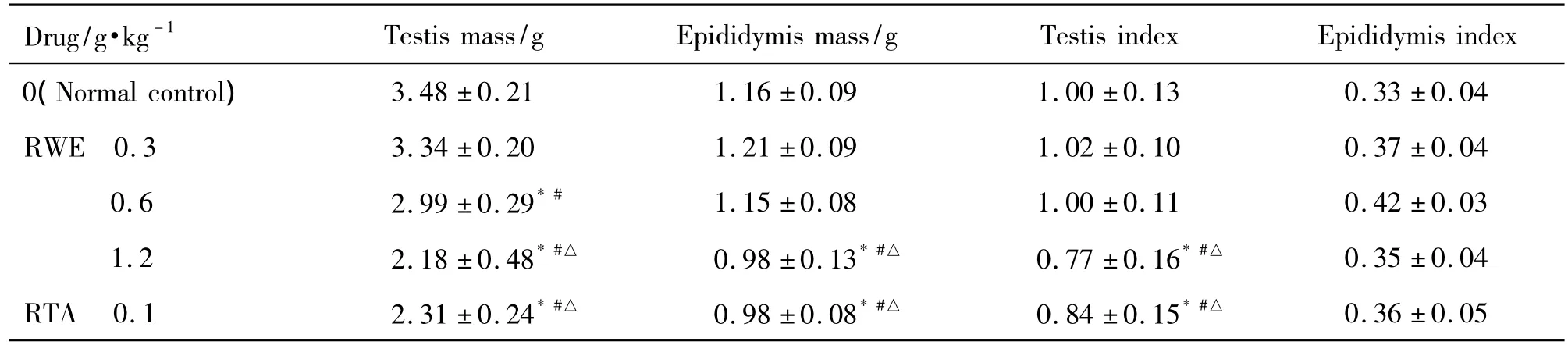
Tab.4 Effect of RWE and RTA on mass and indices of testis and epididymis in rats

Tab.5 Effect of RWE and RTA on levels of testosterone(T),luteinizing hormne(LH)and follicle-stimulating hormone(FSH)in serum of rats
2.7 大黄提取物对Bax和Bcl-2表达水平的影响
图2的免疫组化染色结果显示,在大鼠睾丸间质细胞、精原细胞及精母细胞胞浆内见到Bax(图2A)和Bcl-2(图2B)表达,表现为棕黄色颗粒。半定量结果(表6)显示,与正常对照组相比,大黄水提物0.3,0.6,1.2 g·kg-1组和总蒽醌组 Bax 表达明显升高(P <0.05),Bcl-2表达明显降低(P <0.05),并随剂量增加进一步升降(P<0.05)。

Tab.6 Effect of RWE and RTA on positive expression of Bax and Bcl-2 in spermatogenic cells

Fig.1 Effect of RWE and RTA on morphology in testis in adult rats(HE ×100).A:normal control group;B-D:RWE 0.3,0.6 and 1.2 g·kg-1groups;E:RTA 0.1 g·kg-1group.Arrows show the lose of cell layer.
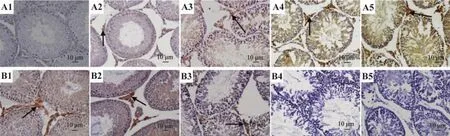
Fig.2 Effect of RWE and RTA on Bax(A1-A5)and Bcl-2(B1-B5)expression in spermatogenic cells of rats(SP ×200).1:normal control group;2-4:RWE 0.3,0.6 and 1.2 g·kg-1group;5:RTA 0.1 g·kg-1group.Arrows show the positive expression product.
3 讨论
大黄为中医临床常用药,由于近年来不适当的使用,使其不良反应的发生率明显增高,关于大黄不良反应的相关报道主要集中于:①消化系统,可引起消化道刺激反应,如恶心、呕吐、胃肠绞痛等。②使用不当,过量服用可引起机体大量脱水,体内电解质平衡破坏,严重者甚至引起虚脱。③对肝肾的毒性,以大黄素和蒽醌长期超大剂量使用动物可能产生一定肝、肾和膀胱毒性。文献报道,连续口服大黄制剂14周以上(大黄素:小鼠29 mg·kg-1,大鼠22 mg·kg-1;蒽醌:小鼠 250 mg·kg-1,大鼠135 mg·kg-1),可致肝肿大、肾小管透明小滴生成和肾矿化、膀胱细胞浆改变等[10]。④ 致癌作用,以大黄素和蒽醌长期超大剂量饲喂动物可能会增加靶器官细胞癌变的潜在危险,但其致癌性尚无明确结论。有报道连续口服大黄制剂2年以上(大黄素:小鼠10 mg·kg-1,大 鼠 5.6 mg·kg-1;蒽 醌:小 鼠90 mg·kg-1,大鼠 33 mg·kg-1),可使肝细胞瘤和肾小管腺瘤发生率增加[11-12]。⑤ 继发性便秘。⑥ 生殖毒性,大黄可致雌性大鼠成熟期明显减缓,子宫卵巢质量减轻;小鼠及金黄地鼠睾丸生精小管上皮细胞层有断脱,金黄地鼠和大鼠的性器官皆有萎缩;未成年大鼠卵巢萎缩,阴户延期甚至长期不能洞开[4-5]。本研究说明大黄对成年雄性大鼠睾丸功能有较强的毒性,其毒性反应程度有明显的剂量依赖关系。
睾丸是雄性生殖系统的重要组成部分,其中生殖小管占睾丸体积的80%[13]。在生精小管管壁中,各种不同发育阶段的生精细胞是按顺次排列的,分别为精原细胞、初级精母细胞、次级精母细胞、精子细胞、分化中的精子,直至成熟精子脱离支持细胞(Sertoli细胞)进入管腔,在附睾内精子进一步成熟并获得运动能力[14]。其功能包括产生成熟的精子和合成并分泌雄性激素。因此,睾丸形态正常是维持睾丸功能正常的基础。本实验HE染色结果表明,睾丸细胞间质和生精上皮明显损伤,可能是导致大鼠生殖功能损伤的重要原因。
睾酮是C-19类固醇激素,对促进精子的生成和刺激生殖器官的发育等有重要的作用。睾丸间质细胞的功能主要是合成和分泌睾酮,分泌的睾酮约占血浆睾酮的95%。间质细胞的睾酮分泌有基础分泌和促性腺激素诱导的分泌两种形式,后者受下丘脑-垂体-性腺轴调节。
睾丸生殖细胞的凋亡和细胞的增殖分化受到多种基因的控制。Bcl-2基因家族是细胞凋亡的重要调控基因,其中以Bcl-2作为细胞生存基因的代表,而Bax作为细胞死亡基因的代表,二者表达水平间的平衡结果决定了细胞是生存还是死亡[15]。近年来的研究提示Bcl-2和Bax这两种基因均参与了生精细胞凋亡的过程[16-17]。
本研究结果显示,给药组大鼠血清睾酮含量显著下降,LH和FSH含量显著升高。Bax在睾丸间质细胞、支持细胞和精母细胞中有表达,其中间质细胞表达最为明显。提示大黄的生殖毒性机制可能是损伤了间质细胞和支持细胞使睾酮合成酶和能量代谢酶活性下降,因而使睾酮合成减少,血清睾酮水平下降,促使LH升高。血中FSH升高主要是由于睾酮的下降通过下丘脑-垂体-睾丸轴的调节代偿性增高,致血清中性激素的水平异常,从而影响睾丸的生精过程。
本实验研究表明,ig给予大黄提取物30 d对成年大鼠睾丸有明显的毒性作用,其作用靶点在睾丸的间质细胞,其毒性的主要成分及机制有待进一步研究。
[1]The People's Republic of China Pharmacopoeia Committee of Ministry of Health.Pharmacopoeia of the People's Republic of China(中华人民共和国药典)[M].Beijing:Chemical Industry Press,2005:17-18.
[2]Xu X,Li BP,Zhang HF.Advancement of the study on rhubarb[J].Shanghai J Tradit Chin Med(上海中医药杂志),2003,37(4):56-59.
[3]Zhang Z,Fang JA,Ye RG.Traditional Chinese medicine kidney protection and renal toxicity[J].Chin J Integr Tradti Western Nephrol(中国中西医结合肾病杂志),2001,2(9):552-526.
[4]Miao MS,Wang C.Traditional Chinese medicine on the reproductive system toxicity study[J].Lishizhen Med Materia Med Res(时珍国医国药),2008,19(2):284-285.
[5]Shen PS.Adverse Reactions of Traditional Chinese Medicine and Clinical(中药不良反应临床)[M].Shanghai:the Second Military Medical University Press,2007:275.
[6]Wang HJ. Different age rats on rhubarb tolerance differences and the significance of rational drug use in Department of Pediatrics[D].Beijing:Beijing University of Traditional Chinese Medicine,2009:1-3.
[7]Ma QN.Practical Andrology(实用男性学)[M].Tianjin:Tianjin Science and Technology Press,1988:53.
[8]Wang XR.Toxicology Foundation(毒理学基础)[M].4th ed.Beijing:People's Medical Press,2003:119.
[9]Chen YP,Mou CM,Ji DR,Dan L,Gong WT,Wang LS.Effect of Shenfu parenteral injection on Bcl-2,Bax and c-fos proteins expression in rat ischemia-reperfusion myocardium[J].Acta Acad Med Mil Tert(第三军医大学学报),2006,28(19):1939-1941.
[10]Wells JM,Cole RJ,Kirksey JW.Emodin,a toxic metabolite of Aspergillus wentii isolated from weevil-damaged chestnuts[J].Appl Microbiol,1975,30(1):26-28.
[11]You T,Yang J,Lu JY.Toxic effect of rhubarb overdose on mouse hepatocytes[J].Chin J Histochem Cytochem(中国组织化学与细胞化学杂志),2008,17(3):303-307.
[12]Müller SO,Eckert I,Lutz WK,Stopper H.Genotoxicity of the laxative drug components emodin,aloe-emodin and danthron in mammalian cells:topoisomeraseⅡmediated?[J].Mutat Res,1996,371(3-4):165-173.
[13]Wang QS, Qi LL, Ma T, Li Y,Shi XQ,Cui ZY.Effect of bilateral gradeⅠvaricocele on testicular volume and sexual hormone in infertile men[J].Chin J Androl(中国男科学杂志),2010,24(2):48-50.
[14]Li J,Huang D,He LQ.Kidney Department of Shuguang Affiltiated Hospital to research progress on the damage to male reproductive ability caused by GTW[J].Liaoning J Tradit Chin Med(辽宁中医杂志),2010,37(8):1626-1629.
[15]Yang XZ,Chen YX,Wang ZX,She RP.Gene in male germ cells apoptosis:research progress[J].China Anim Husbandry Vet Med(中国畜牧兽医),2004,31:24-27.
[16]Saikumar P,Dong Z,Weinberg JM,Venkatachalam MA.Mechanisms of cell death in hypoxia/reoxygenation injury[J].Oncogene,1998,17(25):3341-3349.
[17]Yang J,Liu X,Bhalla K,Kim CN,Ibrado AM,Cai J,et al.Prevention of apoptosis by Bcl-2:release of cytochrome c from mitochondria blocked[J].Science,1997,275(5303):1129-1132.

