肿瘤干细胞理论及肿瘤干细胞分离和鉴定研究进展
宋东颖,王 毅,孙 岚,张英鸽
(1.军事医学科学院毒物药物研究所纳米药理毒理重点实验室,北京 100850;2.吉林大学药学院,吉林 长春 130021)
肿瘤干细胞是指肿瘤中具有无限自我更新能力并能产生出异质性肿瘤细胞的细胞。研究发现,这类细胞与肿瘤的生长、转移和复发具有密切联系[1-2]。这类细胞的很多性质与干细胞类似,因此将其称为肿瘤干细胞。
目前,临床肿瘤治疗中的主要难题就是转移和复发。传统肿瘤学理论认为,所有的肿瘤细胞都具有无限增殖的能力,因此,临床上主要是通过手术、放疗和化疗对整个实体肿瘤病灶进行杀伤,然而这些治疗方法不能有效地杀死癌症病灶,特别是对转移病灶治疗效果更是有限。并且很多患者在结束治疗后会出现肿瘤复发现象,复发后的肿瘤对于化疗或放疗具有极强的耐受性,传统肿瘤学理论无法合理解释肿瘤的产生、转移和复发现象。随着实体肿瘤研究的深入展开,研究人员发现肿瘤组织中存在干细胞样的肿瘤细胞,即肿瘤干细胞,肿瘤干细胞理论随之诞生。
1 肿瘤干细胞的发现
早在20世纪50年代,Hewitt等[3]在进行肿瘤细胞的自体/异体移植实验时发现,将白血病小鼠的肿瘤细胞移植到同种小鼠体内后,仅有0.1% ~1%的少部分细胞形成克隆集落。对此研究人员提出两种不同的理论来解释这一发现:一种理论认为出现这种现象的原因是由于肿瘤细胞具有同质性,即每一个肿瘤细胞都具有新生肿瘤的潜力,但是能进入细胞分化周期的肿瘤细胞很少,是一个小概率随机事件,这就是肿瘤的随机化理论;另一种理论就是分层理论,即肿瘤细胞具有功能异质性,只有有限数目的肿瘤细胞具有产生肿瘤的能力,并且这些肿瘤细胞再生肿瘤是高频事件,而这一理论逐渐被更多的研究人员所接受。这类具有非常高的增殖能力、分化能力和致瘤能力的细胞也成为了研究的重点。
1977年,Hamburger等[4-5]在骨髓瘤等细胞的体外软琼脂克隆形成实验中发现,只有不到0.2%的骨髓瘤细胞才能形成克隆,不到4%的细胞才能在非肥胖糖尿病/重症联合免疫缺陷(nonobesediabetic/severe combined immunodeficient,NOD/SCID)小鼠脾内形成肿瘤,并提出了通过杀伤此类细胞而达到治愈肿瘤的设想。此后,多个研究组在肺小细胞癌、神经胶质瘤、黑色素瘤等肿瘤的研究中也发现了类似的现象。有人将这些小量的具有成瘤能力的细胞称之为“肿瘤干细胞”,也提出通过杀伤肿瘤干细胞有可能达到治愈肿瘤的目的,“肿瘤干细胞假说”逐渐受到了研究人员们的关注。1997年,Bonnet等[6]研究人类急性粒细胞白血病时,首次成功分离出了表型为CD34+和CD38-的白血病肿瘤干细胞,并发现此类细胞与普通肿瘤细胞相比具有很高的体内成瘤能力,从而证实了肿瘤干细胞的存在。随后在其他多种肿瘤组织和肿瘤细胞系中也证实了肿瘤干细胞的存在[7-8]。
2 肿瘤干细胞与肿瘤的发生
肿瘤干细胞理论认为,发生肿瘤的根源就是机体组织中形成了肿瘤干细胞,而肿瘤干细胞的来源有三个途径:①正常组织中原有的干细胞由于突变因素的积累,发生突变而产生;②组织中含有的祖细胞发生基因重排,从新获得与干细胞类似的表型和特性,形成肿瘤干细胞;③骨髓来源的干细胞发生突变产生[9]。而这些突变一般发生于某些信号通路中的关键蛋白,这些信号通路在干细胞增殖和更新过程中发挥重要作用,例如Wnt通路、Notch通路等。
2.1 Wnt通路
Wnt信号通路是一类广泛作用于动物生长发育过程的信号通路,对细胞增殖、分化、迁移过程以及干细胞池的维持和不对称分裂等方面起着重要的作用,并且可以决定细胞的极性、命运,在成年期则主要参与机体内平衡的稳定。
该通路中有两个关键蛋白:Wnt蛋白和β联蛋白。Wnt蛋白是细胞内一类分泌型糖蛋白,是此通路的起始蛋白,它能与胞膜上的卷曲蛋白受体家族和低密度脂蛋白受体相关蛋白(LDL-receptor-related protein,LRP)中的LRP-5和LRP-6结合。β联蛋白是该通路发挥效应的关键蛋白。正常状态下,由酪蛋白激酶1α、糖原合成酶激酶-3β、抑癌因子APC和轴蛋白(axin)组成的β联蛋白降解复合体可与β联蛋白结合,使胞内β联蛋白含量维持在一个较低水平。
在正常细胞中WNT抑制因子-1(Wnt inhibitory factor-1,WIF-1),Cerberus和分泌型卷曲蛋白相关蛋白家族(如FrzB)竞争性地抑制Wnt蛋白与卷曲蛋白受体结合,而Dickokpf家族(如DKK-1和DKK-2)通过间接减少可利用的辅助受体LRP的数量来抑制Wnt蛋白与LRP-5,LRP-6等受体结合。如果此抑制过程中的某些蛋白发生突变,Wnt蛋白可与相应受体发生结合,从而活化Wnt信号使细胞内散乱蛋白激活。活化的散乱蛋白能使β联蛋白降解复合体发生解离,β联蛋白从而可以在细胞质内发生积聚,最后进入细胞核启动靶基因过度转录表达,其靶基因包括原癌基因c-myc、周期蛋白D1、基质溶解酶、成纤维细胞生长因子、上皮细胞生长因子和存活蛋白等,而这些表达产物均有助于肿瘤的发生和迁移。研究发现,大部分胃肠道癌症均是由Wnt通路突变引起的,其中β联蛋白降解复合体中的APC是最常见的突变位点,该通路的突变最终引起β联蛋白调节的靶基因过度表达而引起肿瘤的发生[10]。进一步研究表明,在白血病和乳腺癌等多种肿瘤干细胞发生早期均伴有Wnt通路的突变或调节异常,而且Wnt信号通路在肿瘤干细胞的稳定和自我更新过程中发挥着重要作用[11-13]。
2.2 Notch 通路
Notch通路在脊椎动物和无脊椎动物的发育过程中,对细胞生长、发育和凋亡、命运的决定、神经系统的发育、器官的形成等生理过程具有重大意义,并且证实在肿瘤细胞中也起着重要作用。
Notch受体是细胞中广泛存在的一类高度保守的受体蛋白。该受体在细胞中首先以单体蛋白的形式合成,经高尔基体的修饰后转移到细胞表面,最后经过原蛋白转化酶切割与Lin-12/Notch重复蛋白(Lin-12/Notch repeats,LNR)在跨膜区形成异二聚体,形成成熟的Notch受体。当成熟的Notch受体与相邻细胞的Notch配体发生作用后,受体通过先后两次裂解,释放出活化的Notch受体胞内区(Notch intracellular domain,NICD)进入细胞质中。通过细胞内吞作用和膜泡运输,NICD经过核孔进入细胞核,首先与DNA转录抑制因子CSL结合形成短期的核转录异二聚体复合物,接着与转录辅助激活蛋白MAML结合形成三聚体,MAML能募集组蛋白乙酰转移酶等乙酰化组蛋白的因子,最终三聚体成为转录激活因子诱导其下游靶基因的表达。
研究发现,Notch信号通路由于所处环境的不同,在不同癌细胞中起着不同的作用,即该通路发挥作用具有环境依赖性。该通路根据被激活Notch受体种类、被激活受体量的不同、细胞种类的不同、细胞所处微环境的不同、通路与其他通路所处关系的不同,既有可能促进癌细胞增殖和迁移的作用,也可能抑制癌细胞的作用[14]。
3 肿瘤干细胞的特性
肿瘤干细胞顾名思义既具有肿瘤细胞的特性,同时也具有正常干细胞的某些特性,具体有如下基本特性。
(1)肿瘤干细胞不是处于分化途径的终端,而是保持未分化的状态,具有无限增殖能力和分化潜能。肿瘤的发生是一个长期的突变积累过程,在皮肤及肠黏膜上皮等肿瘤的高发部位,衰老细胞不断地死去并脱离机体,只有干细胞是唯一可以长期存在的细胞,有可能积累多次突变而生成肿瘤干细胞,进而最终形成肿瘤[15]。
(2)肿瘤干细胞在肿瘤细胞当中所占的比例非常小,它主要通过两种方式分裂:一种是对称分裂,即形成两个相同的肿瘤干细胞或两个相同的分化肿瘤细胞;另一种是非对称分裂,即肿瘤干细胞分裂后形成的两个细胞中有一个细胞不可逆地走向分化的终端成为功能专一的分化肿瘤细胞,而另一个保持亲代的特征,仍作为肿瘤干细胞保留下来[16]。由于这种类似于干细胞的分裂方式,低密度的肿瘤干细胞能在维持自身数量的同时产生出分化的肿瘤细胞。
(3)肿瘤干细胞具有高端粒酶活性以及扩增的端粒重复序列,高活性的端粒酶可抑制细胞增殖过程中端粒长度的缩短,延长肿瘤干细胞的增殖寿命,这为肿瘤干细胞的不断增殖和分化提供了基础条件[15]。
(4)肿瘤干细胞内抗凋亡家族蛋白过表达。研究发现,大部分肿瘤干细胞中抗凋亡基因Bcl-2的表达量显著增加,从而启动肿瘤干细胞内抗凋亡程序,阻断Bid和Bad等促凋亡蛋白引起的线粒体凋亡途径,并进一步阻断胱天蛋白酶凋亡途径,防止肿瘤干细胞发生凋亡[17]。
(5)肿瘤干细胞的DNA修复能力显著增强。研究发现,肿瘤干细胞内与DNA损伤修复相关的核酸内切酶、DNA聚合酶和DNA连接酶等酶蛋白的合成增加、活性增强,增强了肿瘤干细胞的抗DNA损伤能力,使得肿瘤干细胞可逃避以DNA损伤为主的肿瘤治疗手段[18]。
(6)肿瘤干细胞除在连续分裂的一段时间外,其余较长时间均是处在G0期,即相对静止状态。而现在临床上普遍使用的化疗药物主要是针对增殖旺盛的肿瘤细胞进行杀伤,处在G0期的大多数肿瘤干细胞能逃避传统肿瘤治疗方法的杀伤,一旦时机成熟或停止用药,它们便成为复发的根源[19]。
(7)肿瘤干细胞通常位于由发育良好的三维细胞外基质包裹的低氧环境中,这些细胞外基质起到很好的屏障作用,尽可能避免了肿瘤干细胞接触到抗肿瘤药物。同时由于射线引起的DNA损伤需要氧气,所以肿瘤干细胞所处的低氧环境使得放疗对肿瘤干细胞的杀伤作用也非常局限[20-21]。
(8)肿瘤干细胞能够表达与某些干细胞相同的特殊功能蛋白或特异性表面标志,如CD133,CD90和CD44等。这些特异性蛋白或标志物在肿瘤干细胞的增殖、肿瘤干细胞分化成肿瘤组织周围所必须的血管等组织、肿瘤干细胞的迁移等过程中发挥至关重要的作用。利用这些特异性的表面标志物达到肿瘤干细胞分离或鉴定的目的。
(9)肿瘤干细胞在形成和发展过程中,生物学特征和功能均会有适当的改变。如正常干细胞由于周围微环境的改变或其他突变因素的刺激形成癌前期干细胞,癌前期干细胞能表达OCT3/4,SOX2和KLF4等,能促进干细胞自我更新能力和多向分化能力[22]。突变进一步积累癌前期干细胞逐渐转变为原癌肿瘤干细胞,不断分化形成肿瘤细胞和肿瘤周围血管从而最终形成肿瘤。另有研究表明,并非所有原癌肿瘤干细胞都能转移,Hermann等[23]在研究胰腺癌的时候发现,CD133+/CXCR4+和CD133+/CXCR4-都具有异种动物连续成瘤能力,即均为胰腺癌肿瘤干细胞,具有无限自我更新能力和分化潜能。但是只有CD133+/CXCR4+的肿瘤干细胞才能引起胰腺癌的转移,而CD133+/CXCR4-的肿瘤干细胞则不会导致胰腺癌的转移。说明在肿瘤发生、生长和迁移等不同过程中肿瘤干细胞的特性和功能也不断发生着改变,从而有利于肿瘤生长、转移和躲避治疗。
4 肿瘤干细胞的分离纯化
肿瘤干细胞的研究可能会在根治肿瘤和解决肿瘤的复发等问题上发挥重要作用。然而在肿瘤组织或细胞中肿瘤干细胞所占比例非常小,一般只占到总细胞数的0.01% ~2%,使得肿瘤干细胞的分离比较困难。目前常用如下几种肿瘤干细胞分离方法。
4.1 利用肿瘤干细胞表面的特异性标志物进行分离
通过将肿瘤干细胞表面特异性标志物与相应的单克隆抗体或荧光素标记物结合,再应用一些分离技术手段将肿瘤干细胞分离、筛选出来的方法。可分为磁性活化细胞分离法和荧光活化细胞技术分离法两种。
4.1.1 磁性活化细胞分离法(免疫磁珠分选法,magnetic activated cell sorting,MACS)
MACS是基于肿瘤干细胞表面特异性抗原能与连接有磁珠的特异性单克隆抗体相结合,之后在外部磁场的作用下,连接有单克隆抗体磁珠的肿瘤干细胞停留在磁场中,而无特异性表面抗原的肿瘤细胞则不能与免疫磁珠结合,因而不能在磁场中停留,从而得以分离出肿瘤干细胞。
MACS是目前比较常用的分离肿瘤干细胞的技术手段,特别是在胶质瘤干细胞的分离上应用较多。2008年,董强刚等[24]利用该方法从人肺腺癌细胞株A549和SPC-A1中成功分离出表型为CD24+/IGF-1R+的肺腺癌干细胞。MACS对设备要求相对较抵,所获得的目的细胞纯度高(纯度一般可达到90%以上),且对细胞损伤小,不影响细胞活性和功能。
4.1.2 荧光活化细胞分选法(流式细胞分选法,fluorescence-activated cell sorting,FACS)
FACS是通过将待分选的肿瘤细胞和肿瘤干细胞用同一种或多种荧光素标记的特异性抗体标记,根据肿瘤干细胞与肿瘤细胞结合荧光素标记抗体能力的差异,通过流式细胞仪将肿瘤干细胞分选出来的方法。
第一位从人类急性粒细胞白血病的研究中分离出白血病干细胞的Bonnet等[6]就是通过FACS获得白血病干细胞的。FACS技术是目前应用最为广泛的肿瘤干细胞分离方法,具有特异性和敏感性均非常强的特点,但由于成本、设备和技术要求较高,且容易对细胞造成损伤,因此限制了该方法在国内的广泛应用。
4.2 根据生物学特性分离肿瘤干细胞
根据肿瘤干细胞具有的某些生物学特性将肿瘤干细胞分离筛选出的方法。如可以通过细胞核对核染料的拒染性质、肿瘤干细胞体外培养所需的特殊条件等特性,分离出肿瘤干细胞。
4.2.1 旁群细胞(side population,SP)分选法
肿瘤干细胞具有对核染料Hoechst 33342拒染的特性,研究人员针对这一特性而建立了SP分选法,经研究证实,这些分离出的旁群细胞具有肿瘤干细胞样性质[25]。
Hoechst 33342是一种核酸染料,在紫外光激发下可发出蓝色荧光(波长450 nm左右)和红色荧光(波长650 nm左右),肿瘤干细胞可将染料外排,而不发出荧光,从而可将这类旁群细胞分离出来。
Kondo等[26]证明大多数肿瘤细胞系中存在旁群细胞,并在C6神经胶质瘤、MCF-7乳腺癌、B104成神经细胞瘤和HeLa肿瘤细胞系中成功分离出旁群细胞亚群,且这些旁群细胞具有与肿瘤干细胞相同的表面标志物,多向分化和少量成瘤的特性,从而证实旁群细胞是适用于肿瘤干细胞分离的一种方法。经进一步研究发现干细胞标志物ABCG2高表达的细胞可高效外排Hoechst 33342,从而用流式细胞仪分选出对Hoechst 33342拒染的SP细胞,旁群细胞分选法对于仍未有表面标志物研究的肿瘤干细胞的分离具有非常重要的意义。
4.2.2 无血清培养基(serum-free medium,SFM)分选法
研究人员发现,在合成培养基的基础上,引入特定的生长因子和细胞添加剂,使绝大多数肿瘤细胞由于缺乏生长所必须的血清成分而停止生长,经长时间培养后最终死亡,而肿瘤干细胞则可以在含特定生长因子和添加剂的无血清培养基中呈球状悬浮生长,经几代的培养增殖形成富含肿瘤干细胞的肿瘤细胞球,这种肿瘤干细胞的分离方法就是SFM分选法。
2003 年,Hemmati等[27]和 Singh 等[28]通过无血清培养的方法从脑胶质瘤和成髓细胞瘤等脑肿瘤细胞中成功分离培养出了脑肿瘤细胞球,后被证实为脑肿瘤干细胞。
经过证实可以在含有 B27(1∶50)、EGF(20 ng·ml-1)、bFGF(10 ng·ml-1)的DMEM/F12(1∶1)无血清培养基中培养对数生长期的HCT-116细胞系,可以培养分离出结肠癌干细胞球。这种方法具有操作简便,对设备要求较低等优点,但获得的肿瘤干细胞纯度较低,应根据实验需要进行进一步纯化。
4.3 联合运用多种方法分离肿瘤干细胞
在目前的研究中,肿瘤干细胞的分离并不是采用单一的方法,而是选用两种或者两种以上的分离方法,以获得数量更多、纯度更高的肿瘤干细胞。如只运用FACS技术时,虽然能分离出肿瘤干细胞,但是其数量不是很多,不易扩大培养,而单采用SFM分离法时,虽然经过几代的培养能够获得较多肿瘤细胞球,但其周期长,且其中会含有非肿瘤干细胞,因此,其纯度就无法得到研究的要求。因此,可以通过无血清培养法,将肿瘤干细胞培养至一定数量之后,再利用FACS技术或MACS技术对所获得的肿瘤干细胞进行进一步的分离和筛选,这样所获得的肿瘤干细胞在数量和纯度上均能满足进一步的实验要求。
5 肿瘤干细胞的鉴定
肿瘤干细胞与普通肿瘤细胞之间虽有区别,但也具有很大的相似性,因此,分离出来的肿瘤干细胞必须经过鉴定才能确认。
5.1 利用肿瘤干细胞特异性表面标志物进行鉴定
目前,肿瘤干细胞最为广泛且可靠的鉴定方法就是利用肿瘤干细胞特异性表面标志物。将分离出的肿瘤干细胞通过免疫组织化学法、流式细胞检测技术等方法测定阳性或阴性细胞表面标志物表达情况,进而鉴定是否是肿瘤干细胞。因此,科学地探寻肿瘤干细胞表面标志物对于肿瘤干细胞的分离和鉴定十分重要,确定肿瘤干细胞表面标志物的一般原则为结合谱系标志、正常干细胞的特异标志和正常组织特异性标志等的综合评价。表1为几种已鉴定出的肿瘤干细胞特异性表面标志物。
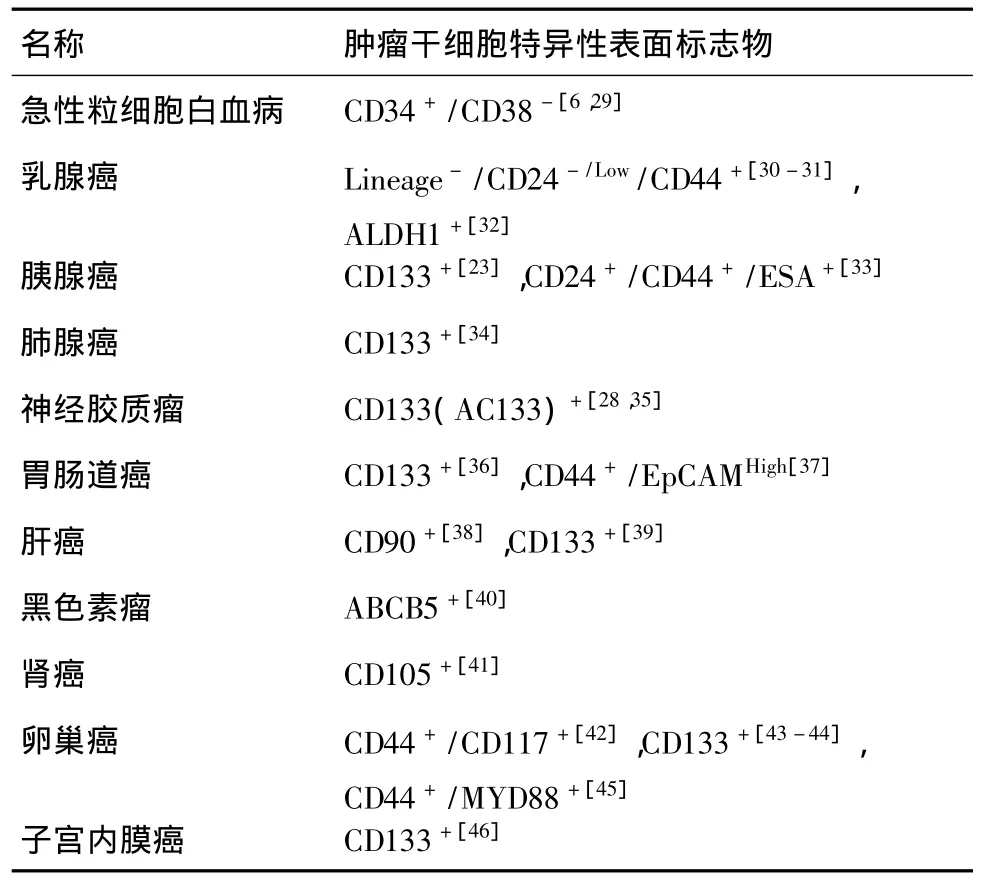
表1 肿瘤干细胞特异性表面标志物
5.2 异种移植成瘤性实验鉴定肿瘤干细胞
将分离出的肿瘤干细胞,制备成细胞悬液后种植到异种动物体内,如将人的肿瘤干细胞接种于NOD/SCID小鼠体内,观察其能否形成肿瘤病灶,且异种动物体内形成的肿瘤病灶在组织学结构上与原发肿瘤病灶类似,则可鉴定为肿瘤干细胞。一般来说,肿瘤干细胞形成肿瘤病灶所需的细胞密度比普通肿瘤细胞要小,如普通的肿瘤细胞接种密度必须达到1×109~1×1010L-1才能形成肿瘤,而肿瘤干细胞根据其纯度接种密度达到1×106~1×109L-1即可形成肿瘤。从形成的肿瘤病灶中提取肿瘤干细胞,再次种植到免疫缺陷动物体内后,仍可以形成肿瘤病灶,这种连续的异种动物致瘤能力说明这类细胞具有稳定的自我更新能力和致瘤能力,从而可进一步鉴定为肿瘤干细胞的。这些现象也证明了肿瘤干细胞在肿瘤的形成和增殖过程中发挥的重要作用。肿瘤干细胞在异种动物体内的连续成瘤实验是鉴定肿瘤干细胞最为可靠的鉴定方法。
5.3 肿瘤干细胞的其他鉴定方法
对于肿瘤干细胞的鉴定,还可通过肿瘤干细胞具有的类干细胞特性进行鉴定。如根据肿瘤干细胞核对核染料拒染(如Hoechst 33342染料)的性质进行鉴定[25]、根据肿瘤干细胞长期处于静止状态的特性,应用溴脱氧尿嘧啶核苷法进行鉴定[47]和软琼脂克隆形成实验鉴定[4-5]等方法。
6 肿瘤干细胞研究前景
虽然经过深入研究对肿瘤干细胞有了更深的认识,但在研究中也仍面临着不少难题:①虽然已成功分离出了几种类型的肿瘤干细胞,但其分离和鉴定方法尚不完善,分离效率比较低;②多数肿瘤干细胞的特异性表面标志物还不是很清楚,肿瘤干细胞的分离鉴定还是仅限于少数几种肿瘤细胞;③肿瘤干细胞的离体研究忽略了肿瘤干细胞与肿瘤组织周围环境间的相互影响;④分离出的肿瘤干细胞在体外培养条件下,容易分化成肿瘤细胞,如何保持肿瘤干细胞的干细胞样特性也是研究人员面临的问题;⑤ 在肿瘤干细胞培养中长期使用蛋白水解酶可能影响细胞表面分子的表达,影响进一步的研究。
肿瘤干细胞理论仍然存在不少的争议和研究难点,但该理论的提出不仅丰富了传统的肿瘤理论,还给研究肿瘤发生机制和治疗策略的人们提供了新的思路和研究途径,提示治疗肿瘤时不能只杀伤肿瘤细胞,而是应该同时采取相应的治疗手段杀伤肿瘤干细胞,从而达到根治肿瘤的目的。并且有望阐明肿瘤的发病和生长增殖机制,尤其在研究肿瘤的转移和恶性复发等问题有望发挥重大作用。
肿瘤干细胞分离和鉴定方法的不断发展是这一理论走向应用过程中迈出的第一步。在这一基础上,对肿瘤干细胞的进一步研究(包括肿瘤干细胞的生物学特征、寻找肿瘤干细胞特异性表面标志物、肿瘤干细胞形成或自我更新等生理过程中的关键蛋白等)不仅有助于实现肿瘤的早期诊断,还可通过将肿瘤干细胞特异性表面标志物、增殖过程中所必须的酶类、细胞自我更新过程中的主要信号通路蛋白、细胞周期调控蛋白、miRNAs等作为靶标设计出能抑制和杀伤肿瘤干细胞的治疗手段,从而最终达到根治肿瘤的目的。
[1]Dick JE.Stem cell concepts renew cancer research[J].Blood,2008,112(13):4793-4807.
[2]Vries RG,Huch M,Clevers H.Stem cells and cancer of the stomach and intestine[J].Mol Oncol,2010,4(5):373-384.
[3]Hewitt HB. Studiesof the dissemination and quantitative transplantation of a lymphocytic leukaemia of CBA mice[J].Br J Cancer,1958,12(3):378-401.
[4]Hamburger A,Salmon SE.Primary bioassay of human myeloma stem cells[J].J Clin Invest,1977,60(4):846-854.
[5]Hamburger AW,Salmon SE.Primary bioassay of human tumor stem cells[J].Science,1977,197(4302):461-463.
[6]Bonnet D,Dick JE.Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell[J].Nat Med,1997,3(7):730-737.
[7]Jordan CT. Cancerstem cell biology:from leukemia to solid tumors[J].Curr Opin Cell Biol,2004,16(6):708-712.
[8]Setoguchi T,Taga T,Kondo T.Cancer stem cells persist in many cancer cell lines[J].Cell Cycle,2004,3(4):414-415.
[9]Davies EJ,Marsh V,Clarke AR.Origin and maintenance of the intestinal cancer stem cell[J].Mol Carcinog,2011,50(4):254-263.
[10]Boman BM,Huang E.Human colon cancer stem cells:a new paradigm in gastrointestinal oncology[J].J Clin Oncol,2008,26(17):2828-2838.
[11]Korkaya H,Paulson A,Charafe-Jauffret E,Ginestier C,Brown M,Dutcher J,et al.Regulation of mammary stem/progenitor cells by PTEN/Akt/beta-catenin signaling[J].PLoS Biol,2009,7(6):e1000121.
[12]Abrahamsson AE, Geron I, Gotlib J,Dao KH,Barroga CF,Newton IG,et al.Glycogen synthase kinase 3beta missplicing contributes to leukemia stem cell generation[J].Proc Natl Acad Sci USA,2009,106(10):3925-3929.
[13]Wang Y,Krivtsov AV,Sinha AU,North TE,Goessling W,Feng Z,et al.The Wnt/beta-catenin pathway is required for the development of leukemia stem cells in AML[J].Science,2010,327(5973):1650-1653.
[14]Sun LZ,Hou L.Structure,Function and related signaling pathway of Notch[J].Chin J Cell Biol(中国细胞生物学学报),2010,32(6):914-921.
[15]Todaro M,Francipane MG,Medema JP,Stassi G.Colon cancer stem cells:promise of targeted therapy[J].Gastroenterology,2010,138(6):2151-2162.
[16]Shackleton M.Normal stem cells and cancer stem cells:similar and different[J].Semin Cancer Biol,2010,20(2):85-92.
[17]Kruyt FA,Schuringa JJ.Apoptosis and cancer stem cells:implications for apoptosis targeted therapy[J].Biochem Pharmacol,2010,80(4):423-430.
[18]Karran P.Mechanisms of tolerance to DNA damaging therapeutic drugs[J].Carcinogenesis,2001,22(12):1931-1937.
[19]Giuffrida D,Rogers IM.Targeting cancer stem cell lines as a new treatment of human cancer[J].Recent Pat Anticancer Drug Discov,2010,5(3):205-218.
[20]Green SK,Frankel A,Kerbel RS.Adhesion-dependent multicellular drug resistance[J].Anticancer Drug Des,1999,14(2):153-168.
[21]Brown JM,Wilson WR.Exploiting tumour hypoxia in cancer treatment[J].Nat Rev Cancer,2004,4(6):437-447.
[22]Bae KM,Su Z,Frye C,McClellan S,Allan RW,Andrejewski JT,et al.Expression of pluripotent stem cell reprogramming factors by prostate tumor initiating cells[J].J Urol,2010,183(5):2045-2053.
[23]Hermann PC,Huber SL,Herrler T,Aicher A,Ellwart JW,Guba M,et al.Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer[J].Cell Stem Cell,2007,1(3):313-323.
[24]Dong QG,Yao M,Geng Q,Zhou J,Yan MX.Isolation and idenfification of human lung adenocarcinoma stem cells[J].Tumor,2008,28(1):1-7.
[25]Wang R,Jiang JT,Yang YiL,Wu CP.Isolation and purification of tumor stem cells[J].J Clin Rehabilitative Tissue Eng Res,2009,13(7):161-164.
[26]Kondo T,Setoguchi T,Taga T.Persistence of a small subpopulation of cancer stem-like cells in the C6 glioma cell line[J].Proc Natl Acad Sci USA,2004,101(3):781-786.
[27]Hemmati HD,Nakano I,Lazareff JA,Masterman-Smith M,Geschwind DH,Bronner-Fraser M,et al.Cancerous stem cells can arise from pediatric brain tumors[J].Proc Natl Acad Sci USA,2003,100(25):15178-15183.
[28]Singh SK,Clarke ID,Terasaki M,Bonn VE,Hawkins C,Squire J,et al.Identification of a cancer stem cell in human brain tumors[J].Cancer Res,2003,63(18):5821-5828.
[29]Lapidot T,Sirard C,Vormoor J,Murdoch B,Hoang T,Caceres-Cortes J,et al.A cell initiating human acute myeloid leukaemia after transplantation into SCID mice[J].Nature,1994,367(6464):645-648.
[30]Al-Hajj M, Wicha MS, Benito-Hernandez A, Morrison SJ,Clarke MF.Prospective identification of tumorigenic breast cancer cells[J].Proc Natl Acad Sci USA,2003,100(7):3983-3988.
[31]Winquist RJ,Furey BF,Boucher DM.Cancer stem cells as the relevant biomass for drug discovery[J].Curr Opin Pharmacol,2010,10(4):385-390.
[32]Ginestier C,Hur MH,Charafe-Jauffvet E,Monville F,Dutcher J,Brown M,et al.ALDH1is a marker of normal malignant human mammary stem cells and a predictor of poor clinical outcome[J].Cell Stem Cell,2007,1(5):555-567.
[33]Li C,Heidt DG,Dalerba P,Burant CF,Zhang L,Adsay V,et al.Identification of pancreatic cancer stem cells[J].Cancer Res,2007,67(3):1030-1037.
[34]Eramo A,Lotti F,Sette G,Pilozzi E,Biffoni M,Di Virgilio A,et al.Identification and expansion of the tumorigenic lung cancer stem cell population[J].Cell Death Differ,2008,15(3):504-514.
[35]Kemper K,Sprick MR,de Bree M,Scopelliti A,Vermeulen L,Hoek M,et al.The AC133 epitope,but not the CD133 protein,is lost upon cancer stem cell differentiation[J].Cancer Res,2010,70(2):719-729.
[36]O'Brien CA,Pollett A,Gallinger S,Dick JE.A human colon cancer cell capable of initiating tumour growth in immunodeficient mice[J].Nature,2007,445(7123):106-110.
[37]Han ME,Jeon TY,Hwang SH,Lee YS,Kim HJ,Shim HE,et al.Cancer spheres from gastric cancer patients provide an ideal model system for cancer stem cell research[J].Cell Mol Life Sci,2011,68(21):3589-3605.
[38]Yang ZF,Ho DW,Ng MN,Lau CK,Yu WC,Ngai P,et al.Significance of CD90+cancer stem cells in human liver cancer[J].Cancer Cell,2008,13(2):153-166.
[39]Piao LS,Hur W,Kim TK,Hong SW,Kim SW,Choi JE,et al.CD133+cancer stem cells modulate radioresistance in human hepatocellular carcinoma[J].Cancer Lett,2012,315(2):129-137.
[40]Schatton T,Murphy GF,Frank NY,Yamaura K,Waaga-Gasser AM,Gasser M,et al.Identification of cells initiating human melanomas[J].Nature,2008,451(7176):345-349.
[41]Bussolati B,Bruno S,Grange C,Ferrando U,Camussi G.Identification of a tumor-initiating stem cell population in human renal carcinomas[J].FASEB J,2008,22(10):3696-3705.
[42]Zhang S,Balch C,Chan MW,Lai HC,Matei D,Schilder JM,et al.Identification and characterization of ovarian cancer-initiating cells from primary human tumors[J].Cancer Res,2008,68(11):4311-4320.
[43]Baba T,Convery PA,Matsumura N,Whitaker RS,Kondoh E,Perry T,et al.Epigenetic regulation of CD133 and tumorigenicity of CD133+ovarian cancer cells[J].Oncogene,2009,28(2):209-218.
[44]Curley MD,Therrien VA,Cummings CL,Sergent PA,Koulouris CR,Friel AM,et al.CD133 expression defines a tumor initiating cell population in primary human ovarian cancer[J].Stem Cells,2009,27(12):2875-2883.
[45]Alvero AB,Chen R,Fu HH,Montagna M,Schowortz PE,Rutherford T,et al.Molecular phenotyping of human ovarian cancer stem cells unravels the mechanisms for repair and chemoresistance[J].Cell Cycle,2009,8(1):158-166.
[46]Hubbard SA,Gargett CE.A cancer stem cell origin for human endometrial carcinoma[J]?Reproduction,2010,140(1):23-32.
[47]Zhang HB,Ren CP,Yang XY,Wang L,Li H,Zhao M,et al.Identification of label-retaining cells in nasopharyngeal epithelia and nasopharyngeal carcinoma tissues[J].Histochem Cell Biol,2007,127(3):347-354.

