Binswanger病患者脑白质疏松的磁共振波谱分析*
陕西省人民医院神经内科(西安710068) 郭生龙 张 虹 王秋莲 李 伟 陈 岩 宋允章
Binswanger病属于皮层下血管性痴呆,是血管性认知功能障碍(VCI)的多见类型之一。其主要病理改变是白质的缺氧缺血性脱髓鞘改变,神经影像学显示脑白质萎缩、脑室旁白质疏松伴多发腔隙性梗死。磁共振波谱(MRS)技术是一种无创性观察人体脏器、组织代谢、生化改变以及化合物定量分析的影像学方法。对于认知功能障碍而言,脑内生化物质的改变可能先于认知损害出现。本研究采用MRS技术观察Bins wanger病患者脑白质的生化代谢特点,探讨其能否作为诊断Binswanger病的有效指标。
资料和方法
1 一般资料 ①Binswanger病组:为2007年1月至2010年6月我科就诊的Binswanger病患者61例,男36例,女25例,平均年龄66.51±5.3岁,平均病程 3.5±1.3 年。 符 合 Bennett 等[1]提 出 的Binswanger病的临床诊断标准。所有的患者均存在腔隙性脑梗塞,无大面积脑梗死。排除标准:既往有认知障碍或其他类型痴呆;有甲状腺功能障碍、维生素缺乏;严重皮层萎缩;梅毒、HIV感染等;其他类型白质病变;其他神经系统疾病;严重系统性疾病;长期饮酒史。②脑白质疏松症组:为本院同期体检者。共53例,男33例,女20例,平均年龄63.15±5.26岁。符合郭洪志、屈传强[2-3]提出的脑白质疏松症的诊断标准。MRI提示脑白质疏松,认知功能正常者。③正常对照组:为本院同期体检者。共41例,男23例,女18例,平均年龄61.23±6.25岁。MRI提示正常,且认知功能正常者。3组在性别构成比、年龄等方面无统计学差异(P>0.05)。
2 方 法 ①辅助检查:所有患者进行血常规、血生化、血清维生素B12、血同型半胱氨酸、梅毒和HIV抗体检测、甲状腺功能检测等。②头颅MRI的平扫及二维多体素波谱成像:采用Philips 1.5 T超导型MR扫描仪,相控阵头线圈,行常规颅脑MRI平扫,包括横断及矢状面T1 WI/IR 序列:TR/TE=1594 ms/10 ms,T2 WI/TSE 序列:TR/TE=1875 ms/100 ms,层厚5~6 mm,层间距1 mm,矩阵256×521,FOV23c m。MRS检查:选用点解析波谱序列,选择T2加权像,行二维多体素波谱成像。感兴趣区取侧脑室体旁,尽可能避开脑沟和脑室。经匀场、抑水后,获得波谱谱线。使用机器自带的波谱高级分析软件对谱线进行分析。计算3个峰,即N-乙酰天门冬氨酸(NAA)、肌酸(Cr)及胆碱(Cho)峰的波幅下面积,并计算它们的NAA/Cr、Cho/Cr比值。③脑白质疏松程度的评定:根据MRI T2加权像白质高信号将白质疏松分为4个部位:侧脑室前角、体部、尾部、半卵圆中心;对上述每一部位白质疏松分布的范围进行评分:无白质疏松0分、白质疏松范围<25%为1分、白质疏松范围在25%~50%之间为2分、白质疏松范围>50%为3分;将上述4个部位的白质疏松范围评分相加,为该病人的白质疏松总分,即总分=前角(0~3)+体部(0~3)+尾部(0~3)+半卵圆中心(0~3)=0~12分。轻度白质疏松1~3分,中度白质疏松4~6分,重度白质疏松7分以上。
3 统计学处理 采用SPSS 13.0统计软件进行分析,正态资料表示为,两组间比较用t检验,多组间用方差分析;相关分析采用Spear man’s相关性分析。P<0.05为差异有统计学意义。
结 果
1 Binswanger病组与正常对照组的双侧侧脑室体旁白质MRS表现 见表1。Binswanger病组与正常对照组双侧侧脑室体旁白质的NAA/Cr及Cho/Cr值的比较,显示两组之间NAA/Cr及Cho/Cr值均有统计学差异(P<0.05)。
表1 Binswanger病组与正常对照组双侧侧脑室体旁白质区NAA/Cr及Cho/Cr值比较()
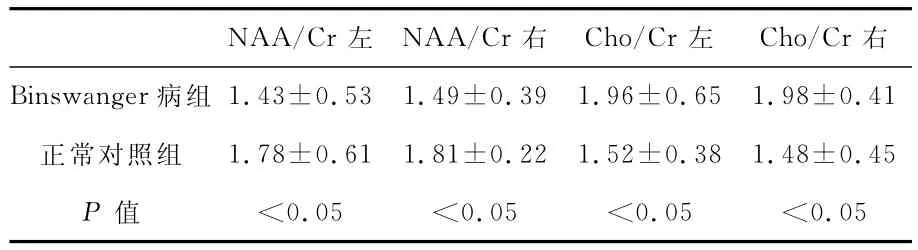
表1 Binswanger病组与正常对照组双侧侧脑室体旁白质区NAA/Cr及Cho/Cr值比较()
NAA/Cr左 NAA/Cr右 Cho/Cr左 Cho/Cr右Binswanger病组 1.43±0.53 1.49±0.39 1.96±0.65 1.98±0.41正常对照组 1.78±0.61 1.81±0.22 1.52±0.38 1.48±0.45 P 值 <0.05 <0.05 <0.05 <0.05
2 Bins wanger病组与脑白质疏松症组的双侧侧脑室体旁白质MRS表现 见表2。Binswanger病组与脑白质疏松症组双侧侧脑室体旁白质的NAA/Cr及Cho/Cr值的比较,显示两组之间NAA/Cr及Cho/Cr值均有统计学差异(P<0.05)。
表2 Bins wanger病组与脑白质疏松症组双侧侧脑室体旁白质区NAA/Cr及Cho/Cr值比较()

表2 Bins wanger病组与脑白质疏松症组双侧侧脑室体旁白质区NAA/Cr及Cho/Cr值比较()
NAA/Cr左 NAA/Cr右 Cho/Cr左 Cho/Cr右Bins wanger病组 1.46±0.53 1.49±0.39 1.96±0.65 1.98±0.41脑白质疏松症组 1.79±0.39 1.76±0.47 1.57±0.62 1.61±0.36 P 值 <0.05 <0.05 <0.05 <0.05
3 脑白质疏松程度与双侧侧脑室体旁白质MRS的关系 见表3。采用单因素方差分析比较不同程度白质疏松之间双侧额叶NAA/Cr及Cho/Cr值,结果显示重度脑白质疏松组Cho/Cr值明显高于轻、中度疏松组,有统计学差异,而其它组间NAA/Cr值均无统计学差异。Speras man’s等级相关分析显示,Cho/Cr值与白质疏松程度呈正相关(P<0.05),即随着白质疏松程度的加重,Cho/Cr值逐渐升高。
表3 脑白质疏松程度与NAA/Cr及Cho/Cr值的相关性()

表3 脑白质疏松程度与NAA/Cr及Cho/Cr值的相关性()
注:与轻度、中度脑白质疏松相比*P<0.05
NAA/Cr左 NAA/Cr右 Cho/Cr左 Cho/Cr右轻度 1.68±0.32 1.65±0.36 1.65±0.41 1.73±0.17中度 1.70±0.56 1.87±0.49 1.89±0.69 1.67±0.25重度 1.23±0.62 1.31±0.32 2.87±0.49* 2.91±0.62*P 值 >0.05 >0.05 <0.05 <0.05
讨 论
Bins wanger病也称皮质下动脉粥样硬化性脑病,是大脑前部和脑室周围皮质下白质缺血性损害导致慢性进展型VCI,通常在数周至数月内进展。诊断Binswanger病患者需要用到病史、神经科查体、神经影像学和选择性的生物标志物。单靠其中之一都无法准确诊断该病,所以需要采用一个包含多种方式的方法来早期准确的诊断这种进展型的VCI。MRS分析主要利用磁共振现象和化学位移作用来测定一系列特定原子核及其化合物的MR信号频率,从而直接检测脑细胞代谢和生物能量变化。目前,用于脑梗死的MRS技术主要有1H-MRS,31P-MRS及13C-MRS,国内主要采用1H-MRS,它可显示的主要代谢物有NAA、Cho、Cr等。因为侧脑室体旁是脑白质的集中区域[4],所以本研究选择其作为测量点。
本研究发现Binswanger病组与正常对照组双侧侧脑室体旁白质的NAA/Cr值的比较有明显下降,Binswanger病组与脑白质疏松症组双侧侧脑室体旁白质的NAA/Cr值的比较有明显下降。NAA常位于2.03×10-6处,主要存在于神经元内,是神经元密度及活力的标志物,NAA的下降,意味着神经元的损伤和功能受损。Cr位于3.04×10-6处,是总肌酸中的甲基组,是能量代谢的物质。由于在同一个体不同代谢条件下,脑内的Cr总量是恒定的,因此把它作为其他代谢物的参照物。Kantarci[5]的研究表明在有神经元损害的AD、VD以及额叶痴呆患者中NAA/Cr值是下降的。Schuff等[6]的研究也表明在VD患者中NAA/Cr值是下降的,这与本研究的结果是一致的。其原因是Binswanger病患者的脑部深穿支小动脉硬化,导致广泛的脑白质慢性缺血脱髓鞘,以及神经元损害,从而可能导致NAA/Cr值的下降。
本研究显示Bins wanger病组Cho/Cr值明显升高,且Cho/Cr值与白质疏松程度呈正相关。Cho位于3.20×10-6处,主要存在于细胞膜上,参与细胞膜的合成,影响细胞膜的合成和分解,反映细胞膜的转运状况。Cho峰反映总胆碱含量,包括磷酸胆碱、磷脂酰胆碱和磷酸甘油胆碱等细胞膜的组成成分。胆碱富含于神经胶质细胞中,当神经胶质细胞增生及脱髓鞘改变时可见其增高。同时当髓鞘、磷脂酰胆碱或磷脂酰肌醇分解时增加了非膜性结合池的胆碱成分。Heijer等[4]对509例正常老年人进行了MRS的前瞻性长期随访研究,37人发展为痴呆,发现Cho/Cr比率升高可作为评价白质损害程度的一个生化指标。Valenzuela等[7]研究发现在AD患者中Cho/Cr比率也是升高的。本研究的结果表明Binswanger病作为一种进展型的VCI,其Cho/Cr比率升高与白质疏松反映了可能的相一致的病理变化。总之,测定患者脑白质的NAA/Cr及Cho/Cr值是早期诊断Binswanger病的有效指标。
[1]Bennett DA,Wilson RS,Gilley DW,et al.Clinical diagnosis of Binswangers disease[J].J Neurol Neurosurg Psychiatry,1990,53(11):961-965.
[2]郭洪志.脑白质疏松症[J].临床神经病学杂志,2002,15:3241.
[3]郭洪志,屈传强.Binswanger病的诊断[J].临床神经病学杂志,2002,15:3772-3781.
[4]Den Heijer T,Sijens PE,Prins ND,et al.MR spectroscopy of brain white matter in the prediction of de mentia[J].Neurology,2006,66(4):540-544.
[5]Kantarci K.1 H Magnetic resonance spectroscopy in dementia[J].The British Jour nal of Radiology,2007,80:S146-S152.
[6]Schuff N,Capizzano AA,Amend DL,et al.Different patterns of N-acetylaspartate loss in subcortical ischemic vascular de mentia and AD[J].Neurology,2003,61:358-364.
[7]Valenzuela MJ,Sachdev P.Magnetic Resonance Spectroscopy in AD[J].Neurology,2001,56:592-598.

