缺血性脑中风CT及MRI的影像表现
董进,马志娟,彭红芬,宋少辉 ,阳义
武汉市第一医院, 放射科 MRI室,湖北 武汉 430022
缺血性脑中风CT及MRI的影像表现
董进,马志娟,彭红芬,宋少辉 ,阳义
武汉市第一医院, 放射科 MRI室,湖北 武汉 430022
中风的发病率和病死率逐年上升[1],而缺血性脑中风占中风病例的 85%。本文主要探讨CT及MRI检查在观察评价缺血性中风中的优势,追踪中风的影像学演变过程,在随访中评估中风病人预后的临床价值。
缺血性脑中风;CT;MRI
0 前言
脑血管疾病包括出血性脑中风和缺血性脑中风。缺血性脑中风是脑血管疾病的主要类型,约 85%的脑中风是缺血性的。它是指脑血管狭窄或闭塞,导致脑血流阻断而使脑组织发生缺血缺氧、软化甚至坏死,致使脑血管功能障碍,引起相关症状。典型的缺血性脑中风、脑血栓、脑栓塞、腔隙性缺血性脑中风、多发性缺血性脑中风及小中风都属于缺血性脑中风。脑电子计算机 X 射线断层扫描(CT)及核磁共振(MRI)检查可显示脑梗死的部位、大小及其周围脑水肿情况和有无出血征象等,是最可靠的无创性诊断手段。
在 全 球 脑 中 风 占 死 亡 原 因 的 第 2 位[2]。 脑 中 风 中 最常见的类型为缺血性中风,占各种中风的 85%。2008 年642 万人死 于 脑 中 风, 其 中 发 展中国家约占 440 万人。根据世界卫生组织最新资料,2010 年 780 万人死于脑中风,另有 2400 万人患轻度脑中风。在发达国家中,脑中风占死亡原因的第3位。随着可显示缺血中心及半暗带的无创性成像技术的发展,目前不仅可检测脑组织具有的 潜 在 存 活 能 力 的 阈 值[3], 亦 可 评 价 脑 中 风 病 人 临 床 治疗适应症。
1 CT影像表现
CT可快速安全检查危重病人,而且相对廉价。头颅CT平扫在急性脑中风诊断中属于常规手段。阴性或轻度CT缺血征象被认为是对急性缺血性脑中风病人进行溶栓治疗的标志之一。但是对于评价急性脑缺血是否出现脑梗死,CT 并不是最合适的技术[4]。如果想扩展超出 3 h 的治疗时间窗,而在当时极有可能出现脑梗死且治疗后出血的危险性增高的情况下,CT就表现得更加不敏感了。
1.1 CT形态学成像
早期缺血性脑中风的 CT 平扫征象包括 :① 内囊模糊 ;② 脑岛带区分不清 ;③ 灰质与邻近白质分界消失 ;④ 细胞内液体积聚导致灰质脑回肿胀,脑沟消失 ;⑤大脑中动脉因栓子存在而呈高密度,大脑中动脉近端密度增高提示病人预后不良。关于 CT上出现的脑缺血改变的几 率报道不 一。早期 研究[5]中,60% 的缺血 性中风病人 24 h 内 CT 表现异常。近年来,随着新 CT 快速成像技术的应用,以及内科医生对脑缺血早期 CT表现的熟悉和掌握,缺血性脑中风的发现率逐渐增高。在对早期脑缺血病人 3 h 内出现的 CT 异常,其检出率达 65%。如果超过 1/ 3 的大脑中动脉供血区域出现上述早期 CT改变,病人出现溶栓治疗后出血的风险度较高。增强CT可清晰显示亚急性期病人在 CT平扫上呈等密度的梗死区,这是由于小的出血斑或巨噬细胞进入到梗死组织。理论上当血脑屏障被破坏时,血管内注入对比剂会加重脑实质的损伤,但在实验条件下非离子型对比剂并不影响梗死灶的容积,因而可安全使用。由于增强 CT不能增加 24 h 内脑缺血性改变的检出率,因而无法用来对急性脑中风作形态学评估,但是可用作鉴别诊断,如鉴别肿瘤所致的中风等。
1.2 CT灌注成像和血管成像
随着螺旋 CT 的出现,扫描时间明显缩短,螺旋 CT可追踪经静脉注射后血管床内的碘对比剂的变化,从而能够识别大动脉闭塞。将图像重组后可获得血管树的3D影像。 目 前 研 究 证 明[6], 应 用 CT 血 管 成 像(CTA) 可 准 确诊断大血管闭塞。依据 CTA 所采集的数据还可得到全脑灌注血容量图,从而可对出现脑缺血的低灌注的组织进行功能性和生理上的评估。基于对比剂团注前后分别进行的CT扫描以及应用减影技术得出的全脑灌注血容量图,并且根据这两种状态下的脑组织X线衰减值的变化可得到灌注数值,因而可将团注示踪作为时间功能因素。与MR灌注成像(PWI)相似,CTP 图 [如脑血容量(CBV)图、脑血流量(CBF)图和平均通过时间(MTT)图 ]亦可在对比剂首过时的 CTP 影像采集后获得。在对比剂首过时的 CTP 扫描中可采集一层或多层脑缺血组织,并绘出时间 - 密度曲线。通过定量去卷积分析可获得定量灌注图[7]。为测定动脉输入功能(AIF),扫描层面应包括脑内大动脉,如大脑中动脉。CTP 成像可估计脑梗死的最终范围和病人的预后。由于 CTA/ CTP 扫描速度快、应用广泛,因此成为评价急性脑中风病人的首选成像技术。覆盖范围有限 (1~4 层 ) 是它的主要不足[8]。
2 MRI影像表现
MRI可用于检查大多数神经系统疾病,在缺血性中风早期诊断中具有明显优势[9]。
2.1 常规MRI成像
MRI较 CT 在发现脑缺血性中风病变方面,尤其对位于小脑、脑干和深部白质的梗死灶更加敏感。脑缺血的MR表现与时间相关。急性期,T1WI上病变信号强度等同于正常脑组织。早期改变包括 T2WI或质子密度像(PDWI)可见正常血管流空效应消失,脑沟模糊且病变呈高信号,但是在发病 6~12 h 内 T2WI 不一定出现信号增高。有证据表明[10],利用液体衰减反转恢复(FLAIR)序列成像有助于脑缺血的早期诊断。应用使脑脊液(CSF)的纵向磁化矢量恢复约为零时的反转时间(TI)及较长的回波时间(TE)值,FLAIR 序列可抑制 CSF 信号,而相应的病变则呈高信号,因此可清晰显示病变。在 FLAIR 序列上血管表现为高信号,提示小动脉、小静脉或侧支血管血流缓慢或停滞。在对 70例脑内大动脉闭塞所致超急性期脑缺血病人的研究中[11],24 h 内发病的65 例(92.9%),3 h 内 发 病 的 31 例(100.0%) 于 FLAIR序列上血管内呈高信号,58 例 ( 82. 9% ) 病人 FLAIR 影像上血管内高信号与MRA显示的血管信号消失表现相一致。
应用顺磁性对比剂的增强 MRT1WI 可提供额外信息[12],但当 MR 扩散成像(DWI)和灌注成像(PWI)广泛用于评价脑缺血情况时,前者诊断价值不大。脑梗死急性期增强 MRT1WI可显示血管内、软脑膜和脑实质的强化。血管内强化的机制为血流缓慢、流动相关性增强以及正铁血红蛋白可能会缩短 T1值和血管内存在的具有类似作用的物质, 这 几 种 因 素 共 同 导 致 的 后 果[13]。 急 性 期 血 管 内 强 化与梗死性扩展的范围无关。显著的血管内强化和血容量增加提示软脑膜侧支代偿循环。血管内强化的检出率随时间而异。
2.2 MR血管成像(MRA)
MRA可用于颅内血管成像,评价颅内循环。应尽量采用 3D 采集方式[14],因其可应用较小的体素并限制体素内的相位分散和狭窄处伪影所致的信号丢失。3DTOF-MRA和相位对比 MRA(PC-MRA)方法均可获得具有较高空间 分 辨 力 的 含 有 血 流 信 息 的 影 像[15]。3DTOF 序 列 常 用 于颅内大血管成像,见图 1~2。但是由于较长的成像时间,3DTOF-MRA 和 PC-MRA 容易受运动伪影的干扰,对急性重症中风病人检查时更是如此。2DPC-MRA 可行单个厚层块采集,从而能为临床提供价值较大的 MRA 影像[16]。此种方法所用的重复时间(TR)短,可以进行快速成像,虽然其影像质量稍差,但可针对血管进行快速成像。MRA显示颅内动脉闭塞具有较高的准确度。将传统的血管造影作为金标准[17]时,MRA 显示正常和闭塞血管的准确度分别为 96.7% 和 100%。尽管已应用一些 MRI技术来提高评价颅内血管的狭窄程度的准确度,但由血流缓慢所致的敏感性降低和湍流所致的信号丢失问题尚未解决[18]。增强 MRA可清晰显示小血管并显著缩短采集时间,但其缺点是,在得到动脉信号增强的同时静脉也可强化,两者发生重叠而难以区分。

图1 动脉闭塞

图2 血肿
MRA 有助于评估中风病人的预后[19]。MRA 上大脑中动脉主干的显示与否是预测脑梗死发展的一个最重要征象。如果 M1段闭塞,梗死常常发展到最初 PWI所显示病灶周围的异常灌注区域。相反,M1段通畅的病人,其中风表现与远侧分支闭塞的表现相一致,脑损害的最大程度累及最初的 DWI上显示的异常信号区。Bryan 等在对 31例 病 人 的 研 究 中 发 现[20],M1 段 闭 塞 与 M1 段 通 畅 的 病 人相比,病变处 MTT 延长,急性期 DWI显示的病变范围大,最 终 梗 死 区 域 亦 较 大, 临 床 预 后 差。 研 究 表 明[21], 在 最初 6 h 内 MRA 上显示大脑中动脉或颈内动脉闭塞。48 例中风病人中 8 例在 3 个月内死亡,这 8 例病人最初 6 h 内在 MRA 上均显示 M1 段闭塞,且发病后 1 d 内 M1 段无再通,提示发病后 1 d 内 M1 段闭塞现象与死亡具有显著相关性。
2.3 DWI 和 PWI
分子扩散是由热引起的所有分子随机转换运动[22],即所谓布朗运动。DWI序列对分子扩散十分敏感,它广泛用于检测早期脑缺血性中风的缺血组织。PWI可显示与正常脑组织相比的低灌注区域。DWI和 PWI联合应用可为脑缺血提供定性和定量信息。
2.3.1 DWI
在早期发现脑梗死方面,脑 MRI检查对于脑干及小脑 的 病 灶 尤 为 有 效[23]。 DWI 能 够 较 直 观 地 反 映 出 新 的梗死病变,在缺血性脑梗死早期诊断中的作用十分突出,鉴别诊断优势明显,见图 3~4。随着超高场强超导磁共振 设 备 投 入 临 床 应 用[24],DWI 的 应 用 更 加 广 泛 。20 世纪 60 年 代 ,Stejskal 和 Tanner[25-26]首 次 介 绍 用 核 磁 共振测量分子的扩散。该方法基于联合应用标准自旋回波(SE)序列和扩散梯度脉冲,DWI可检测到扩散分子的净相位位移。发生位置变化的分子越多,相位位移越明显,因此信号衰减越大。信号衰减总量与扩散系数D及扩散梯度的强度和持续时间 (以常数 b 来表示 )呈指数关系,即信号衰减≈ e-bD。b 代表自旋回波扩散成像的扩散敏感因子,按以下公式计算 : b= r2G2&2(△ - &/3)。 其 中 G 代 表 梯 度 强 度 , & 为 梯 度 持 续 时 间 , △ 为180°脉冲间隔时间,r为氢质子的磁旋比。使用两个或两个以上不同的扩散梯度值,以像素为基础,根据b值和信号强度的线性变化定量测量水分子的扩散率。弥散敏感梯度强度用B值来表示。B值越高,对水分子弥散越敏感,T2透过效应越小。梗塞一般使用 1000,肿瘤使用更高的B值。对于脑实质来说,水分子表现为各向异性的弥散,因此选择施加三个方向(上下,左右,前后 )的 弥 散 梯 度[27]。 缩 短 TE 时 间 ,改 善 DWI 图 像 质 量 。双 回 波 选 项 , 改 善 涡 流 效 应[28], 但 会 增 加 TE 时 间 。 如果在6个或更多方向上测量水分子扩散率,则可计算出所有扩散张量的矩阵,因而能够绘出扩散张量图,后者可 用 来 显 示 白 质 纤 维 束[29], 见 图 5~ 7。

图3
图4
图3 ~4 脑梗死 右侧基底节区DWI图像上片状高信号,ADC图像上,相对于正常脑实质呈蓝色,说明ADC下降,水分子弥散受限。

图5

图6

图7
图5 ~7 FA图未见明显的白质纤维束受损,但白质纤维束追踪三维图像上可见相应区域白质纤维束中断减少。
2.3.2 PWI
基于团注对比剂追踪技术,当团注顺磁性对比剂进入毛细血管床时,组织血管腔内的磁敏感性增加,引起局部磁场的变化,进而引起邻近氢质子共振频率的改变,后者引起质子自旋失相,导致 T1和 T2或 T2* 的值缩短,反映在磁共振影像上则是在 T1WI上信号强度增加,而在 T2或T2*WI上信号强度降低。对比剂首过期间,主要存在于血管内,血管外极少,血管内外浓度梯度最大,信号的变化受弥散因素的影响很小,故能反映组织血液灌注的情况,间接反映组织的微血管分布情况,是对血供变化最敏感的扫描序列。可与弥散加权对照,确定缺血半暗带和再灌注时间窗[30]。近年来这种敏感性对比法广泛应用于临床的各个方面,包括肿瘤、中风、痴呆、颅内和转移瘤鉴别[31]、胶质瘤级别鉴别。对比剂浓度和血容量均与 T2弛豫率的变化呈近乎线性的关系[32-34]。要获得 CBV 值需计算相对基线值,因此必须尽可能多地采集对比剂应用时的影像,以及对比剂注入前后的影像,见图 8~11。MR 采集的原始灌注影像可用以计算出许多重要的生理学参数[35],一些对 CBF变化敏感的简单参数如峰值信号强度、峰值时间及浓度-时间曲线的半高宽均可直接得出。上述参数均与血流量呈一定的比例关系。其他参数如 rCBV、rCBF、MTT 也可通过不同的数学方法得出。rCBV 是早期 PWI应用于脑中风的研究中最常用的参数。NEI即为 rCBV,MTE 即为 MTT。为提高时间分辨率和信噪比,可用较小的矩阵。TE时间越长,对造影剂引起磁敏感效应越敏感,但图像变形会更大。
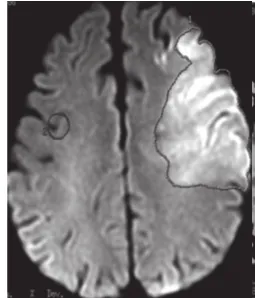
图8
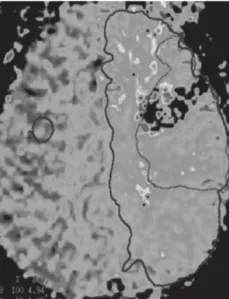
图9
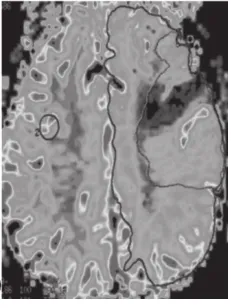
图10

图11
图8 ~11 脑梗死 弥散加权图像上可见右侧大脑半球大面积梗死高信号,而从TTP图像上,与左侧正常大脑区域相比,右侧大脑半球TTP达峰时间延长,这种异常区域明显大于DWI上梗死区域,相应区域的CBV、CBF均有下降。
2.3.3 脑中风的DWI和PWI表现
人脑缺血组织的 ADC值随时间的变化呈“双向”模式演变[36]。急性期 ADC 值显著降低,亚急性晚期、慢性期 ADC 值呈现假正常化,甚至升高。ADC 值可反应病变的进程。研究显示,中风症状出现后 12~24 h,ADC值降至最低。 ADC 值“假正常化”的时间通常认为是中风后 9~10 d。由于 ADC 值的变化呈“双向”模式,相似的 ADC值可代表完全不同的病理过程。例如,低于正常脑组织的 ADC 值即可代表脑缺血灶具有可逆性,也可代表脑梗死后 ADC值未完全归为正常。因此,需应用多个序列,如 PWI 及 T2Wl对脑梗死进行评价。联合行 DWI、PWI检查已应用于急性中风病人,两者在检测早期缺血方面优于传统的 MRl。在许多急性中风病人中,低灌注区容积大于扩散减低区脑组织。这种同层面形成 PWI、DWI上的缺血区不一致可用于评价缺血半暗带,从而进一步评估脑梗死的发展趋势。载脂蛋白 E(ApoE)的基因 表 型 对 于 梗 死 的 演 变 起 非 常 重 要 的 作 用[37]。 在 人 脑 研究中,多种MR成像方法中派生出的多个参数可用于定量评价急性中风时缺血性脑组织的梗死过程。虽然不同的 PWI参数可提供许多不同的生理学信息,但只依赖PWI的参数来评价缺血灶是不行的。联合应用 PWI和DWI的各种参数是预测缺血组织预后的最精确方法。在以体素为单位进行计算机辅助测量的基础上,联合应用MR各种成像方法能够很容易地评价急性缺血组织发生梗死的危险性。目前,DWI和 PWI对于设计个体治疗方案和评价溶栓治疗的有效性非常有意义。DWI和 PWI联合检查还可用于评价急性脑中风病人溶栓治疗的适应症,甚 至 出 现 缺 血 症 状 超 出 3 h 的 适 应 症。 研 究 发 现 接 受rtPA 溶栓治疗的病人出现早期再灌注的几率高于未接受治疗的病人。超急性期中风病人于治疗前行 DWI和 PWI检查,可避免其接受一些潜在危险性的治疗。人脑缺血组织早期再灌注后,DWI上的高信号是可逆的。然而组织的灌注减低后,DWI高信号的恢复并不意味着这些组织完全存活。大部分急性中风病人在脑组织早期 ADC值恢复后,还会在中风后 7 d 左右出现第 2 次脑缺血性损伤。接受溶栓治疗病人的研究中发现,有许多患者 ADC值早期恢复,但所有的组织均出现了梗死,而且于 T2WI和 FLAIR 序列上呈现了高信号。
2.3.4 MRI弥散张量成像(DTI)
DTI可用于定量测量组织的扩散各向异性效应。它可提供关于组织微结构的详细信息。平行于纤维束方向的水分子运动快于垂直于纤维束方向的运动,因而 DTI最有价值的应用是纤维束示踪成像[38]。此法与功能性 MRI 联合应用,可充分评价许多重要组织的连续性。DTI也用于评价一系列细微性病变,如中风、多发性硬化、失读症和精神病。DTI可为中风病人提供 ADC无法单独提供的额外信息。急性中风时,联合应用ADC值和扩散各向异性测量值可出现 3 个阶段的异常 :① ADC 值减低和扩散各向异性值增高。② ADC值和扩散各向异性值均减低。③ADC 值升高和扩散各向异性值减低。梗死区周围的白质纤维束只是扭曲而非破坏,纤维束破坏较少的病人预后较好。
DTI扫描一般采用 5 mm,覆盖全脑,增加 TR 时间增加扫描层数。增加 NEX,或增加弥散张量数量,均可改善图像质量。采用单次激发自旋回波 EPI序列扫描,弥散 b值一般为 1000。TR=8000~10000 ms,TE 默认为最短。弥散敏感梯度施加方向一般选择 13~25 个。DTI是在 DWI的基础上施加6个以上梯度场获取脑实质内水分子弥散方向的信息。衡量水分子弥散方向的指标叫部分各向异性值FA。FA 图反映水分子弥散方向的各向异性,彩色 FA 图像对白质纤维束走行方向用颜色进行标识,前后为绿色,左右为红色,上下为蓝色。DTI可以计算出 ADC、FA、VR值等,FA对白质损伤比较敏感,所以临床应用较多。
2.3.5 MRI波谱(MRS)
磁共振波谱是一种无创性获得活体生理及病理物质代谢的检查方法,尤以1H-MRS 在脑部疾病中的应用最为广泛。MRS是将一个空间内许多信号分别用不同的峰值曲线显示而成,波谱曲线的形成是基于化学位移和 J- 耦合两种物理现象,见图 12。
中枢神经系统波谱谱线临床意义:
(1)N- 乙酰基天门冬氨酸(NAA),正常脑组织第一大峰,位于 2.02~2.05 ppm,仅存在于神经元内,而不会出现于胶质细胞,是神经元密度和生存的标志。
(2)肌酸(Creatine),正常脑组织的第二大峰,位于3.03 ppm 附近 ;峰值一般较稳定,常作为其他代谢物信号强度的参照物。
(3)胆碱(Choline),位于 3.2 ppm 附近,评价脑肿瘤的重要共振峰之一,快速细胞分裂导致细胞膜转换和细胞增殖加快,胆碱峰增高。
(4)乳酸(Lac),位于 1.32 ppm,由两个共振峰组成,TE=144,乳酸双峰向下 ;TE=288,乳酸双峰向上 ;正常情况下,细胞代谢以有氧代谢为主,检测不到 Lac 峰,此峰出现说明细胞内有氧呼吸被抑制,糖酵解加强。
(5) 脂 质(Lip), 位 于 1.3、0.9、1.5、6.0 ppm, 频 率与 Lac 相似,可遮蔽 Lac 峰 ;此峰多见于坏死脑肿瘤。
(6)肌醇(mI),位于 3.56 ppm,用 STEAM 技术显示,认为是激素敏感性神经受体的代谢物,mI含量的升高与病灶内的胶质增生有关。mI峰主要用 STEAM 序列观察。

图12 中枢神经系统波谱图
MRS可用于评价活体正常或异常脑组织的代谢产物浓度。随着新技术的发展,1H-MRS 在缺血性脑中风中的应用越来越多。脑中风病人1H-MRS 的表现是 :出现 Lac 峰,NAA 峰、Cho及 Cr峰均降低。急性脑梗死后几个小时内便可见 NAA 减低。Lac的出现提示梗死区域组织的无氧代谢。NAA进一步降低提示缺血组织的损伤将持续 1周。在急性期、亚急性期和慢性期,病人 NAA 降低的水平及 Lac/ Cho比值升高的水平与临床预后具有相关性。区域性31p-MRS可对脑组织的能量代谢和 pH 值的变化进行研究[39-40]。 脑缺血组织可见无机磷 /磷酸肌酸升高,ATP 耗竭,与生物化学研究的表现相似。
2.3.6 功能性MRI( fMRI)研究
fMRI研究可为缺血、梗死的脑组织恢复提供定性、定量和动态的信息。fMRI是以与代谢相关的血流变化为基础的。最常用的成像机制称为血氧水平依赖(BOLD)对比法和流动相关增强。BOLD 利用 EPI系列采集皮层活动区血氧饱和度变化,反映脑皮层区在外界刺激状态下的功能情况。局部脑组织的血流动力学与局部的脑活动密切相关。BOLD利用血红蛋白引起的磁敏感性变化进行成像。当含氧血红蛋白转变成去氧血红蛋白 (顺磁性物质 )时,T2WI 或 T2*WI 便 可 检 测 到 信 号 的 变 化。 流 动 相 关 增 强 则依赖于脑组织灌注增加时其表现 T1值减低的原理,这样在 对 T1值 变 化 敏 感 的 序 列 上 便 可 检 到 信 号 增 加[41]。 血氧水平依赖(BOLD)对比法常用正轴位定位,频率编码位于左右方向。扫描分辨率不宜过高,一般 3.0T 机器为96×96。其图像参数特点:多采用 GREEPI序列进行扫描,此序列对磁敏感效应最为敏感,可以探测脑功能区含氧血红蛋白和脱氧血蛋白比例的差异,引起的磁敏感效应的差异。TR=3000 ms,TR 根据不同实验可进行调整。血氧水平依赖(BOLD)对比法的临床应用 :可获得实验设计下的皮层活动状态;可以观察功能区活动程度。
fMRI可探讨脑中风病人恢复期语言和感觉认知网络的动态重组功能。限制性疗法为一种身体制动方案,主要用于改善脑中风病人慢性偏瘫恢复期的运动功能。此疗法通过迫使病人使用运动障碍的肢体来恢复肢体的运动功能。fMRI给治疗后运动恢复的神经元机制探讨提供了新方法。采取限制性疗法改善的运动功能主要与运动皮质的功能向对侧未损伤的半球转移有关。
[1] Somford DM,Nederkoorn PJ,Rutgers DR,et al.Proximal and distal hyperattenuating middle cerebral artery signs at CT: different prognostic implications[J].Radiology,2002,223(2):667-671.
[2] Gerriets T,Goertler M,Stolz E,et al.Feasibility and validity of transcranial duplex sonography in patients with acute stroke[J].J Neurol Neurosurg Psychiatry,2002,73(1):17-20.
[3] Cullen SP,Symons SP,Hunter G,et al.Dynamic contrast enhanced computed tomography of acute ischemic stroke:CTA and CTP[J].Semin Roentgenol,2002,37(3):192-205.
[4] World Health Organization.The World Health Report[R].2002.
[5] Schellinger PD,Fiebach JB,Hacke W.Imaging-based decision making in thrombolytic therapy for ischemic stroke:present status[J].Stroke,2008,34(2):575-583.
[6] Schaechter JD,Kraft E, Hilliard TS,et al. Motor recovery and cortical reorganization after constraint induced movement therapy in stroke patients:a preliminary study[J].Neurorehabil Neural Repair,2002,16(4):326-338.
[7] Toyoda K,Ida M,Fukuda K.Fluid-attenuated inversion recovery intraarterial signal:an early sign of hyperacute cerebral ischemia[J].AJNR,2010,22(6):1021-1029.
[8] Karonen JO,Partaner KPL,Vanninen RL,et al. Evolution of MR contrast enhancement patterns during the first week after acute ischemic stroke[J].AJNR,2010,22(1):103-111.
[9]Parsons MW,Yang Q,Barber PA,et al.Perfusion magnetic resonance imaging maps in hyperacute stroke:relative cerebral blood flow most accurately identifies tissue destined to infarct[J].Stroke,2010,32(7):1581-1587.
[10] Feyoly A,Carlier R,Roby-Braini A,et al.Longitudinal study ofmotor recovery after stroke: recruitment and focusing of brain activation[J].Stroke,2002,33(6):1610-1617.
[11] Arenillas JF,Rovira A,Molina CA,et al.Prediction of early neurological deterioration using diffusion and perfusion weighted imaging in hyperacute middle cerebral artery ischemic stroke[J].Stroke,2002,33(9):2197-2205.
[12] Fiehler J,Foth M,Kucinski T,et al.Severe ADC decreases do not predict irreversible tissue damage in humans[J].Stroke,2008,33(1):79-86.
[13] Kidwell CS,Saver JL,Starkman S,et al.Late secondary ischemic injury in patients receiving intraarterial thrombolysis[J].Ann Neurol,2002,52(5):698-703.
[14] Gillard JH,Papadakis NG,Martin K,et al.MR diffusion tensor imaging of white matter tract disruption in stroke at 3T[J].BJR,2010,74(883):642-647.
[15] Schellinger PD,Jansen O,Fiebach JB,et al.Monitoring intravenous recombinant tissue plasminogen activator thrombolysis for acute ischemic stroke with diffusion and perfusion MRI[J].Stroke,2009,31(6):1318-1328.
[16] Sotak CH.The role of diffusion tensor imaging in the evaluation of ischemic brain injury-a review[J]. NMR Biomed,2002,15(7-8):561-569.
[17] Li F,Liu KF,Silva MD,et al.Transient and permanent resolution of ischemic lesions on diffusion-weighted imaging after brief periods of focal ischemia in rats: correlation with histopathology[J].Stroke,2009,31(4):946-954.
[18] Li F,Silva MD,Sotak CH,et al.Temporal evolution of ischemic injury evaluated with diffusion, perfusion,and T2-weighted MRI[J].Neurology,2009,54(3):689-696.
[19] Lansberg MG,Thijs VN,O' Brien MW,et al.Evolution of apparent diffusion coefficient,diffusion-weighted,and T2-weighted signal intensity of acute stroke[J].AJNR,2010,22(4): 637-644.
[20] Lee JM,Vo KD,An H,et al.Magnetic resonance cerebral metabolic rate of oxygen utilization in hyperacute stroke patients[J].Ann Neurol,2003,53(2):227-232.
[21] Karonen JO,Nuutinen J,Kuikka JT,et al.Combined SPECT and diffusion-weighted MRI as a predictor of infarct growth in acute ischemic stroke[J].J Nucl Med,2008,41(5):788-794.
[22] Liu Y,Laakso MP,Karonen JO,et al.Apolipoprotein E polymorphism and acute ischemic stroke:a diffusion- and perfusion-weighted magnetic resonance imaging study[J].J Cereb Blood Flow Metab,2002,22(11):1336-1342.
[23] Parsons MW,Li T,Barber PA,et al.Combined (1) H MR spectroscopy and diffusion-weighted MRI improves the prediction of stroke outcome[J].Neurology,2009,55(4):498-505.
[24] Liu Y,Karonen JO,Vanninen RL,et al.Cerebral hemodynamics in human acute ischemic stroke: a study with diffusion-and perfusion-weighted magnetic resonance imaging and SPECT[J].J Cereb Blood Flow Metab,2009,20(6):910-920.
[25] Ostergaard L,Sorensen AG,Chesler DA,et al.Combined diffusion-weighted and perfusion-weighted flow heterogeneity magnetic resonance imaging in acute stroke[J].Stroke,2009, 31(5): 1097-1103.
[26] Rohl L,Ostergaard L,Simonsen CZ,et al.Viability thresholds of ischemic penumbra of hyperacute stroke defined by perfusionweighted MRI and apparent diffusion coefficient[J].Stroke, 2010,32(5):1140-1146.
[27] Liu Y,Karonen JO,Vanninen RL,et al.Detecting the subregion proceeding to infarction in hypoperfused cerebral tissue:a study with diffusion and perfusion weighted MRI[J].Neuroradiology, 2003,45(6):345-351.
[28] Desmond PM,Lovell AC,Rawlinson AA,et al.The value of apparent diffusion coefficient maps in early cerebral ischemia[J].AJNR,2009,22(7):1260-1267.
[29] Rose SE,Chalk JB,Griffin MP,et al.MRI based diffusion and perfusion predictive model to estimate stroke evolution[J].Magn Reson Imaging,2009,19(8):1043-1053.
[30] Kim JH,Lee EJ,Lee SJ,et al.Comparative evaluation of cerebral blood volume and cerebral blood flow in acute ischemic stroke by using perfusion-weighted MR imaging and SPECT[J].Acta Radiol,2002,43(4):365-370.
[31] Wittsack HJ,Ritzl A,Fink GR,et al.MR imaging in acute stroke:diffusion-weighted and perfusion imaging parameters for predicting infarct size[J].Radiology,2002,222(2):397-403.
[32] 孙德胜,王金锐.医学超声技术在动脉硬化疾病中的应用及进展[J].中国医疗设备,2008,(12):134-137.
[33] Fiehler J,von Bezold M,Kucinski T,et al.Cerebral blood flow predicts lesion growth in acute stroke patients[J].Stroke,2002,33 (10):2421-2425.
[34] Belin P,Zatorre R J,Lafaille P,et al.Voice-selective areas in human auditory cortex[J].Nature,2009,403(6767):309-312.
[35] Solodkin A,Hlustik P,Noll DC,et al.Lateralization of motor circuits and handedness during finger movements[J].Eur J Neurol,2009,8(5):425-434.
[36] Rotte M,Kanowski M,Heinze HJ,et al.Functional magnetic resonance imaging for the evaluation of the motor system: primary and secondary brain areas in different motor tasks[J].Stereotact Funct Neurosurg,2009,78(1):3-16.
[37] Krings T,Topper R,Willmes K,et al.Activation in primary andsecondary motor areas in patients with CNS neoplasms and weakness[J].Neurology,2009,58(3):381-390.
[38] Fontaine D,Capelle L,Duffau H,et al.Somatotopy of the supplementary motor area: evidence from correlation of the extent of surgical resection with the clinical patterns of deficit[J].Neurosurgery,2009,50(2):297-303.
[39] Nelson L,Lapsiwala S,Haughton VM,et al.Preoperative mapping of the supplementary motor area in patients harboring tumors in the medial frontal lobe[J].Neurosurgy,2009,97(5):1108-1114.
[40]王昌军,李福星,侯威.脑磁图磁源模型的物理探讨[J].中国医疗设备,2010,(8):54-55.
[41] Gumprecht H,Ebel GK,Auer DP,et al.Neuronavigation and functional MRI for surgery in patients with lesibn in eloquent brain areas[J].Minim Invasive Neurosurg,2008,45(3):151-153.
CT and MRI Image Display of Ischemic Stroke
DONG Jin, MA Zhi-juan, PENG Hong-fen,
SONG Shao-hui, YANG Yi
MRI Room, Radiology Department, First Hospital of Wuhan, Wuhan Hubei 430022, China
Mortality and morbidity of stroke are increasing year after year, however, ischemic stroke takes up 85% of all stroke cases. This paper mainly discusses the superiorities of CT and MRI examnation in observing and evaluating ischemic stroke, tracks stroke iconography evolution, and estimates the clinical value of stroke patients prognosis in follow-up.
ischemic stroke; CT; MRI
R445
B
10.3969/j.issn.1674-1633.2012.09.021
1674-1633(2012)09-0080-06
2012-01-11
2012-06-15
作者邮箱:djyl516@126.com

