多谱线光声断层摄影术的癌症异质性光学成像
Eva Herzog, PhD
Adrian Taruttis, MS1
Nicolas Beziere, PhD1
Andrey A. Lutich, PhD2
Daniel Razansky, PhD1
Vasilis Ntziachristos, PhD1
多谱线光声断层摄影术的癌症异质性光学成像
Eva Herzog, PhD1
Adrian Taruttis, MS1
Nicolas Beziere, PhD1
Andrey A. Lutich, PhD2
Daniel Razansky, PhD1
Vasilis Ntziachristos, PhD1
Radiology杂志特别供稿专栏
编者按:本刊与世界顶级专业杂志合作,推出Radiology杂志特别供稿专栏。从2011年第8期起每期由北美放射学会Radiology(《放射学》)杂志向《中国医疗设备》杂志特别提供1~2篇当期的最新专业论文,本刊的读者将与Radiology杂志的读者分享到这些文章,了解该领域的最新动态。
Radiology刊载临床放射学和相关科学的研究论文,包括诊断放射学、神经放射学、核医学、儿科放射学、超声、治疗放射学、辐射物理学,以及放射生物学等。该杂志每月出版约300 页的同行评审的原创性研究、权威的评论及新技术的专家评论,其影响因子在诊断放射领域杂志中排名第一,系全球医学专业杂志中拥有权威地位的顶尖杂志(独家发布,禁止转载)。
1.慕尼黑工业大学 生物和医学影像研究院,德国 纽贺堡;2.慕尼黑大学 物理学系与纳米科技中心 光子学与光电子学组,德国 慕尼黑[摘 要]目的考察多谱线光声断层摄影术(MSOT)在展示目标外源物质的不均匀分布状况和活体样本恶性肿瘤中直径在毫米级的血管的特征等方面的能力。材料与方法实验中涉及的对动物的操作经上巴伐利亚行政区政府批准。研究人员使用一台MSOT装置(产生横断面图像速度为10帧/s,平面内分辨率约为150 μm)对小鼠皮下肿瘤进行成像。为了研究动态对比强化,研究人员系统性地对3只患4T1型肿瘤的小鼠进行注射吲哚菁绿(ICG)操作,并在该操作前、注射时及注射后20 min,4 h和24 h对上述小鼠进行成像。荧光显微镜成像结果被用于对比。靶向荧光剂(注射6 h后)和血红蛋白氧合物的MSOT同时进行(4T1型肿瘤:n=3)。冰冻切片的荧光显微镜成像结果被用于验证上述结果。研究人员利用长循环时间金纳米棒对由于渗透性增加和肿瘤(4T1型肿瘤: n=4, HT29型肿瘤:n=3, A2780型肿瘤: n=2)内的滞留产生的积聚效应进行评估(注射前,注射时,注射后1 h,5 h和24 h)。暗场显微镜检查结果被用于验证上述结果。结果吲哚菁绿可用于动态对比强化。与荧光显微镜成像对比,MSOT显示了肿瘤内药剂的不均匀分布。靶向荧光剂和脱氧血红蛋白的同时成像让研究人员除目标药物摄取程度外,还可以了解肿瘤内的血管系统。久而久之在MSOT影像中看到的肿瘤中的金纳米棒的积聚过程,也呈异质性吸收。结论MSOT技术可用于肿瘤的即时高空间分辨率观测,用以展示目标荧光染料、纳米材料以及肿瘤内部血管网的影像资料。
荧光活体显微镜是了解恶性肿瘤微环境和治疗机制[1,2]的基本手段。这种肿瘤成像技术使得研究人员得以使用荧光手段深入了解肿瘤血管系统和局部药代动力学特性。尽管荧光显微法功能强大,但因为受到表面渗透性的限制,该方法的成像深度很少达到几百微米[3]以上。从全部肿瘤的宏观成像可以看出显微镜检查捕获不到的空间异质性,比如药物传输的整体分布。然而,宏观光学成像法受到光子穿透能力的限制,现在主要应用于定性的二维展示皮肤表面的荧光光子分布,而无法探测肿瘤分布[3]。光声成像的出现以其提供的高空间分辨率的深部组织光学对比和实时成像能力[4-6],为肿瘤研究提供了新的手段。
光声成像技术使用短时光子脉冲(纳秒幅度)激发组织,并测量各种组织吸收激发光束后产生的超声信号[7]。使用不同的激发波长光信号,多谱线光声断层摄影术(MSOT)可以利用不同分子的谱线特征来像荧光显微镜一样区分普通的荧光分子、光吸收纳米材料以及血红素分子[8,9],而同时将成像深度提高至几毫米甚至厘米量级。此方法的成像分辨率由超声信号的间隔长度决定,该时间间隔通常低于激发光信号的间隔长度[3]。
迄今为止,基于光声现象的成像技术已被有限地应用于 探 测肿瘤[10]中 吸 光粒子, 如血管结构[11]和 血液含氧[12]的评估,模式组织[8]中荧光蛋白的成像,以及尝试探测病人[13,14]乳腺癌的初步研究。
我们假设 MSOT 能用来做全肿瘤横切面的实时高空间分辨率成像。我们利用荧光染料和显影荧光探针分布的技术,研究了影像动态对比强化的能力。研究人员也研究了一段时间后的长循环时间金纳米棒的积聚程度以及肿瘤内血液载氧程度的分布,用以描述肿瘤内增强的渗透性和药物截留效应,这为开发针对肿瘤的选择性药物传输技术创造了机会。此项研究的目的是调查 MSOT 能否显示目标外源性药剂的不均匀分布和活体样本中直径几毫米肿瘤的血管网特征。
1 材料与方法
1.1 MSOT的设置
本 文 中 使 用 的 实 验MSOT 系 统[6,11]( 图 1) 能 够 以 10帧 /s 的速度获取,重建和展示小鼠的横断面成像。2 cm 视场信号的获取时间为 33μs/帧 ;实时成像的图像重建耗时不超过 100 ms。平面分辨率大约 150 μm。研究人员用一 台 由 掺 钕 钇 铝 石 榴 石 激 光 器(Opotek, Carlsbad, 加 州 )带动的可调(700~950 nm)光学参量振荡器产生近红外激发光束,并用一个带有 10根输出臂的光纤束对小鼠进行多角度照明。一个自制的带有 64 个收集单位,中心频率 5 MHz 的超声换能器阵列(Imasonic SAS, Voray, 法国)被用来收集超声信号。研究人员用一套 4 千万样本 /s 和 12 bit数位解析度的定制获取系统对时间分辨信号进行了数字化。换能器阵列被潜入水槽,用固定器固定于水平位置,并用聚乙烯薄膜隔水,以便与小鼠进行声学耦合。该装置可以使用线性模组对小鼠进行多重横截面成像。

图1 实验用MSOT成像装置。虚线表示大概的成像平面。
1.2 图像重建
本研究用反投影算法[16]为每一种单一波长信号重建了MSOT 图像。研究人员随后对每组多重波长成像结果进行线性光谱分离,以解出每种吸光介质(造影剂和血红蛋白)[8]的特异性信号。这种信号处理方法将每个像素点的光声断层扫描数据按照已知的氧合/脱氧血红蛋白、用于注射的荧光药物的光谱特征以及水平光谱基线进行拟合。光谱分离算法的方程如下:

其中,φ 为积分通量(焦耳 /平方厘米),μa为光学吸收系数(单位 /厘米),λi为波长,εj为单位浓度吸收介质 j的波长吸收系数,cj为吸收介质 j的局部浓度。由于光声信号强度与局部积分通量和吸收量相称,结果Φμa代表每个波长的像素点信号强度。用最小二乘法解出的未知量就是 φcj,j=1...N。本研究中,研究人员假设组织吸收光谱决定的积分通量的波长相关性可以忽略,而在皮下肿瘤的病例中该假设被证明是正确的。深部组织成像的校正方法是当前研究[17]的一个方向。
1.3 动物的处理
程序所涉及动物均由上巴伐利亚区政府批准。本研 究 中共 使 用了 3 支 癌 细 胞 株 :4T1 型 小鼠 乳 腺癌 细 胞(CRL2539 ;美式细胞培养保藏,马纳萨斯,弗吉尼亚州),A2780 型人类卵巢癌细胞(Sigma-Aldrich,圣路易斯,密苏里州),以及 HT29 型 人 类结肠恶 性腺瘤细胞(ATCCHTB-38,美式细胞培养保藏)。小鼠(成年雌性 CD-1 型裸鼠)均皮下接种细胞悬液(4T1 和 A2780 型 :80 万细胞 ;HT29 型 :150 万细胞),晚期实验均在肿瘤达到 8 mm 直径(具有可比较的尺寸)时执行。研究人员通过被异荧烷麻醉的小鼠对 MSOT 数据进行了记录。
1.4 肿瘤血管信号的动态对比强化
为了研究 动态对比 强化的 MSOT 成 像,我 们使用了吲哚菁绿(ICG)(Pulsion 医学体系,慕尼黑,德国),这是一种被美国食品药品管理部门批准可用于临床实验[18]的 染 料 。 静 脉 注 射 后 , 吲 哚 菁 绿 迅 速 与 血 浆 白 蛋白和 b- 脂蛋白结合,并脱离循环系统 [19]。研究人员给 3 只携带有 4T1 型 肿 瘤 的 小 鼠 进行了成 像,在注射97 nmol吲 哚 菁 绿 前 、 注 射 时 和 注 射 后 20 min、 小 时和 24 h 以及 725,750,775,800,825 和 850 nm 波长下为肿瘤实施了多谱线光声断层摄影术。静脉注射吲哚菁绿期间,研究人员在 790 nm 波长下对小鼠进行连续成像处理。为对照起见和证实吲哚菁绿的存在,研究人员 用 一 台 低 温 电 荷 耦 合 联 照 相 机(VersArray ;Roper Scientific,特 伦 顿 , 新 泽 西 州 ) 和 适 当 的 滤 光 片 , 在24 h 的时间点和 750 nm 激光照明下,捕获了活体样本的荧光显微镜成像。通过肿瘤与相邻皮肤区域的手动
分割,根据这些区域内平均强度值的除法运算,估算出了肿瘤与背景的比值。
1.5 靶定荧光剂成像
为了研究 MSOT 展示血红蛋白和靶定荧光剂在肿瘤内分布情况的能力,研究人员在 700,730,745,760,800和 900 nm 波长下给 3 只患有 4T1 型肿瘤的小鼠进行了成像。为检验注射靶定荧光剂前血红蛋白的分布情况(以及肿瘤血管的特性),研究人员在给小鼠接种肿瘤细胞4天、6 天、10 天和 13 天后为它们做了成像。在第 13 天,研究人员给小鼠注射了 24 nmol定向荧光剂(IntegriSense 750;PerkinElmer,沃尔瑟姆,麻省)并在 6 h 后为其成像。IntegriSense 750 是一种与荧光染料(靶向整合素 αγβ3)共轭的 3- 氨甲基类似物,与病态血管生成[20,21]相关联的生物标记。多谱线光声断层摄影之后,这些小鼠被执行安乐死,并被置于最佳切割温度复合物(Sakura Finetek,托伦斯,加州)中冷冻于 -80℃环境下,在低温切片机(CM1950,徕卡微型系统,维兹勒,德国)中切片,同时用多谱线荧光系统 22 做成像处理以确认 IntegriSense 750的分布情况。研究人员每隔 500 μm 记录一次肿瘤横截面的成像。研究人员手工分割肿瘤区域,并计算不含氧合血红蛋白明显信号的像素点(氧合血红蛋白信号≤0)占总像素点数的百分比。
1.6 纳米粒子沉积的成像
研究人员利用肿瘤的增强渗透性和保留效果,使用吸收波长为 780 nm 的金纳米棒(AuNR-M; Nanopartz, 拉夫兰,科罗拉多州),使其在恶性肿瘤血管网部位渗出血管壁,从而获得纳米颗粒在肿瘤部位的沉积程度成像。金纳米棒在近红外区域显示出高强度的可调吸收峰。它们强烈的光热属性可用于治疗目的[23]而且实现光学控制的药物释放[24]。由于强大的光学吸收,它们适配于光声成像的造影剂[25,26]。我们使用覆盖有专利亲水甲基高分子材料的纳米棒,这使得微粒在活体样本中的循环系统中可以保存超长的时间。这些纳米棒尺寸为 10 nm×38 nm。
在 早 期 实 验 中, 研 究 人 员 在 700,730,760,780,800,825,850 和 900 nm 波长下,给 4 只患有 4T1 型肿瘤的 小 鼠 做 了 成 像, 并 将 金 纳 米 棒(16μg/g, 约 2.6e12 个微粒)注入小鼠体内。在注入前、注入时和注入后 1 h、5 h 和 24 h 做了成像处理。此后,小鼠被实施安乐死并被提取血样以检查循环系统中的金纳米棒。离心分离(6 min,2000 倍重力)后,血浆上清液被分离出去,研究人员用分光仪(VIS-NIR,Ocean Optics,丹尼丁,佛罗里达)记录其吸光度光谱。780 nm 附近的吸收峰表明金纳米棒大量集中。随后小鼠被置于-80℃下存储至低温切片机切片。研究人员选定了厚度 18μm 的冷鲜肿瘤切片样本并用苏木精曙红将其染色。为确认金纳米棒的分布,研究人员用一台垂直暗场显微镜(Axiotech;卡尔蔡斯,奥伯考亨,德国)将选出的冷鲜肿瘤组织切片(10 或 12μm)成像。一台暗场聚光器(数值孔径为 1.2~1.4)将碘钨灯的白光聚焦于组织上。组织在标准指数匹配液体(折射率 1.52)中被置于基板与聚光器之间以减少来自组织背景的光散射。研究人员用物镜(原始放大率,×100;数值孔径 =1.0;水中)聚集散射光,并用电荷耦合相机(model 550D;佳能,纽波特纽斯,维吉尼亚州)记录图像。
在后续实验中,研究人员给 3 只携带有 HT29 型肿瘤和 2 只携带有 A2780 型肿瘤的小鼠注射了 8μg/g 的金纳米棒并在与初期研究同等的波长和时间点上用 MSOT 为其成像。我们通过手工分割肿瘤区域,测量每个像素点的荧光信号强度,并与空白试验(注射纳米棒之前)中采集到的最高背景噪音水平进行对比,计算其中有金纳米棒信号的像素点数量,以及占总像素点的百分比。
2 结果
2.1 肿瘤血管信号的动态对比强化
注射吲哚菁绿期间(图 2b,网上视频),在 790 nm波长处获得的图像展示了肿瘤区域内及其周围增强的动态信号。这种即时对比强化出现在循环系统中的吲哚菁绿与肿瘤血管和小鼠体内其他血管之间。利用特定多谱线技术探测荧光染料也被证明可行(图 2c,绿色覆盖物)。注射吲哚菁绿后(图 2c)产生的光谱信号与活动目标影像(图 2b)上的增强对比区域有良好的一致性,这一现象可以用于再次确认方法有效性。在注射20 min、4 h 和 24 h 后获得的测量值(图 2c)中,循环系统中的吲哚菁绿信号迅速消退(以前的研究中有研究人 员 计 算 得 出 具 体 的 半 衰 期 分 钟 数[27]), 并 在 周 围 组 织中留下了少许残留。
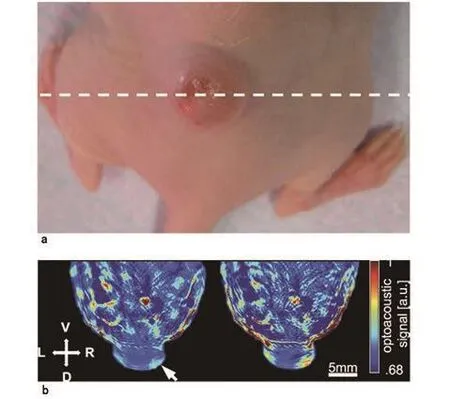
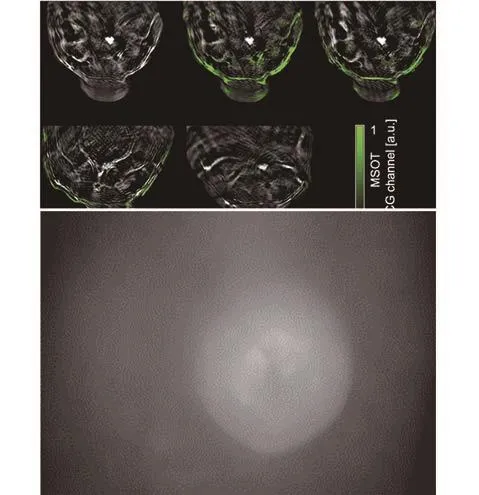
图2 植入4T1型肿瘤裸鼠的动态强化对比
在注射后第 24 h 时间点上获取的肿瘤荧光显微镜成像中,肿瘤与其周围组织之间的信号对比很弱(肿瘤与背景比率为 1.7:1),这与在同一时间点上用 MSOT 观察到的现象一致。
2.2 靶向荧光剂成像
MSOT 还能进一步应用于对肿瘤内的靶向荧光剂成像。通过使用 MSOT,研究人员可以观察在注射成像剂 6 h 后该成像剂在肿瘤部位的分布(图 3a,经冰冻切片的荧光显微镜验证),结果显示该成像剂并非均匀地渗透肿瘤组织,而是集中于肿瘤外围组织。从上述数据中,研究人员也计算出了氧合血红蛋白(红)和脱氧血红蛋白(蓝)(图 3b)的信号强度。这为荧光探针探测不到肿瘤内部提供了一种可能的解释 :肿瘤面积的 52%(4705 像素中的 2472 像素)未产生可检测的氧合血红蛋白信号,表明缺乏荧光探针转运所需的血管系统。对于接种癌细胞6日后相同肿瘤的成像结果显示出肿瘤核心部位有浓缩脱氧血红蛋白的部位(图 3b)。
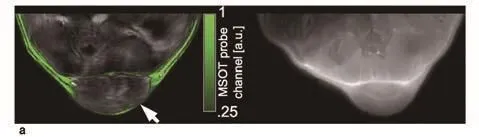
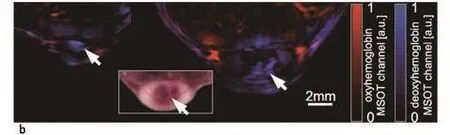
图3 植入4T1型肿瘤裸鼠的血红蛋白与αvβ3靶向荧光剂的MSOT成像
2.3 活体样本中纳米粒子沉积的成像
长循环时间金纳米棒的初步成像结果显示了在注射 24 h后仍可用 MSOT 检测到肿瘤中的纳米粒子沉积(图 4a)。血清光谱(图 4a)显示出一个波长 780 nm 左右的峰,证实了注射纳米颗粒 24 h 后循环系统内该材料的存在。纳米材料局部沉积的原因可用上述结论结合纳米材料的尺寸解释:在增强的渗透性和滞留效应条件下,纳米材料从循环系统中渗出,并在肿瘤中逐渐沉积需要一段较长的时间。高空间分辨率的 MSOT信号显示出,即便在注射药剂前,在单一波长的光声图像中,部分肿瘤组织部位的信号也显现出较高的强度差异。这暗示着纳米材料的沉积都发生在 MSOT信号较强的血流丰富区域。如图 4b所示,对冰冻切片的分析使研究人员证实了血流在肿瘤与周围组织界面处以及在周六中心区域较为丰富。苏木精 - 曙红染色的图像(图 4c)展示了血流丰富的肿瘤边缘和内部的非细胞区域。在暗场显微镜检查中,单根纳米棒及其凝聚体由于散射作用[28]分别呈亮绿,黄色和橙色。研究人员发现金纳米棒在肿瘤区域有稀疏分布(图4d);然而,在健康组织中只发现了少许斑点。研究人员检测到金纳米棒的最高浓度是在肿瘤与其周围组织的交界处,这一结果证实了 MSOT 获得的结果。
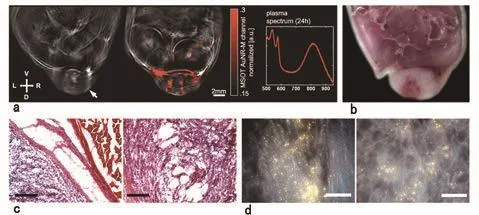
图4 金纳米棒在植入4T1型肿瘤裸鼠体内的积聚
通过在多个时间点获取的金纳米棒分布图像(图 5a),我们注意到一种变化趋势:注射后不久,金纳米棒主要集中在循环系统中。注射后 5 h 和 24 h 获得的图像则显示纳米颗粒逐渐在血管外侧形成沉积。研究人员计算了 A2780型和 HT29 型细胞系 2 个独立的肿瘤中展示出增强的金纳米棒信号的肿瘤组织的百分比含量。A2780 型肿瘤中的有纳米颗粒沉积的部分所占比例更高(图 5b)。此外,根据上文的 MSOT 数据,我们定量地绘制了肿瘤中氧合血红蛋白和脱氧血红蛋白的信号图谱(图 5c)。上述图像阐述了两种肿瘤的血管网在功能上的不同 :在检验中,A2780 型肿瘤比 HT29 型肿瘤具有更多集中脱氧血红蛋白(蓝色)的区域,后者则呈现出更均匀的氧合血红蛋白(红色)分布。这些结果暗示了纳米颗粒沉积和血管体系结构之间的潜在联系。实验后获得的来自体内的切片影像与活体成像的结果一致 :在活体内的影像(图 5c)中,A2780 型肿瘤在脱氧血红蛋白信号高亮的区域有明显的血液积聚。

图5 金纳米棒在患A2780型肿瘤裸鼠体内的积聚
3 讨论
通过使用 MSOT,可以对包括血红蛋白氧合物、荧光染料以及吸光纳米粒子在内的光学对照样品进行成像,此方法可以达到超声谱学(US)的分辨率和并能实时监控整个肿瘤在成像过程中的变化。成像结果中可见随时间变化的信号分布,其中信号主要分布在肿瘤周边,而且无法对肿瘤的大部分均匀渗透。MSOT 成像结果可以展示这种组织层面的信号分布情况,因为它是一种高空间分辨率的方法,而且对于特定的目标分子有较高的灵敏度。在本研究中,MSOT 图像和荧光显微镜成像结果在一点上有显著的差异。后者作为一种了解荧光剂生物分布的常用手段,常常使人误认为荧光信号在肿瘤中可以均匀分布。相反地,MSOT显示的生物分布照片则反映了肿瘤内荧光信号分布的异质性。
这些研究有许多是在实时模式下进行的,每帧的获取时间只需不到 50 μm。实时成像作为一种超声检查的典型特征,在动态临床 MSOT 中同样愈发重要。由于相对较高的空间分辨率,我们可以将个别大的血管——尤其是那些为肿瘤供给养分的血管形象化。光声成像的分辨率在深度上具有可扩展性而且能够在现有技术条件下通过使用更高频的探测器改善成像质量。本研究中采用的分辨率(~150 μm,特征描述未予显示)是研究人员为了对能容纳整只小鼠的视场区域(~2 cm)进行成像而特别选定的。
除了演示该方法的空间和时间特征,本研究还表明对于特定的光活性分子,研究人员能够根据其光谱特征将它们的信号进行分离,而无需测量基线信号。这对需要连续采样几小时或几天的研究来说格外重要。用此方法,研究人员可以连续描绘一段时间内的显像剂的分布。重要的是,现在 MSOT 技术可以快速扫描不同波长的信号,以便同时分辨几种目标分子的谱图指纹信号。比如,本研究中氧合/脱氧血红蛋白以及一种注射的信号分子在肿瘤中的成像可以同时完成。如果几种目标分子的吸收波长不同,也就是说它们在不同波长上显示吸收峰,那么就可能对它们同时进行成像。同时对多种外源性药剂的分布进行成像,将是下一步探究的主题。
MSOT最大的局限也许来自于激发光线,这限制了它在组织中的渗透深度。一般来说渗透的深度范围取决于组织类型,从几毫米到几厘米不等。在目前技术条件下,为简单起见,研究人员使用的是表面肿瘤模型;然而更深部位的组织特征在图像上同样可见。因此就为骨骼肿瘤的成像创造了可能,在未来研究中也研究人员也将考察这种可能性。在检测肿瘤生物指标过程中,其敏感性一定会随着深度的增加而降低,因为光每传播 1 cm 就会减弱大约 1~2 个数量级。现有系统的另一个局限是实时成像每次只能在单一平面上获取。因此,尽管整个肿瘤都能被循序的扫描,但实时成像只能在二维平面上完成。未来的发展中科研人员需要开发能够实时捕获整个肿瘤三维数据的更大的探测器阵列。
总而言之,MSOT技术可以利用光声成像技术,进行功能性成像和分子成像,其分辨率可以达到超声和核磁技术的水平。MSOT 能够作为活体显微镜检查的延伸 :牺牲衍射限制的较高的光学分辨率,来达到更深的观察水平,并且将信号分辨率保持在超声成像的水平上。对于很多吸光性药剂来说,微观尺度上的信号对比度将会达到和宏观尺度一个水平。此途径同样适合于临床环境下的多种应用——尤其是与手持式和内窥镜系统相关的——扩展了当今临床光学成像的能力。
[1] Condeelis J,Segall JE.Intravital imaging of cell movement in tumours[J].Nat Rev Cancer,2003,3(12):921-930.
[2] Jain RK,Munn LL,Fukumura D.Dissecting tumour pathophysiology using intravital microscopy[J].Nat Rev Cancer,2002,2(4):266-276.
[3] Ntziachristos V.Going deeper than microscopy:the optical imaging frontier in biology[J].Nat Methods,2010,7(8):603-614.
[4] Ntziachristos V,Razansky D.Molecular imaging by means of multispectral optoacoustic tomography (MSOT)[J].Chem Rev,2010,110(5):2783-2794.
[5] Wang LV.Multiscale photoacoustic microscopy and computed tomography[J].Nat Photonics,2009,3(9):503-509.
[6] Buehler A,Herzog E,Razansky D,et al.Video rate optoacoustic tomography of mouse kidney perfusion[J].Opt Lett,2010,35(14):2475-2477.
[7] Oraevsky AA,Jacques SL,Tittel FK.Measurement of tissue optical properties by timeresolved detection of laser-induced transient stress[J].Appl Opt,1997,36(1):402-415.
[8] Razansky D,Distel M,Vinegoni C,et al.Multispectral optoacoustic tomography of deep-seated fluorescent proteins in vivo[J].Nat Photonics,2009,3:412-417.
[9] Li ML,Oh JT,Xie X,et al.Simultaneous molecular and hypoxia imaging of brain tumors in vivo using spectroscopic photoacoustic tomography[J].Proc IEEE,2008,96(3):481-489.
[10] De la Zerda A,Zavaleta C,Keren S,et al.Carbon nanotubes as photoacoustic molecular imaging agents in living mice[J].Nat Nanotechnol,2008,3(9):557-562.
[11] Taruttis A,Herzog E,Razansky D,et al.Real-time imaging of cardiovascular dynamics and circulating gold nanorods with multispectral optoacoustic tomography[J].Opt Express,2010,18(1 9):19592-19602.
[12] Zhang HF,Maslov K,Sivaramakrishnan M,et al.Imaging of hemoglobin oxygen saturation variations in single vessels in vivo using photoacoustic microscopy[J].Appl Phys Lett,2007,90(5): 053901.
[13] Ermilov SA,Khamapirad T,Conjusteau A,et al.Laser optoacoustic imaging system fordetection of breast cancer[J].J Biomed Opt,2009,14(2):024007.
[14] Manohar S,Vaartjes SE,van Hespen JCG,et al.Initial results of in vivo non-invasive cancer imaging in the human breast using near-infrared photoacoustics[J].Opt Express,2007,15(19):12277 -12285.
[15] Maeda H,Wu J,Sawa T,et al.Tumor vascular permeability and the EPR effect in macromolecular therapeutics:a review[J].J Control Release 2000;65(1-2):271-284.
[16] Kruger RA,Kiser WL,Reinecke DR,et al.Thermoacoustic molecular imaging of small animals[J].Mol Imaging,2003, 2(2): 113-123.
[17] Rosenthal A,Razansky D,Ntziachristos V.Quantitative optoacoustic signal extraction using sparse signal representation[J].IEEE Trans Med Imaging,2009,28(12):1997-2006.
[18] Hunton DB,Bollman JL,Hoffman HN.Studies of hepatic function with indocyanine green[J]. Gastroenterology,1960,39:7 13-724.
[19] Cherrick GR,Stein SW,Leevy CM,et al.Indocyanine green: observations on its physical properties,plasma decay,and hepatic extraction[J].J Clin Invest,1960,39:592-600.
[20] Hood JD,Cheresh DA.Role of integrins in cell invasion and migration[J].Nat Rev Cancer,2002,2(2):91-100.
[21] Kossodo S,Pickarski M,Lin SA,et al.Dual in vivo quantification of integrin-targeted and protease-activated agents in cancer using fluorescence molecular tomography (FMT)[J].Mol Imaging Biol,2010,12(5):488-499.
[22] Sarantopoulos A,Themelis G,Ntziachristos V.Imaging the bio-distribution of fluorescent probes using multispectral epi-illumination cryoslicing imaging[J].Mol Imaging Biol,2011,13(5):874-885.
[23] Dickerson EB,Dreaden EC,Huang X,et al.Gold nanorod assisted near-infrared plasmonic photothermal therapy (PPTT) of squamous cell carcinoma in mice[J].Cancer Lett,2008,269(1): 57-66.
[24] Skirtach AG,Dejugnat C,Braun D,et al.The role of metal nanoparticles in remote release of encapsulated materials[J].Nano Lett,2005,5(7):1371-1377.
[25] Song KH,Kim C,Maslov K,et al.Noninvasive in vivo spectroscopic nanorodcontrast photoacoustic mapping of sentinel lymph nodes[J].Eur J Radiol,2009,70(2):227-231.
[26] Eghtedari M,Oraevsky A,Copland JA,et al.High sensitivity of in vivo detection of gold nanorods using a laser optoacoustic imaging system[J].Nano Lett,2007,7(7):1914-1918.
[27] Okabe A,Hirota M,Kimura Y,et al.Functional disturbance of biliary indocyanine green excretion in rat cerulein pancreatitis followed by endotoxemia: role of the prime and the second attack[J].JOP,2003,4(5):178-183.
[28] Orendorff CJ,Sau TK,Murphy CJ.Shapedependent plasmonresonant gold nanoparticles[J].Small,2006;2(5):636-639.
10.3969/j.issn.1674-1633.2012.09.005
1674-1633(2012)09-0021-06
本文英文原版出自Radiology杂志2012年第263卷5月刊461~468页。翻译及转载均经过北美放射学会许可。北美放射学会对在翻译过程中出现的译文不准确现象概不负责。
2011年8月5日
修改通知发出日期:2011年9月26日
修回日期:2011年11月17日
通过审核日期:2011年12月8日
定稿日期:2011年12月9日
联系人:V.N. (e-mail: v.ntziachristos@tum.de)
©RSNA, 2012

