蛹虫草废弃培养残基中虫草素的提取工艺研究
李辰,吴盼盼,卿宁,梁硕,黄俊添
蛹虫草废弃培养残基中虫草素的提取工艺研究
李辰1,2,吴盼盼1,卿宁2,梁硕3,黄俊添3
(1. 广东工业大学 轻工化工学院,广东 广州 510006;2. 五邑大学 化学与环境工程学院,广东 江门 529020;3. 江门市新会区现代农业发展有限公司,广东 江门 529100)
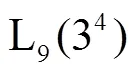
蛹虫草;培养残基;虫草素;微波;超声波
虫草是我国的一种名贵传统药用真菌,冬虫夏草因生境特殊、寄主专一而难以人工培养,但蛹虫草较易进行人工发酵培养. 虫草活性成分包括虫草素、腺苷、多糖、氨基酸等,其中虫草素具有抑菌、抗肿瘤、抑制病毒、增强免疫等多种生物活性[1-2]. 由于虫草素的合成路线较复杂、成本高[3],目前虫草素仍主要由人工蛹虫草子实体中提取而来. 然而,虫草素在天然及人工培养的虫草体内的含量很低,仅为0.02%~0.3%[4],因此,从蛹虫草或其培养残基中提取虫草素、腺苷等有效成分制备高附加值精细化学品的提取分离技术便成为近年来的研究热点之一[5-6].
目前,虫草素的提取方法有水热回流法[7]、醇热回流法、微波提取法[8]、超声波提取法[9]、微波—超声波协同提取法[10]、超临界流体提取法[11]等. 由于虫草子实体生产成本高、产量低,导致虫草素价格昂贵,目前子实体价格在每千克600.00元以上. 虫草培养残基除少量用作饲料外,大部分被废弃,其价格约为子实体成本的1%,因此尽管虫草培养残基中虫草素的含量低于或相当于子实体中虫草素的含量,但从培养残基中提取虫草素的研究愈来愈多[12-13]. 本文旨在研究从虫草培养残基中快速高效提取虫草素的工艺条件,以促进蛹虫草副产品资源的开发利用.
1 仪器、材料与试剂
Finnigan Surveyor高效液相色谱仪(美国Thermo Scientific公司),WBFY 201型微波反应器(巩义市科瑞仪器有限公司),KQ-300VDV型双频数控超声波清洗器(昆山市超声波仪器有限公司),BZF50型真空干燥箱(上海博迅实业有限公司),旋转蒸发仪RE-52A型(巩义市英峪予华仪器厂),SHZ-D(Ⅲ)循环式真空泵(巩义市英峪予华仪器厂),EL204电子天平(梅特勒-托利多),QE-200万能粉碎机(浙江屹立工贸有限责任公司).
蛹虫草大米培养残基(广东新会农业基地提供),虫草素对照品(批号858—200202,中国药品生物制品检定所).
甲醇(色谱纯,美国Burdick & Jackson公司),无水乙醇(分析纯,广州化学试剂二厂),石油醚(分析纯,60~90℃,汕头西陇化工股份有限公司),液相色谱用水由Millipore公司的Simplicity超纯水仪制备.
2 实验部分
2.1 虫草素提取
2.1.1 虫草培养残基预处理
将虫草大米培养残基样品进行真空干燥(60 ℃),经万能粉碎机粉碎,过筛,选60~100目的颗粒,加入60~90℃石油醚回流脱酯处理2 h,将脱脂后的样品过滤、风干.
2.1.2 微波和超声波提取正交试验设计
为得到最大的提取效率,在单因素试验的基础上,用正交试验分别考察微波和超声波提取两种工艺方法. 采用L9(34)正交试验设计,考察了影响提取效率的料液比(g:mL)、乙醇含量(%)、微波功率(微波法)或提取温度(超声波法)、提取时间等4个因素,因素水平设计见表1.

表1 因素水平表
注:①为微波辅助法提取,②为超声波法提取
2.1.3 微波提取
准确称取处理后的样品2.000 0 g放入250 mL具塞三角瓶中,加入50 mL 40%乙醇水溶液,再置于微波反应器中,240 W下微波提取1.5 min,提取2次. 减压抽滤,合并两次提取滤液,将滤液减压浓缩定容至50 mL.
2.1.4 超声波提取
准确称取处理后的样品2.000 0 g放入250 mL具塞三角瓶中,加入50 mL 40%乙醇水溶液,超声频率45 kHz、温度60℃下超声提取30 min,提取2次. 减压抽滤,合并两次提取滤液,将滤液减压浓缩定容至50 mL.
2.1.5 微波、超声波联合提取法
考察微波和超声波联用后的提取效果,其中一组实验先以微波提取后再以超声波提取,另一组实验先以超声波提取后再以微波提取,微波提取方法按2.1.3进行,超声波提取方法按2.1.4进行,比较两组实验与单独微波提取2次或单独超声波提取2次的提取效率.
2.2 分析方法

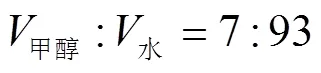

3 结果与讨论
3.1 微波辅助提取法的最佳条件
3.1.1 乙醇含量
通过单因素试验发现,提取溶剂中乙醇含量对虫草素提取效果的影响较为显著. 在提取料液比为1:25、微波提取时间1.5 min、功率400 W不变条件下,考察乙醇体积分数20%、30%、40%、50%时对虫草素提取效率的影响,由2.2分析后按式(1)计算,虫草素含量分别为:0.313、0.358、0.392和0.345 mg/g,故提取液乙醇含量为40%时提取率较高,选择乙醇含量30%、40%、50%作正交试验的3个水平.
3.1.2 料液比
通过单因素试验可知虫草素含量随料液比的增加先增大后减小. 在提取溶剂为40%乙醇、微波提取时间1.5 min、功率400 W不变条件下,考察料液比为1:10、1:15、1:20、1:25、1:30时对虫草素提取效率的影响,经计算可知虫草素含量分别为:0.193、0.238、0.325、0.362、0.315 mg/g,故料液比为1:25时提取率较高,考虑到成本和后续处理难易程度,选择料液比1:15、1:20、1:25作正交试验的3个水平.
3.1.3 正交提取试验
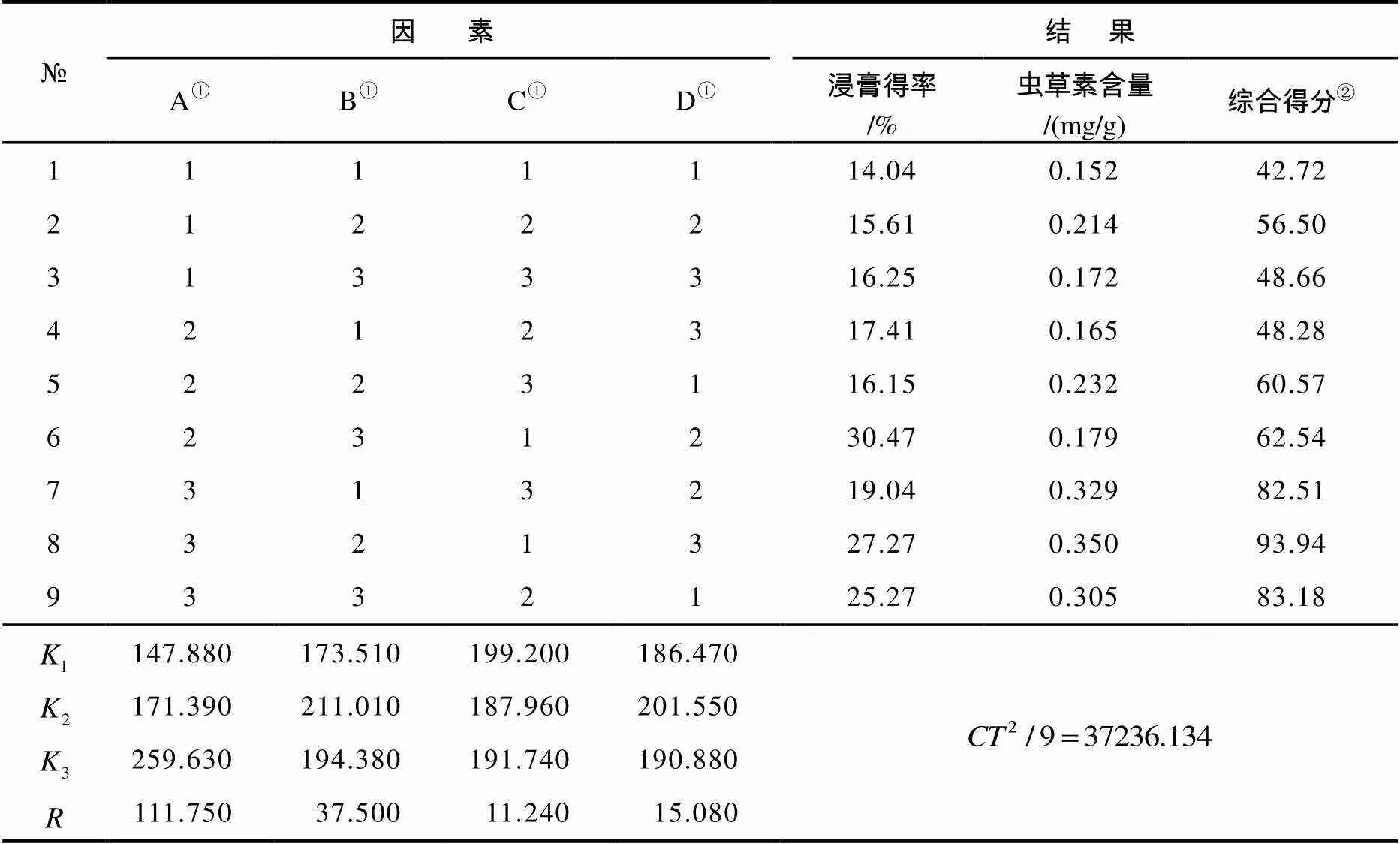
表2 微波提取正交试验结果
注:①为微波辅助提取因素;②综合得分=浸膏得率权重系数(30)×浸膏得率/最大浸膏得率+虫草素含量权重系数(70)×虫草素含量/最大虫草素含量.
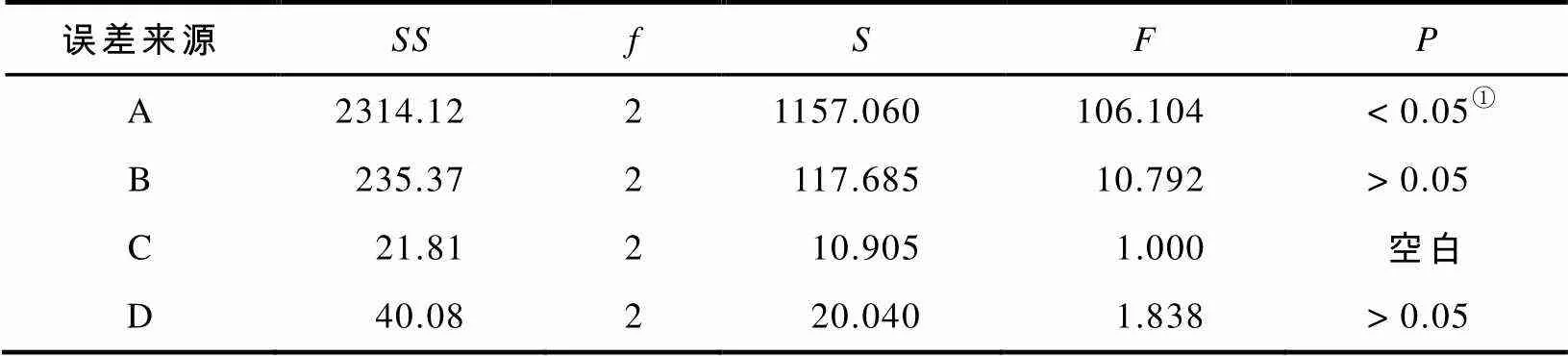
表3 微波提取方差分析

3.1.4 验证实验
由于表2中没有A3B2C1D2最佳工艺条件的实验,因此须做该工艺条件下的验证性实验. 按该条件,平行微波提取3份样品,浸膏得率平均值为28.33%,培养残基样品中虫草素含量为0.378 mg/g. 实验表明:蛹虫草培养残基经微波提取2次后,其提取液中虫草素的含量已极低,考虑成本和时间,提取2次即可.
3.2 超声提取法的最佳条件
3.2.1 单因素试验
参考微波提取法正交试验结果,提取料液比和提取溶剂中乙醇含量可能为影响提取率的主要因素,故在超声频率45 kHz、超声时间40 min和超声提取温度50℃不变条件下,分别进行料液比(1:15、1:20、1:25)和提取溶剂中乙醇含量(20%、30%、40%、50%)的单因素试验. 结果发现料液比为1:25、乙醇含量为40%时虫草素提取率较高. 为便于同微波辅助提取法比较,亦选择1:15、1:20、1:25为提取料液比的3个水平,30%、40%、50%为提取液乙醇含量的3个水平进行正交试验.
3.2.2 正交提取试验
按照表1设计方法进行正交试验,结果列于表4. 由表4结果可知,溶剂中乙醇含量增加从某种程度上增加了虫草素的溶出度,40%乙醇提取剂与虫草素的极性相近,故提取率最高. 由分子热运动规律可知,在一定范围内,温度升高有利于虫草素的提取;然而,温度过高使得虫草素可能受热分解,因此继续增加温度至70℃后虫草素含量反而降低,故选择60℃为优化后的超声提取温度. 由于提取时间增加至30 min后提取率变化不大,考虑到虫草素含量和操作时间,选择超声提取30 min即可.
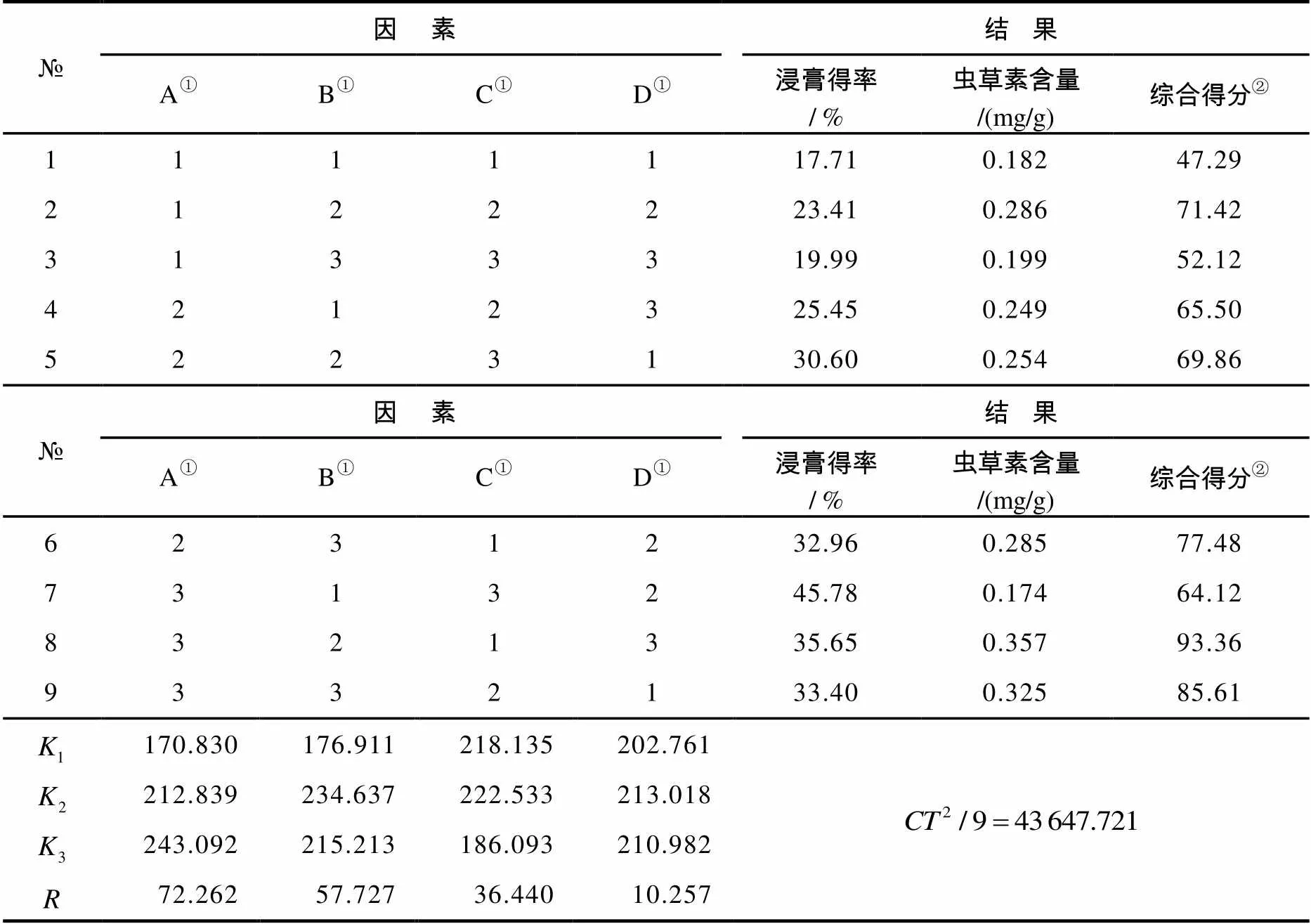
表4 超声正交提取法结果
注:①为超声波提取因素;②同表2的注释②
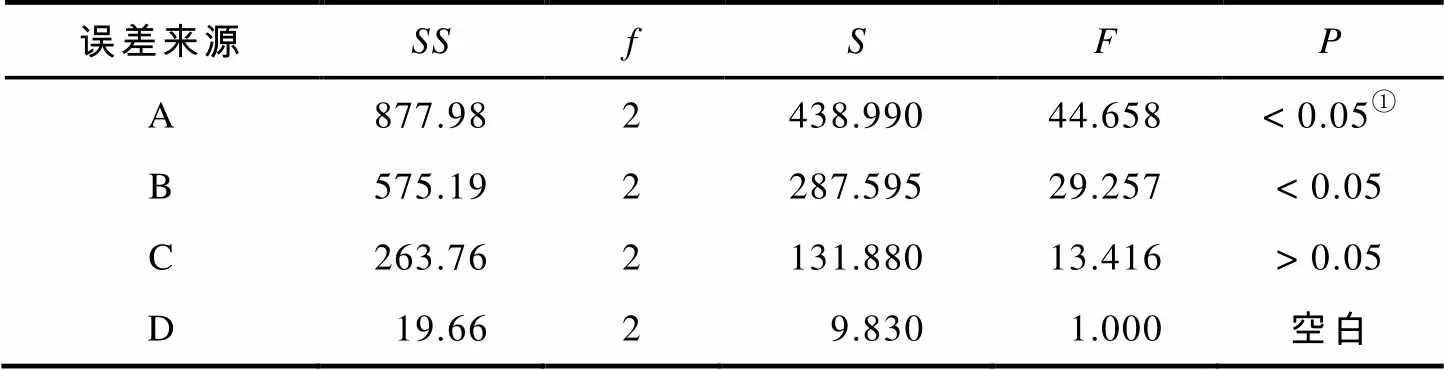
表5 超声提取方差分析
3.2.3 验证实验
3.3 微波、超声波联合提取法
上述实验结果表明:微波辅助和超声波辅助提取虫草培养基中的虫草素均可获得较好的效果. 两种提取方法均采用25倍量的40%乙醇水溶液作为提取溶剂,故考虑将两种提取方法联用以考察虫草素提取率是否有提高.
具体做法:称取经2.1.1预处理后的样品4份,每份2.000 0 g,分别置于250 mL具塞三角瓶中,其中2份先微波提取后再以超声波提取,另外2份先超声波提取后再以微波辅助法提取,微波提取条件按3.1优化后的工艺条件,超声波提取条件按3.2优化后的工艺条件进行. 结果表明:先微波提取后超声波提取的虫草素含量为0.355 mg/g;先超声波提取后微波提取的为0.367 mg/g,与单独用微波提取2次(0.378 mg/g)或单独超声波提取2次(0.362 mg/g)的结果接近,无显著不同. 鉴于超声波提取一次需30 min,而微波提取一次仅需1.5 min,且微波提取浸膏中虫草素的含量更高,故选择微波提取2次为最佳提取方案. 本方法提取蛹虫草培养残基中虫草素的提取率与文献方法相当,但无需特殊设备如微波—超声波协同提取仪或超临界流体提取仪等,采用普通微波反应器即可(笔者曾以家用微波炉提取,发现提取效果近似).
4 结语
通过正交试验分别优化了微波提取和超声波提取蛹虫草培养残基中虫草素的工艺条件,比较了微波提取2次、超声波提取2次、微波—超声波联合提取以及超声波—微波联合提取虫草素的结果,最终确定微波提取2次比其他提取方式更佳:用时仅数分钟,虫草素提取效率较高. 优化后的工艺条件:以25倍料液比的40%乙醇于240 W功率下微波提取1.5 min,提取2次. 该工艺操作简便、仪器易得、提取迅速,可作为蛹虫草及其培养残基中虫草素的快速高效提取方法,能为虫草系列产品的开发奠定一定基础.
致谢 感谢合作导师广东工业大学轻工化工学院张焜教授对本文工作给予的帮助和指导.
[1] CHEN Ying, CHEN Yungchia, LIN Yentung, et al. Cordycepin induces apoptosis of CGTH W-2 thyroid carcinoma cells through the calcium−calpain−caspase 7-PARP pathway [J]. Journal of Agriculture and Food Chemistry, 2010, 58 (22): 11645–11652.
[2] KIM H G, SHRESTHA B, LIM S Y, et al. Cordycepin inhibits lipopolysaccharide induced inflammation by the suppression of N F-kappa B through Akt and p38 inhibition in RAW 2647 macrophage cells [J]. European Journal of Pharmacology, 2006, 545(2-3): 192-199.
[3] 涂红艳,李啸风,吕秀阳. 虫草素的化学合成进展[J]. 化工时刊,2006, 20(2): 66-69.
[4] 刘艳芳,唐庆九,杨焱,等. 蛹虫草及其培养基中主要核苷类成分的分析比较[J]. 食品科学,2010, 31(4): 139-142.
[5] 张丽艳,李盈盈,张凤梅,等. 阳离子树脂对蛹虫草废弃培养料中虫草素吸附特性研究[J]. 福建师范大学学报:自然科学版,2010, 26(4): 101-104.
[6] NI He, ZHOU Xiaohong, LI Haihang, et al. Column chromatographic extraction and preparation of cordycepin from Cordyceps militaris waster medium[J]. J Chromatogr B: Analyt Technol Biomed Life Sci, 2009, 877(22): 2135-2141.
[7] 钟运俊,李学刚,韦会平,等. 蛹虫草菌皮中虫草素的提取纯化工艺研究[J]. 食品工业科技,2008(12): 150-152.
[8] 周英彪,刘芳,张善信,等. 微波—高效液相色谱法提取分离蛹虫草固体培养残基中的虫草素[J]. 食品科技,2010, 35(11): 223-226.
[9] 凌建亚,孙迎节,吕鹏,等. 虫草属真菌中虫草素的超声波提取及其毛细管电泳测定[J]. 菌物系统,2002,21(3): 394-399.
[10] 王陶,李文,陈宏伟. 虫草素的微波—超声波协同提取[J]. 食品科学,2010, 31(10): 86-90.
[11] 陈顺志. 一种超临界萃取虫草脱氧核苷的生产方法:中国,1339440[P]. 2002.
[12] 韦会平,叶小利,张华英,等. 从废弃蛹虫草大米培养基中高效提取纯化虫草素工艺条件研究[J]. 菌物学报,2009, 28(2): 220-225.
[13] 王雅玲,孙力军,赵轶男,等. 蛹虫草大米培养残基中虫草素提取方法的优化研究[J]. 安徽农业科学,2009, 37(8): 3364-3366.
A Study of the Technology for Extracting Cordycepin from Discarded Solid Medium of Cordyceps
LIChen1,2, WUPan-pan1, QINGNing2, LIANGShuo3, HUANGJun-tian3
(1. Faculty of Chemical Engineering and Light Industry, Guangdong University of Technology, Guangzhou 510006, China; 2. School of Chemical and Environmental Engineering, Wuyi University, Jiangmen 529020, China; 3. Modern Agriculture Development Co., Ltd., Jiangmen 529100, China)
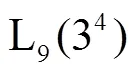
cordyceps; deserted solid medium; cordycepin; microwaves; ultrasonic waves
1006-7302(2012)03-0035-07
R914.4;O657.7
A
2010-05-12
广东省“211工程”三期重点学科建设(天然资源开发与应用平台);五邑大学博士启动项目(30613016).
李辰(1976—),男,甘肃兰州人,讲师,博士,主要从事天然产物提取工艺及质量控制方法研究.

