地下水中铁的形态与除铁工艺选择
□孙乃武 孙惠聪
我省地下水中含铁比较普遍,且随着其来源的不同,存在的形态也不同。在农村饮水安全工程中,过去是单井单屯逐渐发展为一井多屯和集中连片供水,故对水质安全保证和建设投资及常年运转管理要求也越来越高。如何正确地掌握地下水中铁质的存在形态及含量,正确选择合理的除铁工艺,显得尤为重要。
一、地下水中铁的存在形态及其来源
铁在地壳的表层含量约为6%,仅次于氧、硅、铝而占第四位。地壳中的铁质多半分散于各种晶质沉积岩中,它们都是难溶的化合物。Fe3+在水中的溶解度极小。当PH=5 时,Fe3+在水中的溶解度不足0.001mg/L,所以天然地下水中实际上不含有溶解性的Fe3+。Fe2+的溶解度略高于Fe3+,是地下水中铁质的主要成份。
地壳岩土中的铁质大量进入地下水中,大致有以下几种途径:
(一)地面上富含铁沉积岩层中的三价铁在大气降水淋滤作用下,进入水体或地下水中,在汇入和渗透时,受到水体中有机物质的影响还原为二价铁。如海林市红甸子河,就是沸石矿中铁使地面Fe3+含量增大,地下水在与河水相互补给时进入地下水,水质中Fe2+呈递减形式从河漫滩至一级阶地分布。
(二)含有二氧化碳的地下水对岩土中二价铁的溶解作用。
对氧化亚铁:
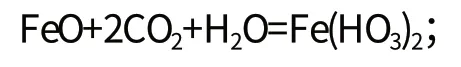
对碳酸亚铁:
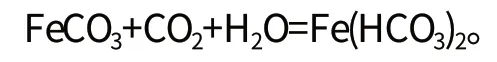
(三)在河谷漫滩、阶地和冲洪积平原地下水中,三价铁在还原条件下被还原为二价铁而溶解。在富含有机质的地层中,常由于微生物的强烈作用而处于嫌气的还原条件下,这时溶解氧被消耗殆尽,有机物进行嫌气分解产生大量硫化氢、腐殖酸、沼气、二氧化碳等。
三价铁被硫化氢还原的过程如下:

硫化铁在二氧化碳作用下溶于水中:
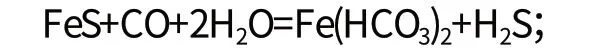
我省松花江、呼兰河、海浪河流域地下水为典型代表。
(四)一些有机物和铁生成复杂的有机铁而溶于水中,是地下潜层水受污染后的典型水质。
(五)铁的硫化物氧化而溶于水中。含铁地下水在我省分布甚广。含铁浓度多数在10mg/L 左右;20~30mg/L 者较少;含铁浓度高于30mg/L 者比较罕见。由于地层对地下水的过滤作用,一般地下水中只含有溶解性的铁的化合物,三价铁在PH>5的水中溶角度极小,所以在地下水中含量甚微,一般含铁地下水所含的主要是二价铁的重碳酸盐。由于重碳酸亚铁是强电解质,能在水中充分离解,所以二价铁在地下水中主要是以二价铁离子Fe2+的形式存在,所谓地下水中含有重碳酸亚铁,是指其假想化合形态。
地下水中除含有重碳酸亚铁外,有时还可能含有硫酸亚铁和有机铁。
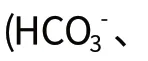
当Fe2+(毫克当量/升) 我省含铁地下水的PH值介于5~8之间,并且介于6~7.5的占绝大多数,低于6和高于7.5的比较罕见。 当水中有溶解氧存在时,水中的二价铁离子易于氧化为三价铁。氧化生成的三价铁因在水中的溶解度极小,故以Fe(OH)3形式由水中沉淀析出。所以,含铁地下水中不含溶解氧是水中二价铁离子能稳定存在的必要条件。 地下水中的有机物常对二价铁的氧化起阻碍作用,特别是当有机物结合成稳定的化合物时,常使二价铁的氧化异常困难,这种铁质一般称为有机铁。地下水中可能存在有机铁的条件是:水中含有大量有机物;水的色度很高,且为浅层地下水;水中总铁浓度与离子铁浓度的差值很大。除水质受污染外,地下水含有有机铁的情况一般并不多见。 为了去除地下水中的铁质,一般都采用氧化的方法,即用氧化剂将水中的二价铁氧化成三价铁。由于三价铁在水中的溶解度极小,故能从水中沉淀析出,从而达到地下水除铁的目的。 地下水中铁、锰一般是伴生的,但我省地下水中锰的指标不高,在除铁的同时也能将水中的锰去除,达到饮用水的指标要求。松花江流域的下游区、县地下水锰的含量高一些,如同江市等。 (一)自然氧化法除铁。以空气中的氧气为氧化剂,使含铁地下水与空气接触,空气中的氧气便迅速溶于水中(此过程为曝气)。 氧化生成的三价铁,经水解后,先生成氢氧化铁胶体,然后逐渐絮凝成絮状沉淀物,用普通砂滤池过滤去除。曝气的方法有: 敞开式:将水暴露在空气中,通过水膜或水滴来接触空气来达到曝气的作用,亦称为瀑布式曝气。如接触式曝气塔、莲蓬头淋水、喷水、跌水等曝气方式。 封闭式:将空气以小气泡的形式注入需曝气的水中,靠小气泡在水中的分散、扩散和溶解来达到曝气的目的,亦称为气泡式曝气。如压缩空气、水一气射流导、鼓风机曝气盘等。 水的PH值对自然氧化除铁过程有很大的影响。水的PH值每降低1个单位,水中OH-浓度将减小10倍,从而使水中二价铁的氧化速度降低100倍。实际上,自然氧化除铁过程只有在水的PH值不低于7的条件下才可能顺利进行。 此外,水中二价铁的氧化速度还受水的碱变、有机物和还原物质以及溶解性硅酸等物质的影响。 由于自然氧化除铁过程受多种因素的影响,所以其除铁的可靠程度只有参照已有工程实例来确定。自然氧化除铁所需时间一般不超过1~2 小时,反应时间过长时,处理系统就会显得过于庞大而不经济,这时应采取加速氧化反应的措施。 加强水的曝气过程,尽可能多地散除水中的二氧化碳以提高水的PH值,是提高二价铁氧化速度的重要措施。特别是多数含铁地下水的PH值小于7,加强曝气更是必要的措施。因此,在自然氧化除铁系统中,曝气的目的不仅是为了向水中溶解氧气,同时也是为了散除水中的二氧化碳以提高水的PH值。敞开式的曝气方式更能散出水中硫化氢、溶解性腐殖酸等气体。 (二)锰砂除铁法。天然锰砂除铁是一种接触催化除铁工艺。天然锰砂含有高价锰(大于正二价)的氧化物,能对水中二价铁的氧化反应起催化作用,大大加快其反应速度。一般认为二氧化锰的催化机理是,二价锰首先被水中的溶解氧氧化成高价锰的氧化物,高价锰再将二价铁氧化成三价铁。由于这两个反应进行得都很快,所以就大大加速了二价铁氧化成三价铁的速度。 天然锰砂在除铁过程中,除了依靠它自身含有的高价锰的氧化物的催化作用以外,在其表面还能逐渐形成一种以“滤膜”形式存在的铁质催化物,称为除铁“活性滤膜”。“活性滤膜”是r 型的羟基氧化铁所构成(r-FeOOH),它在含铁地下水的PH 条件下能与二价铁离子进行离子交换,并置换出等当量的氢离子。被交换吸附的二价铁继续进行水解和氧化,产生出羟基氧化铁,使催化物质得到再生。 生成的羟基氧化铁作为“活性滤膜”物质又参予新的催化除铁过程,所以“活性滤膜”除铁过程是一个自动催化过程。 将催化原理用于地下水除铁,是除铁工艺的一个进步。天然锰砂不仅对水中二价铁的氧化反应有很强的接触催化作用,并且同时又能完成对水中铁质的截留分离作用,所以曝气后的含铁地下水只经天然锰砂一次过滤,就能完成全部除铁过程。 (三)人工锈砂除铁法。除铁活性滤膜不仅能在天然锰砂表面形成,并且也能在其它滤料(如河砂、石英砂)表面形成。制作过程是向水中投加硫酸亚铁,使水中二价铁浓度达到100~200mg/L,并调整PH值为6~7,将此含铁水曝气后立即经滤料过滤,滤后水抽回池前循环使用,如此对滤料连续处理60~70 小时,便制成具有接触催化除铁能力的人工锈砂。 人工锈砂的除铁原理与天然锰砂表面的“活性滤膜”的除铁原理相同,可以使用与天然锰砂相同的除铁系统,并且具有与天然锰砂大致相同的适用范围。 (四)氯化除铁法。当以空气中的氧气氧化地下水中的二价铁有困难时,尚可向水中投加氯,氯是比氧更强的氧化剂,当PH>5 时,氯能迅速将二价铁氧化成三价铁。当地下水中锰较高时,采用氯化法同样能够完成除锰过程。 (五)高锰酸钾除铁法。高锰酸钾也可以除铁,其氧化能力较氧和氯更强。高锰酸钾投量很小仍能获得相当好的除铁效果,这可能是反应中生成的二氧化锰具有接触催化作用所致。 (六)水中硫酸亚铁(石灰)去除法。当水中碱度过小,不足以中和二价铁氧化水解时生成的酸度,水的PH值会在除铁中大大降低,影响除铁过程的进行,所以去除水中的硫酸亚铁,需向水中投加碱剂(石灰等)。 (七)陶料(硅碳素)除铁。采用人工陶料(硅碳素为粉煤灰、氧化铝和沸石等多孔物质烧结而成)作为滤料接触除铁(软化水和除氟所用特殊水处理),使用一段时间后,需用碱剂进行再生(还原),把陶料上的阳离子置换出来,代之以新的可交换离子,硅碳素的再生过程亦为水软化反应的逆过程。 (八)人工地层除铁。地层除铁的机理是用含有氧的曝气灌入地下含铁地层,形成具有除铁能力的地下除铁层。一般有单井自灌和群井互灌两种方式。 当地下水中铁超标不大,不含硫化氢腐殖酸等有害气体时,且PH值不太低,宜采用封闭式曝气,如采用石英砂滤池或锰砂除铁滤池,也可采用人工地层除铁。 当地下水中铁超标不太大,但含有硫化氢腐殖酸、二氧化碳等气体,且PH值较低时,宜采用敞开式曝气方式,如锰砂除铁滤池和人工锈砂除铁滤池。 当地下水中铁、锰都超标时,有机物含量高,氧曝气困难时,宜采用氯化除铁法和高锰酸钾除铁法。 当地下水中含有硫酸亚铁碱度过小、PH值过低时,宜采用石灰法除铁。当地下水含铁超标,硬度大或含氟时,宜采用陶料(硅碳素)除铁法,可达到特殊处理目的,又可实现除铁处理。 地下水除铁工艺选择的根本依据是水源水文地质勘察评价结论,如做不到,也应对探采结合井进行水文地质成果评价,以确保除铁工艺选择准确。 在地下水取水井钻井过程中,应取样编录,以便分析水中各种物质的来源,正确选择曝气形式和除铁工艺。 地下水中含有机物,一般情况是受污染所致,应分析查清其来源,采取措施切断污染源和设立水源卫生防护区,采取相应的处理工艺,以确保水质安全。 地下水除铁工艺选择的原则是:简单、方便、节能、节省工程投资。工艺复杂将增大投资费用和常年管理费用。 对已建成的水处理工程进行总结,可为本地区、相邻地区或相同水质的新建工程提供设计参考相关依据。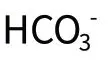

二、地下水除铁原理及基本方法
三、除铁方法的选择
四、总结

