榆紫叶甲雌雄两性跗垫结构及分泌物成分鉴定1)
田海娇 肖 丹 胡基华 孙 凡
(东北林业大学,哈尔滨,150040)
许多昆虫的足上都具有跗垫构造,这使得它们能够抓牢一些光滑的表面。跗垫在结构上分为2种类型,直翅目和膜翅目昆虫跗垫的表面是光滑的,而鞘翅目和双翅目昆虫的跗垫上却密被刚毛。同时,无论是具有光滑跗垫的昆虫还是具毛状跗垫的昆虫,在许多种类中都发现了跗垫黏性液体分泌物的存在[1-2]。这些分泌物覆盖在跗垫的表面,推测能影响跗垫的表面张力来增加其粘着性。目前一些甲虫的跗垫分泌物的成分得到鉴定,其结构是烷烃类物质,这与鞘翅表皮的成分非常相似[3-4]。鞘翅目许多种类的跗垫刚毛都存在着明显的性二型现象。如龙虱科(Dytiscidae)雄性前足跗垫特别膨大,其上的刚毛端部呈吸盘状构造,在交配时雄性用跗垫挟持住雌性[5]。叶甲科(Chrysomelidae)的种类一般雌性具有2~4种末端不同的跗垫刚毛,而雄性比雌性多出一种顶端呈圆盘状的刚毛,推测雄性依靠这种特有的刚毛在交尾时可以牢固地抱握住雌性光滑的鞘 翅[4-6]。榆 紫 叶 甲 (Ambrostoma quadriimpressum Motschulsky)主要分布于我国东北平原地区及内蒙古、河北、山东、河南等地[6-7]。成虫、幼虫均为害榆树萌发的新芽、新苞、叶片,且其食性单一,为害期较长,破坏性大,严重影响榆树(Ulmus pumila L.)生长[8]。笔者利用扫描电镜研究了榆紫叶甲雌雄两性跗垫刚毛的形态,并用GC-MS对雌、雄跗垫分泌物的组成成分进行了鉴定,为进一步研究这种昆虫的行为学提供基础。
1 材料与方法
供试昆虫:榆紫叶甲成虫于2011年5月采自东北林业大学校园内的榆树上,在实验室雌、雄成虫分别放置在木制养虫盒内(27 cm×38 cm×5 cm)喂养,每天供给新鲜的榆树叶,实验室温度22~24℃,湿度60%,光周期为16 h光照8 h黑暗。
跗垫扫描电镜观察:将活成虫雌、雄各3头放在冰箱内-20℃冷冻1 h,取出室内解冻15 min,将雌、雄成虫足用锋利的刀切下,用70%乙醇超声清洗5 min,用70%、85%、95%和100%乙醇逐级脱水,干燥后用双面胶固定在扫描电镜观察台上,用离子溅射器喷金,应用扫描电镜(FEI-QUANTA-200)在10 kV加速电压下观察和摄影。
跗垫分泌物的提取:参考Geiselhardt等使用的方法[9]将雌、雄成虫各10头放置在干净的培养皿(直径60 mm)中,让它们自由爬行4 h,取培养皿上面盖子部分(排除虫体其它部位接触的可能,仅足部附节可以接触到)用正己烷溶剂1 mL冲洗2次,以提取粘附在上面的跗垫分泌物,将多次提取液混合后用氮气浓缩后备用。
雌、雄成虫跗垫分泌物的组分比较:通过气相色谱仪GC(HP7890A;美国Agilent公司)分别将雌、雄跗垫提取液分离后比较,色谱柱为HP-5,30m×0.32 μm×0.25 μm;进样口采用无分流模式,进样口温度320℃,隔垫吹扫流量3 mL/min,采用恒压模式,压力为 14.5 psi,检测器温度 320℃,尾吹 25 mL/min。GC升温程序:初始温度50℃(保持1 min),30℃/min升温至230℃,再以2℃/min升温至300℃(保持20 mim)。
足跗垫分泌物组分鉴定:通过气相和质谱联用仪GC-MS(Agilent 5973N;美国 Agilent公司)进行结构鉴定。首先通过离子碎片特征图来分析物质的结构,确认分子离子峰(M+)得到物质的分子质量,然后根据其它离子特征峰确定甲基的位置,最后计算物质的保留指数值[10],与文献比对后确定分子结构[11-14]。
2 结果与分析
2.1 跗垫形态特征
榆紫叶甲跗节有5节(图1)。雌雄两性第1~3跗节跗垫上都覆盖着刚毛,其中第2跗节跗垫的面积较小,第4跗节是隐藏着的,第5跗节狭长无跗垫构造。跗垫刚毛柄部都为圆柱状,依据端部的形状可分为3种类型:①矛状。端部末梢尖锐弯曲呈矛形,近端部呈扁状并有纵向的肋状纹(图2A),雌、雄两性都有分布(图1);②铲状。端部扩展呈铲状,具有2~3个细长的脊状突起,有些脊状突相互连接处呈“V”形,近端部与柄部相连处呈肘状弯曲并有纵向的肋状纹(图2B),在雌雄两性的跗垫上都有分布(图1);③盘形。端部扩展为圆盘状(图2C),盘状表面光滑无条纹,这种类型只分布在雄性跗垫上(图1)。
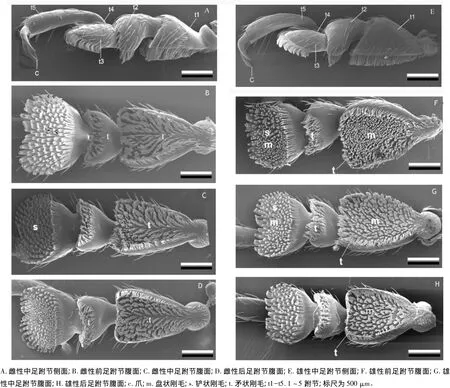
图1 榆紫叶甲跗节电镜扫描图

图2 榆紫叶甲跗垫刚毛电镜扫描图
2.2 跗垫刚毛性二型现象
雌性跗垫上只有矛状和铲状刚毛,并且前、中、后足跗垫刚毛排列是一致的,即第1跗节和第2跗节分布着矛状的刚毛;第3跗节分布着铲状刚毛(图1B-D)。雄性除了矛状和铲状刚毛外,还具有盘状刚毛,雄性前、中、后足第1和第2跗节跗垫刚毛排列是一致的,即第1跗节边缘分布着矛状刚毛,中间分布着大面积盘状刚毛;第2节的跗垫上分布着矛状刚毛。雄性前足、中足和后足的第3跗节跗垫刚毛分布存在着差异,前足第3跗节上,周围分布着铲状刚毛,中间分布着盘状刚毛和铲状刚毛2种类型(图1F、G、H);中足第3跗垫上,大部分是铲状刚毛,中间夹杂着很少的盘状刚毛(图1F,G),后足跗垫第3节全部是铲状刚毛(图1H);即雄性前足和中足的第1跗节和第3跗节具有盘状刚毛,而后足仅第1跗节具有盘状刚毛。
2.3 雌雄跗垫分泌物组分与结构
雌雄两性跗垫分泌物的正己烷提取液经GC分离后比对显示,两者都有31个相同的主要组分,即两性的跗垫分沁物的主要组分无明显的差异(图3)。经GC-MS鉴定出39个跗垫分泌物组分的结构,它们是14~36个碳的直链正烷烃及带有1~3个甲基的支链烷烃(表1)。
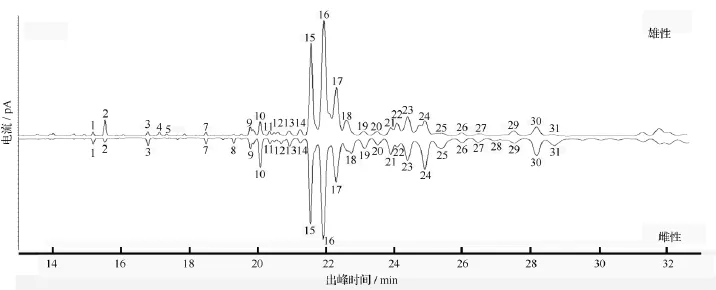
图3 榆紫叶甲雌雄两性足跗节分泌物正己烷提取物GC图谱

表1 榆紫叶甲足跗节分泌物组分结构鉴定

表1 (续)
3 结论与讨论
为了更好地附着和适应不同的寄主,不同甲虫的跗垫刚毛的结构和分布上有很大的差异[11]。榆紫叶甲跗垫着生3种类型的刚毛,这些刚毛的形态都是叶甲亚科昆虫跗垫上常见的类型,与圆叶甲属(Plagiodera)、扁叶甲属(Gastrophysa)和叶甲属(Chrysolina)的一些种类的跗垫刚毛在形态上很相似。榆紫叶甲与目前已经研究的叶甲一样,雄性跗垫比雌性多一种特有的盘状刚毛,又一次证明了叶甲科昆虫跗垫形态的这种普遍特性[12-14]。但是这种雄性特有的盘状刚毛在跗垫上的分布与其它叶甲存在差异。目前已研究的叶甲共有3种分布类型。第1种类型是盘状刚毛均匀地分布在前足、中足和后足的第1、第2和第3跗节上,如Hydrothassa marginella Linnaeus和马铃薯叶甲(Leptinotarsa decemlineata)。第2种类型是盘状刚毛大多数分布在第1跗节上,而在第2和第3跗节上分布的较少,如杨叶甲属的杨叶甲(Chrysomela populi Linnaeus)。第3种类型是盘状刚毛只分布在第1跗节上,只有少量分布在第3跗节上,如圆叶甲属的柳圆叶甲(Plagiodera versicolora)[13-14]。榆紫叶甲前足和中足的第1跗分节分布着大量的盘状刚毛,在第2跗分节上没有分布,第3跗分节上分布着较少的盘状刚毛。而后足仅第1跗节具有盘状刚毛,第2和第3跗节上都没有这种盘状刚毛。盘状刚毛在榆紫叶甲的前足和中足的分布特点与第3种类型相同,而在后足上的分布类型为榆紫叶甲所特有。
榆紫叶甲跗垫刚毛形态的性二型是与雌雄两性的行为相适应。通常跗垫刚毛的末梢首先与平面接触,所以末梢结构不同的刚毛在附着能力上会有差异[11,15-16]。Voigt等[14]对马铃薯叶甲跗垫刚毛附着能力测试显示,末梢是扁尖状的锥形刚毛在粗糙的表面的附着能力强,而末梢是扁平的盘状刚毛在光滑的表面附着能力强。榆紫叶甲雌性跗垫上着生末端尖的矛形刚毛和末端扁的铲形刚毛,它们的功能是有利于雌性在寄主植物粗糙的叶片上爬行产卵。榆紫叶甲盘状刚毛仅着生在雄性跗垫上,这有助于雄雌交尾时用足抱握住雌性光滑的鞘翅,其中雄性后足盘状刚毛只分布在第1跗节上,笔者在生测实验中观察到,雄性的后足正是用第1跗节抱住雌性鞘翅,而其他跗节是悬空的。
与其它甲虫的研究结果类似,榆紫叶甲跗垫分泌物的主要成分是一些带1~3个甲基的烷烃类,这些物质与鞘翅表皮的成分非常相似。许多甲虫鞘翅表皮的成分常常不同,并在雌雄两性的通讯中起重要的作用[17]。对叶甲亚科的Longitarsus jacobaenae研究发现,与空白对照相比,雄性会更多的停留在雌性接触过的植物叶片上[18],但目前还没有直接的证据证明是跗节分泌物参与了雌雄间的通讯过程。研究结果表明,榆紫叶甲雌雄分泌物在组分上无明显差异,推测这种分泌物只是一种润滑或是固定的物理作用,参与雌雄间通讯的可能性不大。
[1]Beutel R G,Gorb S N.Ultrastructure of attachment specializations of hexapods(Arthropoda):evolutionary patterns inferred from a revised ordinal phylogeny[J].Zoological Systematics and Evolutionary Research,2001,39:177-207.
[2]Drechsler P,Federle W.Biomechanics of smooth adhesive pads in insects:influence of tarsal secretion on attachment performance[J].J Comp Physiol A,2006,192:1213-1222.
[3]Attygalle A B,Aneshansley D J,Meinwald J,et al.Defense by foot adhesion in a chrysomelid beetle(Hemisphaerota cyanea):characterization of the adhesive oil[J].Zoology,2000,103(1/2):1-6.
[4]Geiselhardt S F,Lamm S,Gack C,et al.Interaction of liquid epicuticular hydrocarbons and tarsal adhesive secretion in Leptinotarsa decemlineata Say(Coleoptera:Chrysomelidae)[J].Comp Physiol A,2010,196(5):369-378.
[5]Aiken R B,Khan A.The adhesive strength of the palettes of males of a boreal water beetle,Dytiscus alaskanus J.Balfour Browne(Coleoptera:Dytiscidae)[J].Canadian Zoology,1992,70:1321-1324.
[6]Geiselhardt S F,Geiselhardt S,Peschke K.Comparison of tarsal and cuticular chemistry in the leaf beetle Gastrophysa viridula(Coleoptera:Chrysomelidae)and an evaluation of solid-phase microextraction and solvent extraction techniques[J].Chemoecology,2009,19:185-193.
[7]张执中.森林昆虫学[M].2版.北京:中国林业出版社,1993:286.
[8]安瑞军,李秀辉,张冬梅.榆紫叶甲生物学特性的研究[J].林业科技,2005,30(5):18-20.
[9]Geiselhardt S F,Federle W,Prüm B,et al.Impact of chemical manipulation of tarsal liquids on attachment in the Colorado potato beetle,Leptinotarsa decemlineata[J].Journal of Insect Physiology,2010,56:398-404.
[10]刘广舜.关于保留指数的探讨[J].大学化学,1987,2(6):52-54,51.
[11]Stork N E.The adherence of beetle tarsal setae to glass[J].Natural History,1983,17:583-597.
[12]Stürckow B.Über den geschmackssinn und den tastsinn von Leptinotarsa decemlineata Say(Chrysomelidae)[J].Zeitschrift Vergleichender Physiologie,1959,42:255-302.
[13]Stork N E.A scanning electron microscope study of tarsal adhesive setae in the Coleoptera[J].Zoological Linmean Society,1980,68(3):173-306.
[14]Voigt D,Schuppert J M,Dattinger S,et al.Sexual dimorphism in the attachment ability of the Colorado potato beetle Leptinotarsa decemlineata(Coleoptera:Chrysomelidae)to rough substrates[J].Journal of Insect Physiology,2008,54:765-776.
[15]Stork N E.Experimental analysis of adhesion of Chrysolina polita(Chrysomelidae:Coleoptera)on a variety of surfaces[J].Experimental Biology,1980,88:91-107.
[16]Stork N E.Adaptations of arboreal carabids to life in trees[J].Acta Phytopathologica et Entomologica Hungarica,1987,22(1/2):273-291.
[17]Ginzel M D.Hydrocarbons as contact pheromones of longhorned beetles(Coleoptera:Cerambycidae)[M]//Insect Hydrocarbons:Biology,Biochemistry,and Chemical Ecology.New York:Cambridge University Press,2010:375-389.
[18]Zhang zhiqiang,Mc Evoy P B.Attraction of Longitarsus jacobaeae males of cues associated with conspecific females(Coleoptera:Chrysomelidae)[J].Enrironmental Entomology,1994,23(3):732-737.

