糜烂性食管炎中胃蛋白酶原和胃泌素以及幽门螺杆菌抗体的检测
李 红,冯 琴,杜春辉
(1.新疆医科大学第五附属医院检验科,新疆乌鲁木齐830011;2.克拉玛依市第二人民医院检验科,新疆克拉玛依834000;3.新疆喀什地区第一人民医院检验科,新疆喀什844000)
糜烂性食管炎(erosion esophagitis,EE)发病机制复杂,可能与胃酸水平、胃泌素(gastric secretion,Gs)分泌异常、胃蛋白酶原(pepsinogen,PG)对食管黏膜损害,以及幽门螺杆菌(Helicobacter pylori,Hp)感染等诸多因素相关[1]。PG分为 PGⅠ和PGⅡ两个亚群,胃几乎是PG的惟一来源,PGⅠ和PGⅡ反映胃黏膜不同部位的分泌功能。血清PG浓度可反映胃黏膜的分泌水平[2]。以往的研究认为Hp感染是慢性活动性胃炎、消化性溃疡、胃黏膜相关淋巴组织(MALT)淋巴瘤和胃癌的主要致病因素[3-4]。本研究对EE患者同时检测血清PG和Gs以及Hp抗体,发现EE的病变程度与Hp感染、血清PG和Gs含量的变化有一定的关系。联合检测PG、Gs和Hp对临床诊断和治疗EE有帮助,现报道如下。
1 资料与方法
1.1一般资料 2011年1~6月新疆医科大学第五附属医院门诊及住院患者具有胃部灼烧感、反酸、胸骨后灼痛等症状,经内窥镜检查诊断为EE的患者90例(按照1994洛杉矶会议提出的分级标准),根据内窥镜下食管黏膜病变的严重程度分为A~D级[5]。其中A级(局限于黏膜皱襞)28例;B级(破损不连)24例;C级(破损在顶部融合,不环绕全壁)22例;D级(破损相连且环周)16例。EE患者(EE组)中男50例,女40例;平均年龄(58.67±12.13)岁。对照组80例为同期正常体检无反流症状且经内窥镜检查排除EE者。其中男42例,女38例;平均年龄(52.67±8.56)岁。两组性别、年龄比较差异无统计学意义(t=0.043 2,P>0.05),具有可比性。
1.2方法 取受检者清晨空腹静脉血5mL,分离血清迅速冻存于-20℃冰箱中待检。采用乳胶增强免疫比浊法在全自动生化分析仪上测定血清中的PGⅠ、PGⅡ和Gs,同时计算出PGⅠ/PGⅡ比值PGR。另外采用酶联免疫法定性分析血清抗Hp IgG抗体,按照试剂盒说明书操作。所有试剂由北京九强生物技术有限公司提供。
1.3统计学处理 采用SPSS11.5统计软件进行数据分析。计量资料先行数据的正态性检验及方差齐性检验。正态分布数据用两组独立样本t检验。结果用s表示。非正态分布数据以中位数表示,行秩和检验,以P<0.05为差异有统计学意义。
2 结 果
2.1EE组各分级患者与对照组血清PG、Gs含量及PGR比较 EE组分级越高的患者PGⅠ和Gs的含量越低,EE组A级PGⅠ、PGⅡ含量和PGR值以及Gs与对照组比较,差异无统计学意义(P>0.05);EE组B~D级PGⅠ含量和PGR值以及Gs分别与对照组比较,差异有统计学意义(P<0.01),而各级PGⅡ含量分别与对照组间比较,差异无统计学意义(P>0.05)。EE组D级PGⅡ含量与B、C级比较,差异有统计学意义(P<0.01,P<0.05)。分级组间PGⅠ含量和PGR值以及Gs比较,差异有统计学意义(P<0.01);分级组间PGⅡ含量比较,差异无统计学意义(P>0.05)。见表1。
表1 各组间血清PG、PGR和Gs指标比较(s)
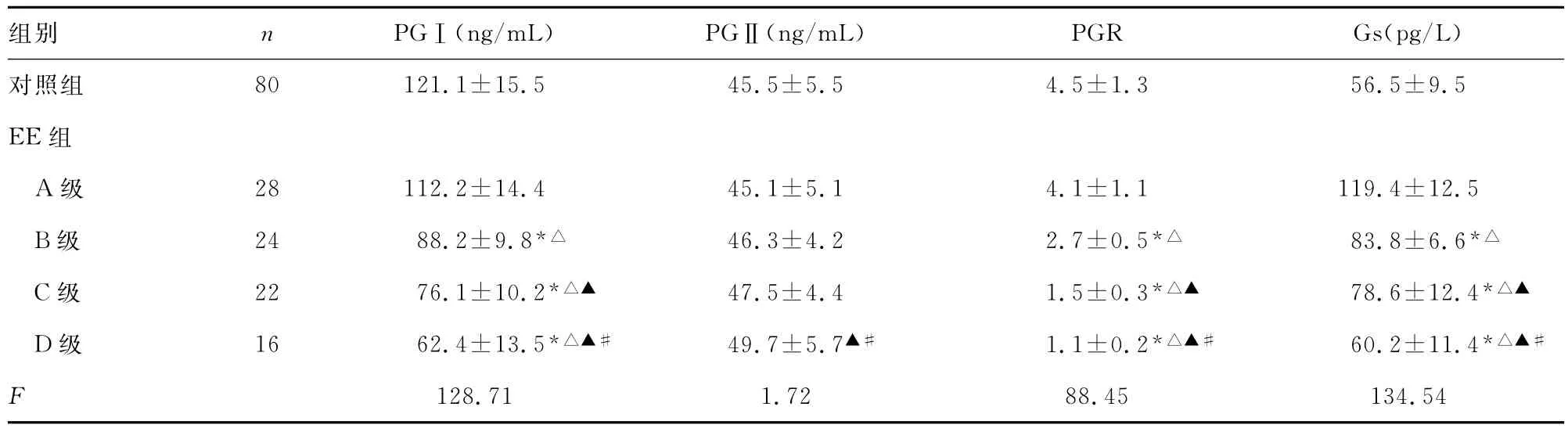
表1 各组间血清PG、PGR和Gs指标比较(s)
*:P<0.01,与对照组比较;△:P<0.01,与EE组A级比较;▲:P<0.01,与EE组B级比较,#:P<0.05,与EE组C级比较。
组别 n PGⅠ(ng/mL)PGⅡ(ng/mL)PGR Gs(pg/L)80 121.1±15.5 45.5±5.5 4.5±1.3 56.5±9.5 EE组A级 28 112.2±14.4 45.1±5.1 4.1±1.1 119.4±12.5 B级 24 88.2±9.8*△ 46.3±4.2 2.7±0.5*△ 83.8±6.6*△C级 22 76.1±10.2*△▲ 47.5±4.4 1.5±0.3*△▲ 78.6±12.4*△▲D级 16 62.4±13.5*△▲# 49.7±5.7▲# 1.1±0.2*△▲# 60.2±11.4*△▲#F对照组128.71 1.72 88.45 134.54
2.2EE组各分级患者与对照组血清抗Hp抗体比较 对照组血清抗Hp抗体阳性比例比EE组高,两组比较差异有统计学意义(P<0.01)。对EE组不同分级之间血清抗Hp抗体阳性比例比较,可见EE的分级越高血清抗Hp抗体阳性比例越高,但不同分级之间血清抗Hp抗体阳性比例比较,差异无统计学意义(P>0.05),见表2。

表2 各组间血清抗Hp抗体阳性比例比较
3 讨 论
EE发病呈上升趋势[6],究其原因是抗反流屏障减弱,反流物在食管暴露时间较长,加上组织抵抗力下降等诸多因素造成[7-9],尽早的诊疗是治愈此类疾病的关键。血清PG和Gs均为正常胃黏膜腺体所分泌,其血清含量异常代表腺体分泌功能发生变化。Gs可促进胃酸分泌,Gs和PG水平的检测作为胃部疾患,特别是早期胃癌的普查,以及萎缩性胃炎、胃癌前期病变及溃疡的评价已得到临床医生的广泛关注和认可。血清Gs和PG水平与EE的关系尚无定论。本研究发现EE分级越高的患者PGⅠ的含量越低,且Gs的含量减少,而PGⅡ的含量没有显著性差别。这可能是由于EE分级越高的患者病变广泛,黏膜糜烂融合的范围较大造成食管黏膜细胞损伤严重,累及胃黏膜腺体细胞分泌Gs降低。同时PG转化成有活性的胃蛋白酶(主要为PGⅠ)的含量相对减少。而PGⅡ的含量不仅有胃黏膜主细胞及颈黏液细胞分泌,还有胃窦及Brunner腺等合成[10-13],所以PGⅡ在血液中含量变化不大。
本研究结果证实,EE的A~D级患者Hp的阳性比例逐渐增加,同时PGⅠ和Gs含量逐渐减少。本研究认为是由于胃蛋白酶在酸性环境中具有较高活性,在中性或碱性溶液中,胃蛋白酶会发生解链而丧失活性。当Hp感染可导致胃酸分泌减少。同时Hp感染可产生尿素酶,此酶分解尿素产生氨,氨可中和胃酸,胃内pH值升高可减缓食管黏膜酸暴露,PG的活化减少,因此PGⅠ含量降低,PGR比值相应降低[14-15],并且胃酸含量的降低也是Gs分泌减少造成的结果所致。这些结果表明EE分级越高的患者糜烂病变程度加重与Hp感染呈正相关,即EE患者Hp感染是起到保护作用,可抑制EE的复发。联合检测血清PG和Gs含量以及抗Hp抗体对EE的诊疗意义重大,应引起临床医生高度重视。
[1]王睿,贺佳.胃食管反流病的流行病学研究进展[J].第二军医大学学报,2006,27(7):733-735.
[2]Fujiwara Y,Arakawa T.Epidemiology and clinical characteristics of GERD in the Japanese population[J].J Gastroenterol,2009,44(6):518-534.
[3]王祈.幽门螺杆菌感染与胃食管反流病关系的研究[J].胃肠病学杂志,2010,19(1):74-75.
[4]Yaghoobi M,Farrokhyar F,Yuan Y,et al.Is there an increased risk of GERD after Helicobacter pylori eradication?a meta-analysis[J].Am J Gastroenterol,2010,105(5):1007-1013.
[5]罗金燕.胃食管反流病的临床类型及表现[J].现代消化及介入诊疗,2011,16(1):41-42.
[6]赵伯维.胃食管反流病患者幽门螺杆菌感染情况分析[J]中国医刊,2011,46(3):45-47.
[7]Merta HR,Peterson WC,Walsh JH.Familial hyperpepsinogenemia and helicobacter pylori infection[J].Am J Gastmenteml,2009,95(10):943-946.
[8]EEnte S,Doiz O,Trinidad Serrano M,et al.Helieobaeter pyloristimulates pepsinogen secEEtion from isolated human peptic cells[J].Gut,2009,50(2):13-18.
[9]Santa L,Gabfielli M,Santoliquido A,et al.Interaction between helicobacter pylofi infection and untEEated coeliac on gastric pattern[J].Gastmenterol,2006,41(5):532-535.
[10]刘家云,陈名声,苏明权,等.血清胃蛋白酶原、促胃液素对胃癌的诊断价值[J].现代检验医学杂志,2007,22(3):19-21.
[11]北宁,杨剑,徐东.胃蛋白酶原Ⅰ、Ⅱ的酶免疫分析[J].标记免疫与临床,2006,13(3):162-163.
[12]马颖杰,王惠吉.血清胃蛋白酶原与良、恶性溃疡[J].临床和实验医学杂志,2007,6(5):24-25.
[13]陈瑜.血清胃蛋白酶原浓度可作为胃酸分泌的检测指标[J].胃肠病学,2006,2(4):348-350.
[14]Dunn BM.EE and mechanism of the pepsin-like family 0f aspartic peptidases[J].Chem EEv,2002,102(8):4431-4458.
[15]Adhami T,Goldblum JR,Richter JE,et al.The role of gastric and duodenal agents in laryngeal injury:an experimental canine model[J].Am J Gastroenterol,2009,99(11):2098-2106.

