3,6-二羟黄酮抗乳腺癌发生过程中miRNA表达谱的变化*
常 徽,王 湛,谢 艳,糜漫天
(第三军医大学营养与食品安全研究中心/重庆市营养与食品安全重点实验室,重庆400038)
微RNA(microRNA,miRNA)是小RNA的一种,可与其靶RNA的3′端非特异区结合,引起靶信使RNA(mRNA)的翻译抑制或降解。研究发现,某些miRNA在肿瘤的发生和发展过程中扮演非常重要的角色,起到癌基因或抑癌基因的作用[1-3]。miRNA的发现与研究为乳腺癌的防治提供了新的途径[4-6]。植物黄酮抗肿瘤作用研究一直受到关注,但其抗肿瘤机制是否涉及对miRNA表达和功能的影响,国内外尚少见报道。本研究前期药效学筛选试验发现3,6-二羟黄酮具有很强的抗肿瘤作用[7-9],但其体内抗肿瘤发生效应尚缺乏研究。本研究观察3,6-二羟黄酮对 N-甲基-N-亚硝脲(MNU)诱导大鼠乳腺癌发生的抑制作用,同时利用基因芯片技术检测大鼠乳腺组织miRNA表达谱的变化,现报道如下。
1 材料与方法
1.1材料 6~7周龄健康雌性SD大鼠,体质量145~165g,由第三军医大学实验动物中心提供[scxk(军)2007015],饲养于SPF动物实验室。雌性SD大鼠依照完全随机设计原则均分为自然对照、模型对照和实验组,自然对照组8只,模型对照和实验组各14只。MNU和3,6-二羟黄酮购自Sigma公司,Trizol为Invitrogen公司产品,GeneChip®miRNA芯片及相关试剂盒均为美国Affymetrix公司产品,本芯片覆盖了71个物种的miRNA,针对7 815个 miRNA设计了共计46 228个探针,数据来自 Sanger miRBase miRNA database V11(http://microrna.sanger.uk)。
1.2方法
1.2.1动物处理 实验组给予3,6-二羟黄酮灌胃(20mg·kg-1·d-1),两对照组给予生理盐水灌胃,实验组和模型对照组一次注射MNU 50mg/kg,制造乳腺癌动物模型,自然对照组注射生理盐水,分组喂养18周,观察各组肿瘤发生率。另取雌性SD大鼠,以前述方法分组和处理,每组12只,分别于MNU注射0、4、8、18周取材,提取乳腺组织总RNA并分离miRNA,通过芯片扫描和数据分析获得miRNA表达谱。
1.2.2乳腺组织总RNA的提取 剪取大鼠乳腺组织0.1g,制备组织匀浆,利用Trizol试剂抽提数次,常规提取总RNA。每个样品取1μL,ddH2O稀释200倍后用核酸蛋白定量仪测定RNA含量与纯度。整个过程所有使用的器械及液体均经0.1%焦碳酸二乙酯(DEPC)水处理,戴消毒手套操作,防止RNA酶污染。
1.2.3miRNA表达谱的检测 取50~100μg总RNA,利用miRNA Isolation Kit分离小 RNA,采用PolyA Polymerase加尾,利用T4RNA连接酶将带有生物素标记的信号分子与之连接,进行标记,然后将生物素标记的小分子RNA溶于16μL杂交液中[15%甲酰胺,0.2%聚丙烯酰胺(SDS),3×柠檬酸钠缓冲液(SSC),50×纯化试剂(Denhardts)]。于42℃与微阵列杂交过夜。杂交结束后,微阵列玻片于42℃下用含0.2%SDS的2×SSC漂洗4min,再在0.2×SSC室温漂洗4min。玻片甩干后,用LuxScan 10K/A双通道激光扫描仪进行扫描,采用微阵列显著点分析(SAM)2.1版软件分析有统计学意义的差异表达位点。
1.3统计学处理 采用SPSS13.0统计软件进行单因素方差分析,肿瘤发生率的比较采用χ2检验,两组间差异比较采用t检验,所有数据均以s表示,以P<0.05为差异有统计学意义。
2 结 果
2.13,6-二羟黄酮膳食干预对乳腺癌发生的抑制作用 实验结束时,3组大鼠之间体质量差异无统计学意义,表明3,6-二羟黄酮膳食处理对大鼠无明显毒副作用。自然对照组大鼠无乳腺肿瘤发生。与模型对照组相比,实验组乳腺肿瘤发生率降低了35.8%,显著低于模型对照组,表明3,6-二羟黄酮膳食处理能够显著抑制化学致癌剂MNU诱导的大鼠乳腺肿瘤发生,见表1。
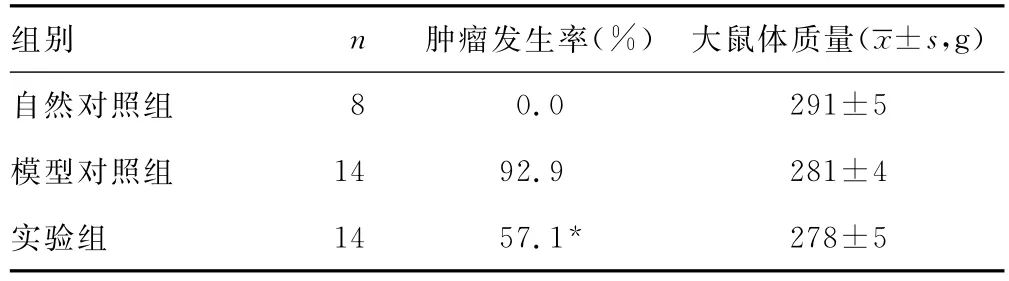
表1 3组膳食干预对MNU诱导大鼠乳腺肿瘤发生率及体质量的影响
2.2大鼠乳腺肿瘤发生过程中miRNA表达谱的变化及3,6-二羟黄酮膳食干预的影响 miRNA芯片检测结果表明,致癌剂MNU注射后,大鼠乳腺组织miRNA表达谱发生显著变化,其中MNU注射4周时,模型对照组检测到11个miRNA表达显著上调,18个miRNA表达显著下降;8周时12个miRNA表达显著上调,17个显著下降;18周时17个显著上调,18个显著下降,见表2。与模型对照组相比,实验组4周时检测到10个miRNA表达显著上调,9个miRNA表达显著下降;8周时15个miRNA表达显著上调,10个显著下降;18周时11个显著上调,12个显著下降,见表3。这些miRNA可能在3,6-二羟黄酮抗乳腺癌发生过程中发挥作用。

表2 MNU诱导大鼠乳腺肿瘤发生过程中miRNA表达谱的变化

表3 与模型对照组相比实验组大鼠miRNA表达谱的变化
3 讨 论
植物黄酮为一类天然植物多酚化合物,具有抗氧化、抗炎症、抗肿瘤等生物学效应,特别是其抗肿瘤活性以其天然、低毒、高效而备受关注[10-11]。本研究前期药效学筛选实验发现,3,6-二羟黄酮具有很强的体外抗肿瘤活性,对乳腺癌细胞、结肠癌细胞、前列腺癌细胞、白血病细胞均表现出强细胞毒性和凋亡诱导作用[7-9]。3,6-二羟黄酮的抗肿瘤作用国内外尚少见报道,特别是其体内抗肿瘤效应如何尚不清楚。MNU诱导大鼠乳腺癌发生是研究乳腺癌发生的经典动物模型,本课题利用此动物模型观察了3,6-二羟黄酮抗乳腺癌发生的效应,结果表明,3,6-二羟黄酮膳食干预可显著抑制致癌剂诱导的大鼠乳腺肿瘤发生,显示出较强的乳腺癌化学预防作用。
miRNA是一类由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子,它可以抑制蛋白质翻译,剪切mRNA,调节靶基因的表达,在动植物中参与转录后基因表达调控。越来越多的研究表明,miRNA参与包括肝癌、肺癌、乳腺癌、结肠癌及白血病在内的多种肿瘤的发生、发展[12-13]。乳腺癌是女性最常患的一种肿瘤,男性由于缺乏对乳腺癌的免疫能力,同样容易罹患此病。有研究发现作为抑癌基因和原癌基因的乳腺癌特异性miRNA,在乳腺癌发生、发展中的作用对于防治乳腺癌具有重要意义[14-15]。
植物黄酮抗乳腺癌作用机制中是否涉及对miRNA表达和功能的影响,尚少见报道,本实验研究发现,3,6-二羟黄酮抗乳腺癌发生过程中,伴随着miRNA表达谱的改变,提示某些miRNA可能在3,6-二羟黄酮抗乳腺癌作用机制中扮演重要角色,黄酮化合物可能通过调节miRNA的表达进而影响某些关键靶蛋白的活性。本研究结果对深入探讨miRNA在植物黄酮抗肿瘤机制中的作用提供了参考。
[1]刘展,张明亮,李毅妮,等.siRNA抑制p63基因表达对胆管癌细胞增殖和侵袭的影响[J].南方医科大学学报,2012,32(2):207-210.
[2]姜昌丽,王惠萱.微小RNA在结直肠癌中的研究进展[J].国际检验医学杂志,2011,32(3):355-357.
[3]Hui C,Yujie F,Lijia Y,et al.MicroRNA-34aand microRNA-21play roles in the chemopreventive effects of 3,6-dihydroxyflavone on 1-methyl-1-nitrosourea-induced breast carcinogenesis[J].Breast Cancer Res,2012,14(3):R80.
[4]孙晓飞.miRNA与乳腺癌[J].医学信息:下旬版,2009,22(9):269-270.
[5]李川,马纪,张越,等.慢病毒介导的shRNA靶向干扰nestin鼻咽癌稳定细胞株的建立[J].南方医科大学学报,2011,31(4):604-609.
[6]梁艳,李涛,周克元.慢病毒载体在RNA干扰中的应用进展[J].国际检验医学杂志,2010,31(11):1282-1284.
[7]Chang H,Lin H,Yi L,et al.3,6-Dihydroxyflavone induces apoptosis in Leukemia HL-60Cell via reactive oxygen species-mediated p38MAPK/JNK pathway[J].Eur J Pharmacol,2010,648(1):31-38.
[8]Chang H,Mi M,Ling W,et al.Structurally related anticancer activity of flavonoids:involvement of reactive oxygen species generation[J].J Food Biochem,2010,34(s1):1-14.
[9]Chang H,Mi M,Ling W,et al.Structurally related cytotoxic effects of flavonoids on human cancer cells in vitro[J].Arch Pharm Res,2008,31(9):1137-1144.
[10]Chang H,Yu B,Yu X,et al.Anti-cancer activities of an anthocyanin-rich extract from black rice against breast cancer cells in vitro and in vivo[J].Nutr Cancer,2010,62(8):1-9.
[11]Theodoratou E,Kyle J,Cetnarskyj R,et al.Dietary flavonoids and the risk of colorectal cancer[J].Cancer Epidemiol Biomarkers Prev,2007,16(4):684-693.
[12]Kim YK,Kim VN.Processing of intronie microRNAs[J].EMBO J,2007,26(3):775-783.
[13]Filipowicz W,Bhattacharyya SN,Sonenberg N.Mechanisms of posttranscriptiona1regulation by microRNAs:are the answers insight?[J].Nat Rev,2008,9(2):102-114.
[14]孙建国,廖荣霞,周度金,等.基于基因芯片的乳腺癌干细胞 miRNAs检测分析[J].重庆医学,2007,36(13):1280-1282.
[15]黄秀芳,邵建永,颜黎栩,等.乳腺癌差异表达的miRNA的筛选研究[J].中山大学学报,2009,30(1):69-73.

